临床常见干扰因素对ctDNA EGFR T790M突变检测的影响
姜文容, 缪应新, 王 粟, 王诗雯, 赵 虎, 张艳梅
(复旦大学附属华东医院检验科,上海 200040)
我国的肺癌发病数和死亡数已位居世界首位,其中非小细胞肺癌(non-small cell lung carcinoma,NSCLC)可占90%以上[1]。表皮生长因子受体(epidermal growth factor receptor,EGFR)基因突变与NSCLC患者对靶向治疗药物EGFR酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitor,EGFRTKI)的疗效密切相关。EGFR的T790M突变作为重要的获得性耐药突变,约占所有耐药基因突变的50%[2],是EGFR-TKI重要的疗效监测和预后判断指标。然而,耐药患者往往无法通过2次活检取得组织样本用于T790M突变检测。此时,血浆循环肿瘤DNA(circulating tumor DNA,ctDNA)就是此类患者的最佳检测标志物。ctDNA由肿瘤细胞释放入血,携带高特异的肿瘤标记[3],且兼具实时、均质、创伤小、易获取等优点[4]。然而,ctDNA在血中含量极低,检测时对样本的要求极高[5],而且,临床血液样本往往存在多样性,检测结果的准确性可受患者状态和干扰物等多种干扰因素影响。血红蛋白、胆红素和三酰甘油作为临床最常见的干扰因素[6],对检测ctDNAEGFRT790M突变的影响尚未见相关报道。本研究检测各种模拟干扰血浆的ctDNAEGFRT790M突变的状况,旨在确认三酰甘油、胆红素和血红蛋白对检测ctDNAEGFRT790M的影响。
1 材料和方法
1.1 材料
1.1.1 样本 收集7例经超级突变扩增阻滞系统(super amplification refractory mutation system,Super-ARMS)确认T790M为野生型的正常献血者血浆,共计1 L。T790M突变型质粒载体选用PUC57,T790M突变序列来源于美国国立生物技术信息中心(the National Center for Biotechnology Information,NCBI),由生工生物工程(上海)股份有限公司完成质粒构建。1.1.2 仪器与试剂 NanoDrop One微量分光光度计和ABI 7500实时荧光PCR仪均购自美国Thermo Fisher Scientific公司。核酸抽提试剂盒(AmoyDx离心柱型循环DNA型核酸提取试剂)和T790M突变检测试剂盒(AmoyDxEGFR基因T790M突变检测试剂)均购自厦门艾德生物医药有限公司;干扰物人血红蛋白(美国Sigma公司,CAS9008-02-0,5 g)购自上海新睿生物科技有限公司;胆红素(中国食品药品检定研究院,100077-201607,300 mg)及三酰甘油(上海源叶生物科技有限公司,CAS538-24-9,5 g)均购自上海源叶生物科技有限公司。
1.2 方法
1.2.1 T790M突变型血浆的制备 将7例经Super-ARMS确认EGFRT790M为野生型的正常献血者血浆混合,制备空白对照血浆,以空白对照血浆为基础,添加不同浓度T790M突变型质粒模拟突变型血浆样本,以此作为空白组。根据检测试剂盒灵敏度选取T790M质粒浓度10拷贝/μL作为临界阳性突变样本;根据试剂盒质控品选取500拷贝/μL作为强阳性突变样本。
1.2.2 不同浓度单干扰物突变型血浆的制备 以制备的T790M突变型血浆为基础,添加不同浓度干扰物制备单一干扰物突变型血浆样本。各干扰物添加浓度最高值根据《WS/T 416-2013 干扰实验指南》[7]附表C“常见内源性干扰物的建议实验浓度”确认,即胆红素为342 μmol/L、血红蛋白为2 g/L、三酰甘油为37 mmol/L。根据“干扰物剂量效应评价实验”制备4个梯度浓度单干扰物血浆样本,即低干扰血浆(低干扰组)、中度干扰血浆(中度干扰组)、较高干扰血浆(较高干扰组)及高干扰血浆(高干扰组)。各组单一干扰物突变型血浆的干扰物浓度见表1。
1.2.3 DNA浓度及纯度检测 采用AmoyDx离心柱型循环DNA型核酸提取试剂抽提DNA,严格按照产品说明书操作。采用NanoDrop One微量分光光度计检测抽提样本的DNA浓度与纯度。DNA纯度以样本在260 nm和280 nm波长处的紫外吸光度比值(A260/A280)表示。A260/A280在1.6~1.8范围,说明抽提样本DNA纯度高;A260/A280>1.8提示有RNA污染;A260/A280<1.6,则提示可能存在蛋白质的污染[8]。
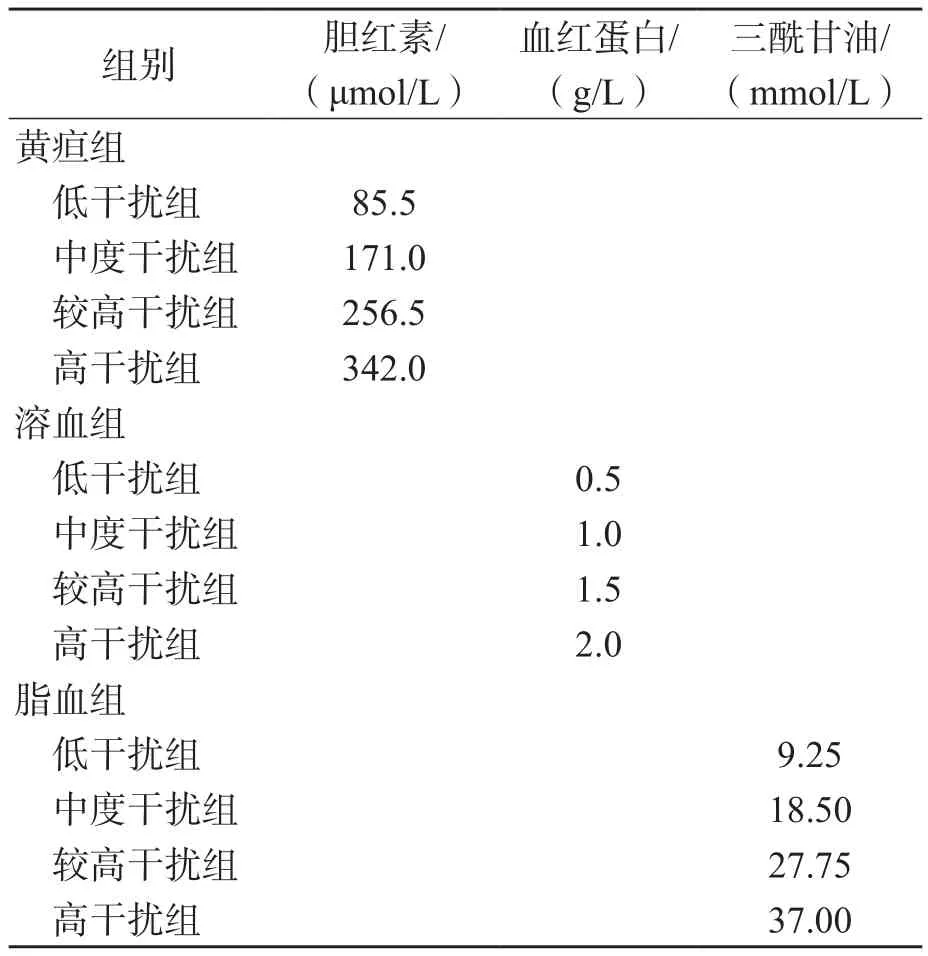
表1 各组单一干扰物突变型血浆干扰物质浓度
1.2.4 T790M突变检测 抽提所得的DNA严格依照AmoyDxEGFR基因T790M突变检测试剂说明书步骤进行检测。取出P-T790M反应液A、B、P-T790M混合酶和P-T790M阳性对照,充分解冻后振荡混匀,快速离心15 s后待用。根据检测样本例数(n)配制反应混合液,实际应配制(n+2.5)例反应混合液以减少分液误差。每例样本按60 μL反应液A、5 μL反应液B和0.4 μL混合酶的比例配制,振荡混匀15 s,快速离心15 s,以每管65.4 μL的量分装到聚合酶链反应(polymerase chain reaction,PCR)反应管中。分别加入需要检测的样品15 μL、P-T790M阳性对照15 μL和纯化水15 μL,盖上PCR管盖后离心数秒。将PCR反应管放置于ABI 7500实时PCR仪中进行T790M突变检测。反应条件为:95℃ 10 min,1个循环;95℃ 40 s,64℃ 40 s,72℃ 30 s,15个循环;93℃ 40 s,60℃ 45 s,72℃ 30 s,28个循环。
1.2.5 结果分析 按照试剂盒说明书要求,在阴性质控品和阳性质控品均合格且待测ctDNA样本内控Ct值<19的情况下判定检测结果。计算ΔCt值(ΔCt值= Ct值FAM- Ct值VIC),当ΔCt值<8时,则该样品为T790M突变阳性,反之则为阴性。
1.3 统计学方法
采用SPSS 22.0软件进行统计分析,呈正态分布的计量数据以±s表示,2个组间的比较采用配对t检验,多组间的比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 各干扰物对抽提样本DNA浓度的影响
临界阳性突变样本的DNA浓度受胆红素(≥85.5 μmol/L)及三酰甘油(≥9.25 mmol/L)的显著干扰(P<0.05),其余各组抗干扰能力均较强。强阳性突变样本除受低浓度胆红素(85.5 μmol/L)及高浓度血红蛋白(2.0 g/L)干扰外,其余各组抗干扰能力均较强(P<0.05)。各干扰物不同浓度组间的干扰效果无明显差异(P>0.05)。见表2。
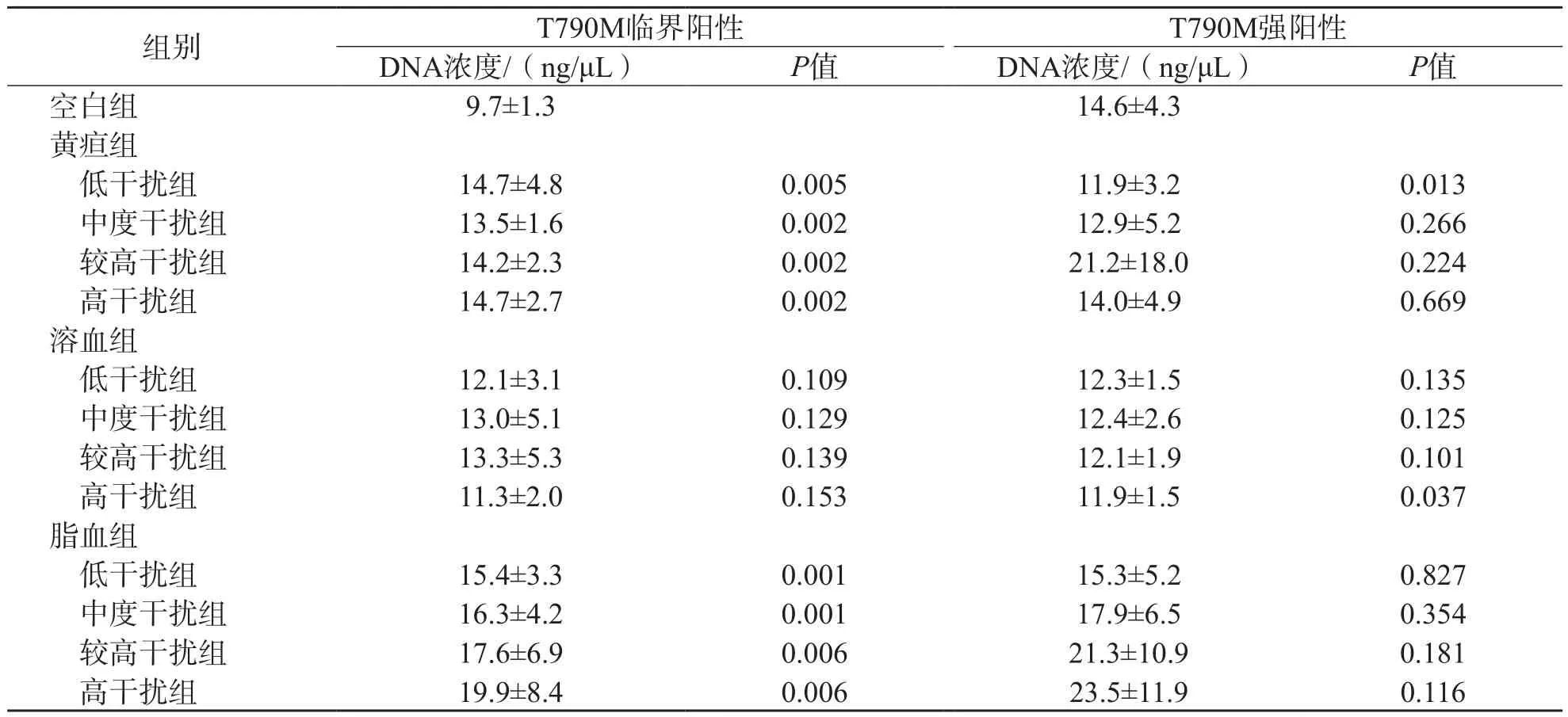
表2 不同浓度干扰物对抽提样本DNA浓度的影响
2.2 各干扰物对抽提样本DNA纯度的影响
临界阳性突变样本的DNA纯度几乎不受干扰物的影响(P>0.05)。强阳性突变样本的DNA纯度不易受胆红素干扰影响(P>0.05),但明显受三酰甘油(≥9.25 mmol/L)和血红蛋白(0.5~1.5 g/L)的影响(P<0.05),脂血组各浓度三酰甘油和溶血组各浓度血红蛋白的干扰效果无明显差异(P>0.05)。见表3。
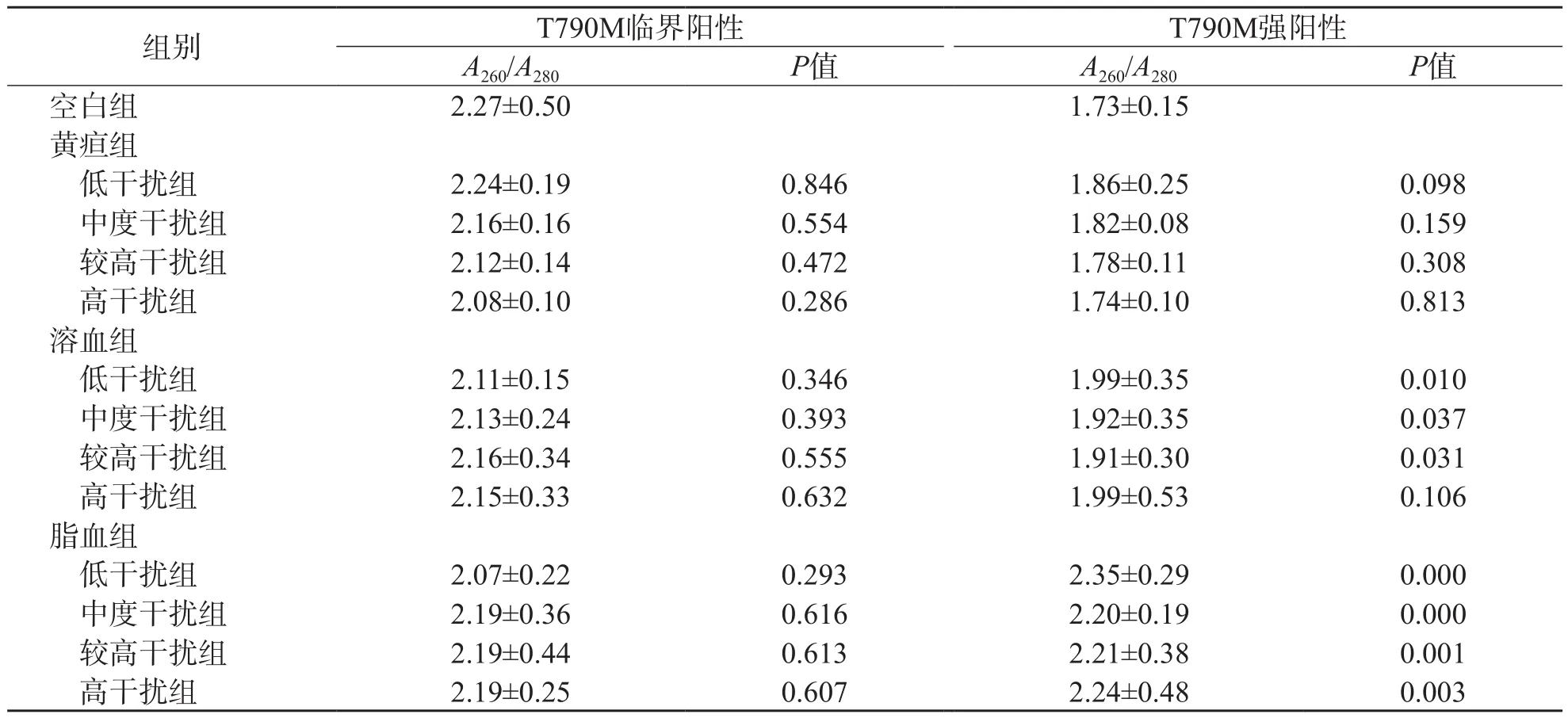
表3 不同浓度干扰物对抽提样本DNA纯度的影响
2.3 各干扰物对T790M突变检测内控Ct值的影响
内控Ct值可综合反映待检测ctDNA的含量与质量。三酰甘油(≥9.25 mmol/L)对临界阳性及强阳性T790M突变样本的内控Ct值均可产生较大影响(P<0.05),且各浓度三酰甘油产生的影响无明显差异(P>0.05)。此外,强阳性T790M突变样本的内控Ct值还可受较高浓度胆红素(≥256.5 μmol/L)干扰(P<0.05),但各浓度胆红素干扰效果的差异无统计学意义(P>0.05)。见表4。
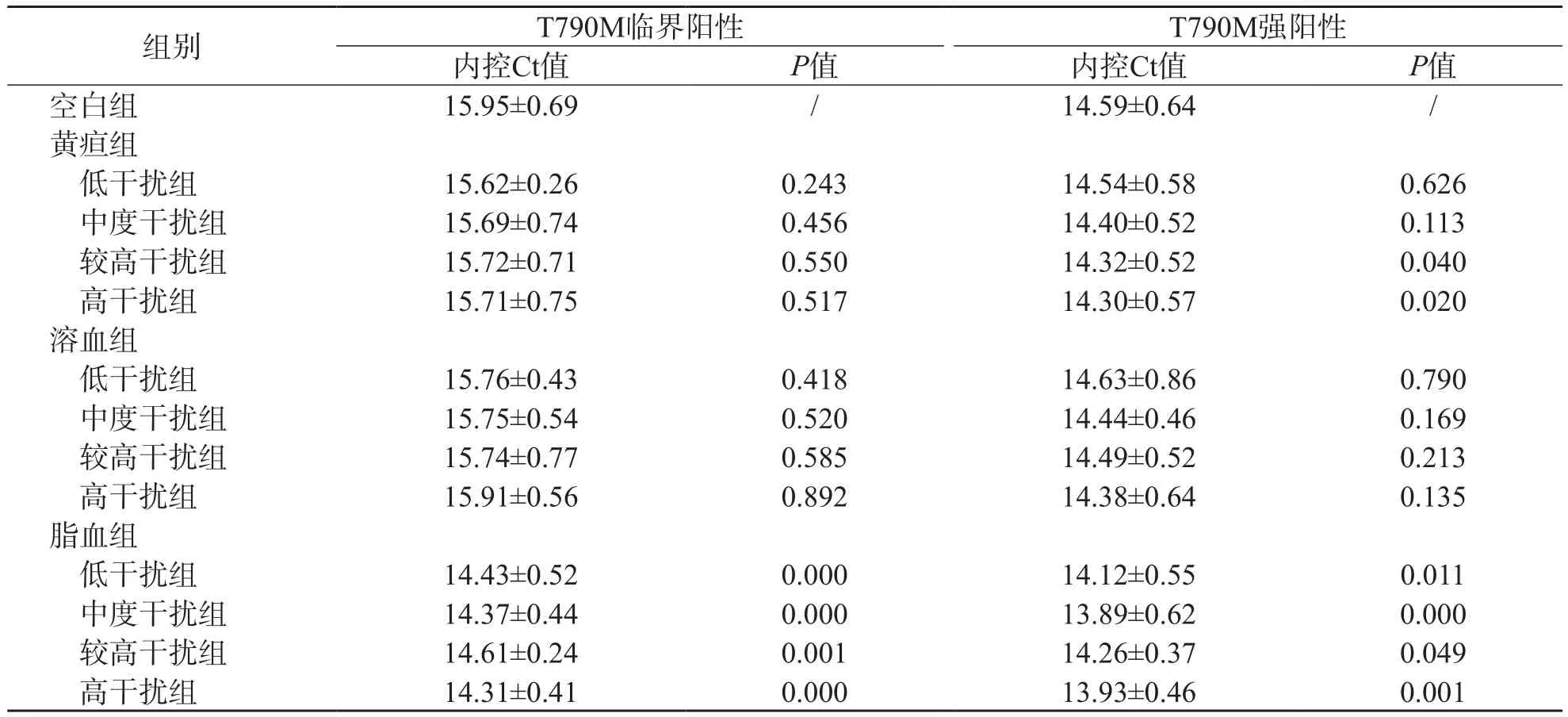
表4 不同浓度干扰物对T790M突变检测值内控Ct值的影响
2.4 各干扰物对T790M突变检测突变ΔCt值的影响
突变ΔCt值可反映T790M突变丰度,与突变丰度成反比。临界阳性突变样本的突变ΔCt值极易受三酰甘油(≥9.25 mmol/L)干扰(P<0.05),且各浓度三酰甘油的干扰效果无明显差异(P>0.05)。强阳性突变样本的突变ΔCt值不受胆红素干扰(P>0.05),但可受三酰甘油(9.25~27.75 mmol/L)及中等浓度血红蛋白(≥1.0 g/L)干扰(P<0.05),且其各浓度影响效果的差异无统计学意义(P>0.05)。见表5。
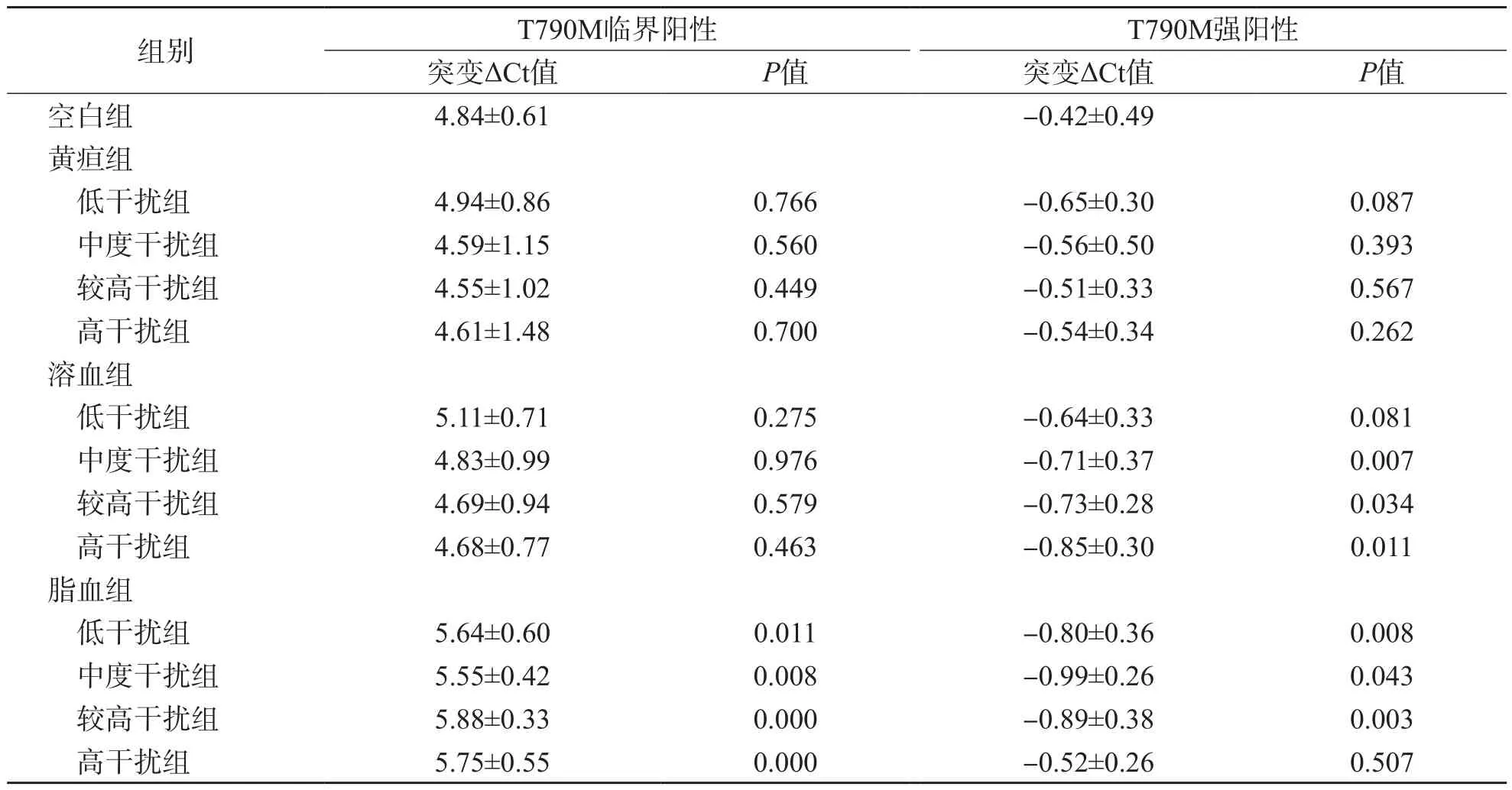
表5 不同浓度干扰物对T790M突变检测突变ΔCt值的影响
3 讨论
EGFR基因突变是亚裔NSCLC患者最常见的驱动基因突变,突变率为30%~40%[4],可用于预测EGFR-TKI靶向药物的治疗效果。然而,接受一、二代EGFR-TKI治疗的患者通常会在治疗后的9~13个月出现耐药[9],其中约50%的患者是由于EGFR的T790M突变所致[2]。奥希替尼作为第三代EGFR-TKI靶向药物,可选择性抑制T790M突变的NSCLC,为一、二代EGFR-TKI获得性耐药患者带来了福音。因此,T790M突变检测对于EGFR-TKI的疗效监测及耐药后的后续治疗选择至关重要。
目前,临床用于T790M突变检测的样本仍首选手术或活检采集的组织样本,但其样本获取不易、范围局限、异质性大、操作创伤大[10],因此对于无法通过2次手术或活检取得组织样本的耐药患者而言,血浆ctDNA是其检测的最佳标志物。ctDNA由循环肿瘤细胞、肿瘤原发或转移灶等凋亡和坏死后释放入血,携带有肿瘤的高特异性标记,同时能够均化肿瘤的异质性,更好地反映患者全身的肿瘤状况。临床研究证实,组织样本与血浆样本EGFR突变检测具有高度一致性[11],且EGFR-TKI耐药后T790M突变血浆检测阳性患者与组织检测阳性患者接受奥希替尼治疗具有相似的临床获益[12]。Super-ARMS作为目前临床运用最广泛的EGFR基因检测方法,可快速、准确地检测ctDNA中0.2%~0.8%的突变[13],因而本研究利用Super-ARMS检测临床常见干扰物对ctDNAEGFRT790M突变的影响。
在Super-ARMS检测的过程中,抽提样本的DNA质量直接关系到后续检测的准确性。紫外分光光度法是目前临床DNA质量鉴定的首选方法,也是行业公认的标准[8],故本研究采用该方法对抽提的样本DNA进行检测和评估。但也需考虑到该方法可能的弊端,例如样本的DNA浓度过低或存在其他物质的污染等均可能对检测的准确性造成一定影响。所以,在结果分析时需综合考虑浓度及纯度2个参数。
除此之外,实验室检验前的质量控制对检验结果的准确性更为重要[14]。由于临床血液样本常存在溶血、脂血及黄疸等状况,不可避免地会对各种检测方法产生干扰,影响结果的准确性。已有研究证实,胆红素、血红蛋白和三酰甘油等干扰物质可降低PCR扩增效率,从而影响检测的准确性[6]。
溶血是临床检验工作中最常遇到的问题,可由抽血操作不当、样本剧烈振荡等原因导致[15]。本研究发现,溶血可影响抽提样本的DNA浓度、DNA纯度及T790M突变检测的突变ΔCt值,其可能的原因为溶血时红细胞释放的大量酶类及血红蛋白可对抽提及PCR过程造成影响。血红蛋白是存在于红细胞内的主要PCR抑制物,通过卟啉环可与Taq酶发生不可逆结合抑制其活性,或者通过释放铁离子干扰DNA合成,进而抑制PCR反应以产生干扰作用[16]。
黄疸主要因患者血液中胆红素的大量堆积所致。本研究发现,黄疸可影响抽提样本的DNA浓度和T790M突变检测的内控Ct值,其可能原因为胆红素作为血红蛋白的衍生物,也具有与血红蛋白类似的PCR抑制作用[16]。
脂血主要是因为血液中乳糜微粒的增多所致,人乳糜微粒中84%~88%为三酰甘油,故三酰甘油水平能够客观反映脂血程度[17]。本研究发现,脂血可影响ctDNAEGFRT790M突变检测中的各项参数,干扰影响较溶血及黄疸更显著。造成该干扰的原因可能是三酰甘油能够通过光散射效应影响紫外分光光度法检测DNA浓度及纯度;光散射效应还能导致荧光淬灭,降低荧光信号强度,影响实时荧光定量PCR检测结果的判读[18]。此外三酰甘油还可通过抑制Taq酶活性,降低PCR扩增效率[19]。
综上所述,本研究发现,临床常见的溶血、脂血和黄疸对Super-ARMS检测血浆ctDNAEGFRT790M突变过程中的各项参数存在不同程度的干扰。因此,临床应用此类样本时应尽量做好样本的检验前质量控制,同时检验过程中应结合样本的具体情况进行全面的分析和解读,为临床诊疗提供更加精准的实验室参考依据。

