百香果果胶及其辛烯基琥珀酸酯化物对酸化脱脂乳饮料稳定性的影响
李帅,艾连中,张汇,宋子波,赖凤羲*
1(上海理工大学 医疗器械与食品学院,上海食品微生物工程技术研究中心,上海,200093) 2(云南猫哆哩集团食品有限责任公司,云南 玉溪, 653100)
果胶是一种酸性多糖,由超过65%的半乳糖醛酸组成,还含有一些中性糖以及少量的蛋白质和酚类物质。果胶按照其酯化度的不同分为高甲氧基果胶和低甲氧基果胶,自然界中绝大部分果实中存在的果胶都是高甲氧基果胶(即高脂果胶)[1]。目前国际上商品类果胶主要来源于柑橘皮和苹果渣。近年来也开发出甜菜果胶、柠檬皮果胶等新来源果胶。百香果又名西番莲,是我国主要的热带水果之一,果实由30%的果汁、50%~55%的果皮及5%~8%的种子组成[1-2],果皮占比较大且含有丰富的果胶物质,若将其加以利用,则可变废为宝。
酸性乳饮料(acidified milk drink,AMD)是非常受欢迎的蛋白质类饮料之一,为了获得更好的口感,其pH范围一般控制在4.7左右,但乳液中的酪蛋白容易发生聚集和沉淀,影响自身的口感。因此,在生产过程中常利用稳定剂抑制这种聚集沉淀。果胶为常见的乳品稳定剂,可以与酪蛋白产生静电相互作用和空间位阻效应,从而有效地防止蛋白质聚集沉淀以及乳清分离[3-5]。然而果胶亲水性高、疏水性低对酸性乳饮料的稳定效果有限,利用食品工业级的酯化衍生法来提高果胶分子的疏水性,有利于促进果胶在酸性乳品饮料的稳定效果。
本研究提取百香果果皮中的果胶(passion fruit pectin,PFP),进而制备含疏水性辛烯基琥珀酸酐(octenyl succinic anhydride,OSA)基团的果胶衍生物,以市售的柑橘果胶(citrus pectin,CP)作为参考,探讨3种果胶样品的添加对酸性乳饮料酸化过程中的稳定效果,确定较适宜的稳定条件和果胶种类。
1 材料与方法
1.1 材料与试剂
百香果果皮,云南猫哆哩集团;柑橘果胶(JMJ-YM150-H),美国CPKelco公司;脱脂乳粉,上海恒天然有限公司;HCl、OSA、HNO3、苯酚、葡萄糖酸-δ-内酯(glucono-delta-lactone, GDL)、异硫氰酸荧光素(fluorescein isothiocyanate isomer, FITC)等试剂采购于上海源叶生物技术有限公司;乙醇、NaOH等试剂,上海泰坦股份科技有限公司。
1.2 主要仪器与设备
PL2002型分析天平,瑞士Mettler-Toledo公司;RRH-A1000高速多功能粉碎机,上海缘沃工贸有限公司;OSB-2100旋转蒸发仪,日本EYELA公司;冷冻干燥机,美国Labconco公司;SP-752冷冻离心机,美国贝克曼库尔特公司;真空干燥箱,上海一恒科学仪器有限公司;T25数显型分散机,德国IKA公司;马尔文zeta电位仪Nano ZS,英国马尔文公司;173 plus多角度激光光散射粒径分析仪,美国Brookhaven公司;Discovery HR-3流变仪,美国TA仪器公司;A1R型激光共聚焦显微镜,日本尼康公司。
1.3 实验方法
1.3.1 百香果果胶的提取与酯化度测定
将百香果果皮烘干,磨粉,过120目筛,称取粉末按料液比1∶20(g∶mL)加入去离子水,搅拌溶解,用1 mol/L HNO3调节pH为2.1,静置30 min,85 ℃水浴加热3 h得到粗提液。粗提液经8 000 r/min离心15 min,得到上层提取液,蒸发浓缩至1/3~1/2体积,缓慢向浓缩液中加入2倍体积的95%乙醇(体积分数),静置1 h,8 000 r/min离心15 min得到下层沉淀,用无水乙醇脱水,搅拌细碎化,4层纱布过滤,沉淀物置于50 ℃真空干燥箱72 h得到粗提果胶。然后将粗提果胶复溶,用3倍体积95%乙醇醇沉,经离心后再细碎化以及干燥,最终得到百香果果胶。
酯化度采用GUZEL等[6]的滴定法进行测定。
1.3.2 果胶分子修饰及取代度测定
根据ZHAO等[7]的方法,称取10 g PFP样品,加入90 mL去离子水,60 ℃搅拌溶解2 h,用0.5 mol/L NaOH调节pH至8.5,按照m(OSA)∶m(PFP)=1∶7的比例缓慢加入OSA,期间维持溶液pH在8.5附近,反应1 h后,调节pH至6.0终止反应,用截留量8 000~14 000 Da透析袋于4 ℃下透析48 h,浓缩后冻干得到果胶衍生物POSA。
取代度采用滴定法[8]。称取2 g POSA样品溶解于25 mL含有体积分数90%异丙醇配制的2.5 mol/L HCl中,离心过滤,残留物用90%异丙醇洗涤3次,干燥去除多余的异丙醇,将产物溶解于300 mL去离子水中,加入几滴酚酞,用0.1 mol/L NaOH进行标定,记录NaOH消耗体积为V1,以PFP为空白组,得到NaOH消耗体积V0,按公式(1)计算取代度:
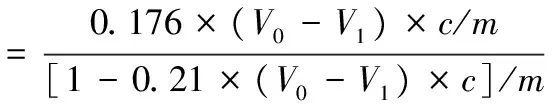
(1)
式中:V0,空白组NaOH消耗体积,mL;V1,样品组NaOH消耗体积,mL;c,NaOH浓度,mol/L;m,样品质量, g。
1.3.3 酸化乳饮料制备
取脱脂乳粉配制100 g/L的脱脂乳,室温搅拌1 h,静置2 h,90 ℃加热灭菌15 min,冷却至室温,分别移取50 mL于容器中,分别加入2 g/L的PFP、POSA或CP,搅拌溶解,乳液以8 000 r/min均质2 min后分别加入0、5、10、14和16 g/L的GDL,40 ℃保温4 h,使乳液pH分别达到6.5、5.48、4.68、4.25和4.1,4 ℃过夜,使用前400 r/min搅拌15 min,使样品恢复至室温。
1.3.4 ζ-电位测定
使用配备有4 mol/L He/Ne激光器的Malvern Zetasizer Nano ZS装置在633 nm处进行ζ-电位测定。测定前,样品溶液用对应pH值去离子水稀释10倍。仪器参数设置为等待时间120 s,平衡时间180 s,在室温下使用Zetasizer软件进行数据收集与分析。
1.3.5 粒径测定
使用173 plus多角度激光散射粒径分析仪对样品溶液的光散射特征进行分析。测定前,样品溶液用对应pH值的去离子水稀释10倍,过0.45 μm滤膜。仪器参数设置:测试角度90°;温度25 ℃;平衡时间300 s;检测时间120 s。
1.3.6 流变学测定
使用配备有Peltier温度控制器和恒温循环水浴装置的Discovery HR-3流变仪和不锈钢平板(直径:40 mm;间隙:1 000 μm)进行流变参数测试。为了避免干燥引起的误差,采用蒸馏水密封蒸汽屏蔽。采用TRIOS软件对样品的实验数据进行采集和分析。
静态剪切流变测试:取1.5 mL样品置于平板上,于温度25 ℃下剪切速率在0.01~1 000 s-1范围内测试表观黏度随剪切速率的变化。
动态黏弹性测试:在25 ℃,2%应变下(线性黏弹区内),测定其弹性模量(G′)和黏性模量(G″),扫描范围:0.1~100 rad/s。
1.3.7 微观分析—激光共聚焦测定
用1 mg/mL FITC乙醇溶液对AMD中蛋白质进行染色,FITC终浓度为40 μg/mL。将染色好的AMD置于单凹片上,盖上载玻片,使用配备有Ne/Ar激光器的激光共聚焦显微镜(confocal laser scanning microscope, CLSM)进行测定。测定条件:激发波长488 nm,发射波长范围500~550 nm,放大倍数400倍。
2 结果与分析
2.1 果胶的提取与分析
由表1可以看出,百香果果胶的平均得率为10.59%,稍低于KULKARNI等[9]报道的果胶提取率,分子修饰之后的POSA果胶取代度为0.016。PFP和POSA果胶的酯化度平均为84.9%~87.6%,大于CP的76.8%,表明3种果胶都属于高甲氧基果胶(酯化度>50%)。

表1 果胶样品的得率、取代度与酯化度Table 1 Yields, degree of substitution, and degree ofesterification of pectin samples
2.2 三种果胶对酸化过程中ζ-电位的影响
由于果胶是酸性多糖,乳液中主要的蛋白质酪蛋白也是带电基团,通过ζ-电位来表征分子之间的相互作用以及表面电荷密度,ζ-电位的绝对值越大说明稳定效果越好[10-11]。从图1可以看出,当未添加果胶的空白组AMD在pH 6.5到4.1,ζ-电位值的绝对值逐渐变小,并在酸性pH<4.5时由负转正[11],说明体系在酸化过程逐渐失稳。当体系中加入PFP、POSA和CP时,在pH>5.5时对ζ-电位值没有明显影响,这可能是由于此时的pH值与果胶溶液本身的pH值相近所致,随着体系pH降低至酪蛋白等电点(pI 4.7)附近,加入果胶的3个体系ζ-电位值增大,说明果胶吸附在蛋白质的表面,改变了表面电荷密度,与溶液中的阴离子多糖产生静电排斥,阻止了大颗粒聚集物的形成。实验表明,3种果胶均具有稳定效果,且在pH 4.7附近,PFP和POSA的稳定效果优于CP,在pH<4.7时,PFP和POSA乳体系的ζ-电位值增长较快,说明稳定效果变差。

图1 三种果胶对脱脂乳悬浮液酸化过程中ζ-电位的影响Fig.1 Effects of PFP, POSA and CP on ζ-potential duringacidification of skimmed milk dispersions
2.3 三种果胶对酸化过程中粒径大小的影响
因果胶为酸性阴离子多糖,可吸附在脱脂乳中酪蛋白的表面,运用动态光散射法测量聚合物的有效粒径,进而评估分子间的相互作用[12-13]。由图2可知,空白组AMD的有效粒径在pH 6.5~4.68范围内逐渐增大,并在pH 4.68时达到最大值1 803 nm;当pH继续降低,有效粒径降低。添加PFP的乳液在偏中性的条件下未发现明显的结合,在酸化至pH 4.68附近时,相对于空白组,PFP组体系的粒径较小,在pH<4.68时则明显增大了体系的粒径,说明PFP在此范围内稳定效果不佳,这一点与电位分析结果一致。而POSA从偏中性开始与体系中蛋白质发生结合,并在pH 4.68时明显减小了体系粒径,随着pH进一步降低,这种稳定效果逐渐变差。商品果胶CP对抑制大颗粒形成的效果与PFP类似,在pH<4.68的范围内,POSA呈现更好的稳定效果。综上,分子修饰之后的果胶POSA有着更好的稳定效果,但在酸化后期的稳定效果较差。

图2 三种果胶对脱脂乳悬浮液酸化过程中有效粒径的影响Fig.2 Effect of PFP, POSA and CP on effective particlesize during acidification of skimmed milk dispersions
2.4 三种果胶对酸化过程中流变性质的影响
流变性是研究物质在力的作用下的流动和变形,是果胶的重要属性之一。当果胶作为稳定剂加入到乳饮料中,黏度是评价果胶效果的重要指标[14-15]。图3为PFP、POSA和CP对脱脂乳酸化过程中表观黏度随剪切速率变化的影响。
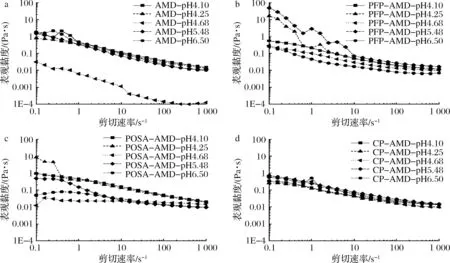
a-AMD;b-PFP-AMD;c-POSA-AMD;d-CP-AMD图3 PFP、POSA和CP对脱脂乳悬浮液酸化过程中表观黏度的影响Fig.3 Effects of PFP, POSA and CP on apparent viscosities of skimmed milk dispersions duringacidification as a function of shear rate
图3-a中,未添加果胶的乳液在酸化过程中表现出明显的剪切稀化行为,其中在pH 4.68时剪切变稀更为明显,且对应的黏度也较低,这与体系失稳有着必然的联系[16]。而添加PFP、POSA和CP后,明显抑制了乳液在酪蛋白等电点时的不稳定性,宏观表现为表观黏度对剪切速率依赖性降低。其中修饰之后的果胶POSA有着更低的剪切速率依赖性,在LIU等[17]的研究中也发现类似的现象。而添加PFP和CP的乳液在pH 4.68时有着相对较高的黏度,这可能是因为PFP和CP与乳液中蛋白质颗粒之间有着更强的分子缠绕,使得分子间相对流动减弱,表现为表观黏度增大[18]。
为了模仿人体口腔环境,选取剪切速率为40 s-1的表观黏度[19]作图。从图4可以看出,AMD组在pH 4.68时表观黏度下降到最低,随着酸化的进行,表观黏度有明显的升高。3种果胶的加入明显增加了乳液在pH 4.68时的表观黏度,PFP在pH<4.68的范围内有很好的稳定性,而POSA在pH>4.68时对乳液的表观黏度的稳定性较好,随着pH的进一步降低,乳液的表观黏度明显上升。CP在酸化开始时显著增加了体系的表观黏度,在pH≤4.68的范围,乳液的表观黏度呈现上升趋势。说明PFP和CP在pH<4.68的范围内对乳液的表观黏度有较好的稳定性,分子修饰之后的果胶POSA在偏中性条件下对表观黏度的稳定效果较好。

图4 脱脂乳-果胶系统在剪切速率40 s-1下的表观黏度随pH值的变化Fig.4 Changes in apparent viscosity at a shear rate of40 s-1 with pH value for skim milk-pectin systems
物质的黏弹特性反映着溶液的凝胶性质,同时与胶体的实际生产应用有着很大的关联性。储能模量(G′)代表能量贮存而可恢复的弹性性质,损耗模量(G″)代表流体流动的黏性性质。从图5可以看出,4种乳体系下的G′和G″均表现出频率依赖性,在pH 4.68时,AMD、PFP-AMD和CP-AMD体系的G′
综合稳态剪切黏度(图3)和动态黏弹性模量(图5)的分析,可以看出CP对乳体系下的流变性质影响较小,而PFP和POSA则增大了乳体系的抗剪切能力以及高频区的凝胶性质,这可能是由于PFP和POSA与乳液中蛋白质的相互作用更强,分子之间的缠绕更为紧密,形成的凝胶网络不易发生“滑动”所致[21]。

a-AMD;b-PFP-AMD;c-POSA-AMD;d-CP-AMD图5 三种果胶对脱脂乳悬浮液酸化过程中动态黏弹性模量的影响Fig.5 Effects of PFP, POSA and CP on dynamic moduli during acidification of skimmed milk dispersions
2.5 三种果胶对酸化过程中的微观结构影响
通过对体系中蛋白质进行荧光标记,在一定的激发波长和发射波长下,用激光共聚焦显微镜观察,可以更加直观地反映果胶对乳体系的稳定性作用。从图6可以看出,空白组AMD可以清楚的看出大面积的聚集,且聚集体呈絮状,较为厚实,这与JORDAN等[22]的研究结果一致。而添加PFP的乳体系表现为局部较为细小的聚集。分子修饰之后的果胶POSA呈现出分布均匀但较为分散的聚集体,这可能是由于OSA具有一定的疏水性质[23-24]导致的。而商品果胶CP在pH 4.68时表现出局部的、松散絮状的大颗粒聚集。因此,从微观图像看,PFP抑制乳体系中大颗粒聚集的效果要优于POSA, 而POSA又稍优于CP。

a-AMD;b-PFP-AMD;c-POSA-AMD;d-CP-AMD;标尺为50 μm图6 三种果胶对脱脂乳悬浮液在pH 4.68时的CLSM图像Fig.6 CLSM images of skimmed milk dispersions with PFP,POSA and CP at pH 4.68
3 结论
通过测定ζ-电位、粒径、流变学特性以及微观分析,研究了百香果果胶PFP,分子修饰后的果胶POSA以及商品类柑橘果胶CP对脱脂乳酸化过程中的稳定效果。PFP、POSA和CP在添加量为2.0 g/L下,均提高了脱脂乳体系在酪蛋白等电点pH 4.7附近的ζ-电位绝对值,降低了有效粒径。但是随着pH继续下降,PFP和POSA体系下的稳定效果变差。另一方面,PFP和POSA提高了脱脂乳体系在酸化过程的抗剪切能力,以及动态黏弹模量(G′、G″),改变体系的凝胶性质。通过CLSM图像分析可以看出PFP和POSA均具有较好的抑制乳液中聚集物的形成效果,具有发展成商品类果胶的潜质。

