TRAIL与上皮性卵巢癌中耐药相关基因的关系
张凤喜 常玉梅 崔允巍 王春香 郭翠莲 易洁
在临床统计中,卵巢上皮癌的病死率居于各类卵巢癌的第一位[1],而且在卵巢恶性肿瘤中,上皮性卵巢癌是最常见的一种卵巢癌。因其发病隐匿,早期无明显症状且缺乏诊断依据,故卵巢癌的早期诊断是一难题,严重威胁着女性的健康和生命[2]。上皮性卵巢癌目前的主要治疗方案是手术治疗联合化疗进行。有报道称约25%的卵巢癌患者存在原发性耐药,而将近75%的卵巢癌患者存在继发性耐药[3]。卵巢癌病死率比较高,其中一个重要的原因应该与卵巢癌的多药耐药性密切相关,卵巢癌的多药耐药性是卵巢癌术后复发及转移的一个主要原因。化疗是卵巢癌患者术后首选的辅助治疗方法。然而化疗的卵巢癌患者中有一部分存在继发性耐药。肿瘤坏死因子相关调亡诱导配体(tumornecrosisfactor related apopto sis inducing ligand,TRAIL)是近几年发现的一个可诱导肿瘤细胞凋亡的 TNF家族成员,TRAIL因子最大特点是选择性诱导癌细胞凋亡,对正常细胞无诱导凋亡作用[4],因此 TRAIL已经成为抗癌研究的热点,本试验通过检测TRAIL和耐药相关蛋白 MDR1、LIVIN、 TOPOⅠ、 TOPOⅡ、 PTEN、 ERCC1在上皮性卵巢癌中的表达,探讨 TRAIL与上皮性卵巢癌临床分期及耐药相关基因的关系,筛选出和 TRAIL相关的耐药因子,从而为预测卵巢癌的耐药并指导临床用药提供参考。
1 材料与方法
1.1 组织标本 选择衡水市妇幼保健院2014年卵巢癌患者50例,年龄39~68岁,平均年龄(50.4±2.5)岁;病程8个月~5年,平均病程为(2.8±0.4)年,标本均经病理科专业人员切片阅读,术后病理结果证实为上皮性卵巢癌,并且所有的病例术后病理结果均含有耐药相关基因MDR1、PTEN、TOPOⅠ、TOPOⅡ、ERCC1、LIVIN的免疫组化结果。其中MDR1(-)14例,MDR1(+)16例,MDR1(++)10例,MDR1(+++)10例;LIVIN (-)24例,LIVIN (+),18例,LIVIN (++)4例,LIVIN (+++)4例;PTEN(-)18例,PTEN(+)9例,PTEN(++)10例,PTEN(+++)13例;TOPOⅠ(-)16例,TOPOⅠ(+)9例,TOPOⅠ(++)22例,TOPOⅠ(+++)3例;TOPOⅡ(-)14例,TOPOⅡ(+)11例,TOPOⅡ(++)20例,TOPOⅡ(+++)5例;ERCC1(-)12例,ERCC1(+)10例,ERCC1(++)25例,ERCC1(+++)3例。所选取的病例未进行术前的任何治疗,如放疗、化疗及免疫治疗等。均为首次手术治疗。
1.2 试剂与方法 鼠抗人TRAIL单克隆抗体(浓缩型)。SP试剂盒;DAB试剂盒;磷酸盐缓冲液(PBS);将一包磷酸盐缓冲液粉剂用1 000 ml蒸馏水稀释,摇匀后备用。将pH值控制在7.2~7.4。用2 000 ml的蒸馏水将一包枸椽酸缓冲液粉剂进行稀释,摇匀后备用,将pH值控制在6.0~7.0。
1.3 免疫组化染色结果判定 采用SP免疫组织化学方法检测,染色判定所有切片用Olympus光学显微镜(CH-20 )进行观察,TRAIL细胞浆或细胞膜被染成棕黄色判定为阳性,连续观察5个高倍视野,计算阳性细胞百分数(0~4分)和染色强度(0~3分),二者为免的积为免疫反应分数(IRS),IRS 0 分时为阴性(-),1~4分时为弱阳性(+),5~8分时为阳性(++),9~12分为强阳性(+++)。计算百分比时,阴性为0分,<5%为1分,6%~10%为2分,11%~30%为3分,>30%为4分;着色强度观察,淡黄色为1分,黄色为2分,棕黄色为3分,无着色为0分。
1.4 统计学分析 应用SPSS 19.0统计软件,TRAIL在不同卵巢组织及卵巢癌分期中的表达率的差异采用χ2检验,TRAIL与几种耐药相关因子MDR1、LIVIN、TOPOⅠ、TOPOⅡ、PTEN、ERCC1的相关性采用Spearman等级检验,P<0.05为差异有统计学意义。
2 结果
2.1 TRAIL因子和MDR1在卵巢癌中的表达 TRAIL随MDR1表达渐强而逐渐减弱,两两比较,差异均有统计学意义(P<0.05)。见表1。
2.2 TRAIL因子和LIVIN在卵巢癌中的表达 TRAIL随LIVIN表达渐强,至LIVIN(++)达到峰值(P<0.05)。TRAIL因子表达没有规律性。见表2。
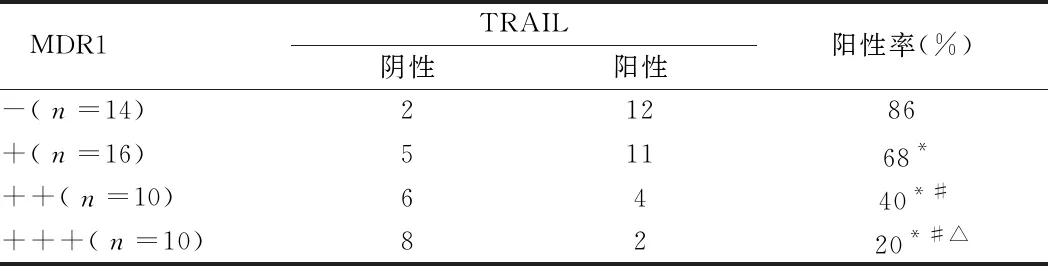
表1 TRAIL因子和MDR1在卵巢癌中的表达 例
注:与MDR1(-)比较,*P<0.05;与MDR1(+)比较,#P<0.05;与MDR1(++)比较,△P<0.05
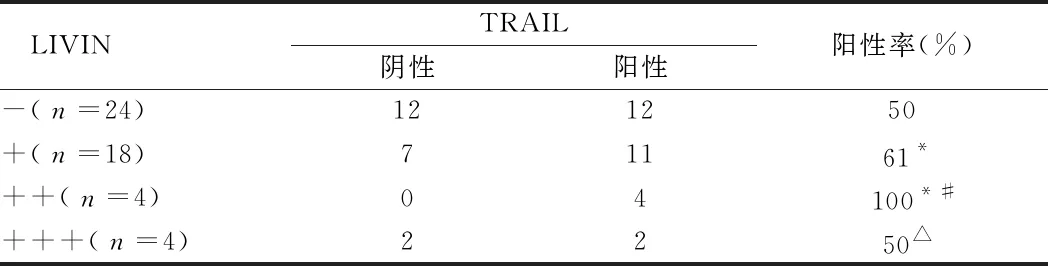
表2 TRAIL因子和LIVIN在卵巢癌中的表达 例
注:与LIVIN(-)比较,*P<0.05;与LIVIN(+)比较,#P<0.05;与LIVIN(++)比较,△P<0.05
2.3 TRAIL因子和TOPOⅠ在卵巢癌中的表达 TRAIL阳性率在TOPOⅠ(-)、(+)、(+++)表达明显高于TOPOⅠ(++),差异有统计学意义(P<0.05)。见表3。

表3 TRAIL因子和TOPOⅠ在卵巢癌中的表达 例
注:与TOPOⅠ(-)比较,*P<0.05;与TOPOⅠ(+)比较,#P<0.05;与TOPOⅠ(++)比较,△P<0.05
2.4 TRAIL因子和TOPOⅡ在卵巢癌中的表达 TRAIL阳性率在TOPOⅡ(-)、(+)、(++)表达高于TOPOⅡ(+++),差异有统计学意义(P<0.5)。见表4。

表4 TRAIL因子和TOPOⅡ在卵巢癌中的表达 例
注:与TOPOⅡ(-)比较,*P<0.05;与TOPOⅡ(+)比较,#P<0.05;与TOPOⅡ(++)比较,△P<0.05
2.5 TRAIL因子和PTEN在卵巢癌中的表达 TRAIL阳性率在PTEN(-)、(+)表达高于PTEN(++)、(+++),差异有统计学意义(P<0.5)。见表5。
2.6 TRAIL因子和ERCC1在卵巢癌中的表达 TRAIL阳性率在ERCC1(-)、(+)表达高于ERCC1(++),差异有统计学意义(P<0.5)。见表6。
2.7 相关性分析 TRAIL与MDR1在卵巢癌中表达呈负相关(r=-1,P=0),与LIVIN、TOPOⅠ、TOPOⅡ、PTEN、ERCC1表达无相关性(P>0.05)。见表7。
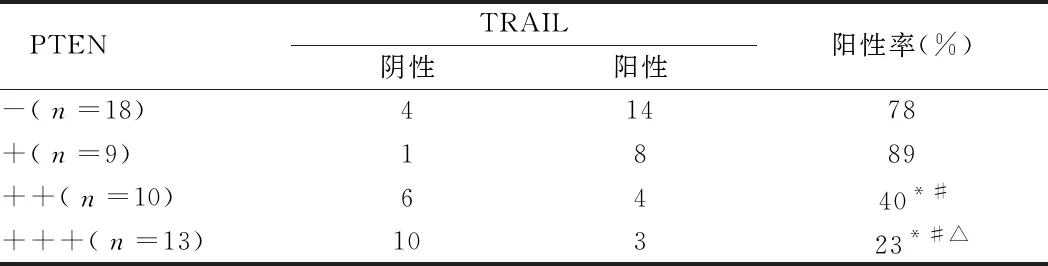
表5 TRAIL因子和PTEN在卵巢癌中的表达 例
注:与PTEN(-)比较,*P<0.05;与PTEN(+)比较,#P<0.05;与PTEN(++)比较,△P<0.05
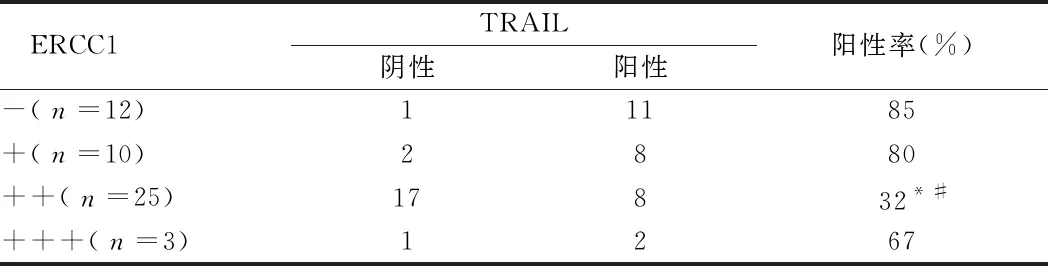
表6 TRAIL因子和ERCC1在卵巢癌中的表达 例
注:与ERCC1(-)比较,*P<0.05;与ERCC1(+)比较,#P<0.05
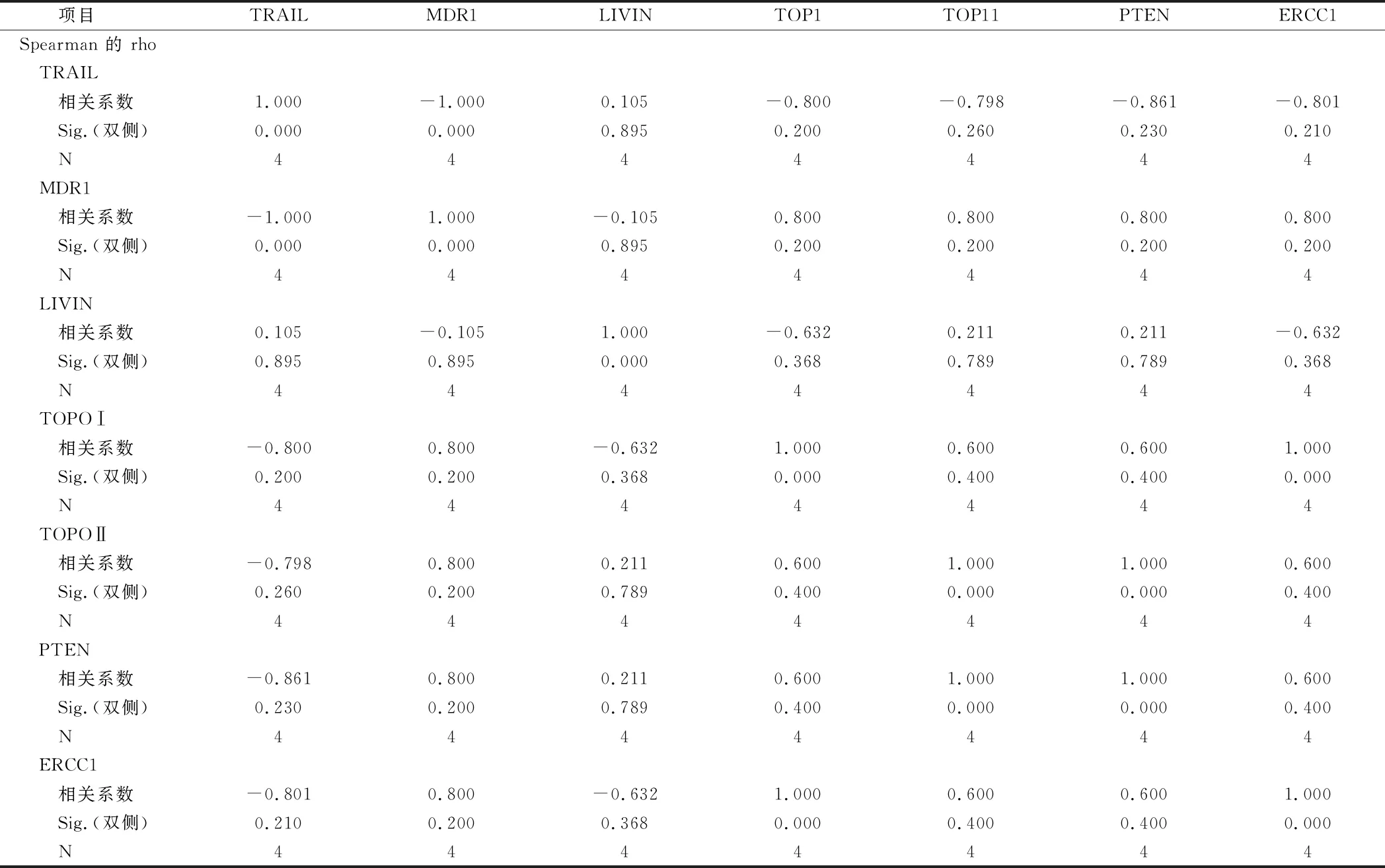
表7 TRAIL因子和TRAIL MDR1 LIVIN TOPOⅠ TOPOⅡ PTEN ERCC1的相关性分析
3 讨论
卵巢癌是一种严重危害女性健康,恶性度很高的肿瘤,在女性生殖器官的恶性肿瘤发病率中仅低于子宫内膜癌,在卵巢癌的发病类型中最常见的一种是卵巢上皮癌,在临床统计中,卵巢上皮癌的病死率居于各类卵巢癌类型中的第一位,占卵巢癌的90%~95%,据报道,世界每年新增卵巢癌病例20.4万,死亡人数12.5万[5],卵巢癌的恶性程度和病因学目前尚不完全清楚。因为卵巢癌早期发病症状不典型且缺乏诊断依据,无较敏感和特异的生物标志物,所以卵巢癌发病早期无明显症状,易被忽视,故约70%的卵巢癌患者确诊时已至晚期,且卵巢癌的发病率呈逐年上升趋势,有部分患者已失去手术机会,且晚期患者治疗困难,预后较差,5年生存率大约40%[6],虽然医疗技术不断发展,肿瘤细胞减灭术,化疗方案不断改进,但卵巢上皮性卵巢癌患者的5年生存率并没有显著的提高,患者的肿瘤分期、分化程度、转移等均影响患者预后,是评估患者生存率的重要因素,部分可手术的患者的主要治疗方案是手术治疗联合化疗进行,即使初次治疗有效,但仍有4/5左右的患者复发或转移,卵巢癌病死率高的原因之一是与卵巢癌的多药耐药性密切相关,导致了患者预后不良,因此寻找新的肿瘤标志物和治疗手段对卵巢癌患者的诊疗和预后尤为重要,到目前为止仍然没有十分有效的治疗方法,近年来,寻找具有生物活性的细胞毒性分子诱导肿瘤细胞凋亡逐渐成为卵巢癌生物治疗领域关注的焦点。
TRAIL是最近这几年被发现的可诱发肿瘤细胞凋亡的TNF家族成员之一,又称为凋亡素2配体。其最大的优点是能够选择性的诱导肿瘤细胞走向凋亡,但对正常细胞来讲,TRAIL不会产生任何毒副作用[7],所以目前TRAIL已成为许多学者的研究热点,并有希望成为新一代的研究药物。研究表明,人的体内所包含的TRAIL基因中存在有一个开放的读码框,它定位于3号染色体的3q26上的,是非常典型的跨膜糖蛋白,它编码一个由281个氨基酸所构成的前体蛋白[8]。在金属蛋白酶的作用下,TRAIL的胞外区碳(C)末端的114~281氨基酸可形成一个同源三聚体结构,是可溶型蛋白(soluble TRAIL,sTRAIL)。研究发现,TRAIL诱导细胞调亡的方式,是通过与靶细胞膜上的相应受体结合而完成[9]。TRAIL一共包含5个受体,包括TRAILR1(DR4)、TRAILR2(DR5)、TRAILR3(DClR1)、TRAILR4(DClR2)以及OPG。DR4、DR5是死亡受体,在不同肿瘤细胞组织及正常细胞组织中均有不同程度的差异化表达;DCR1、DCR2、OPG是诱骗受体,通常只在正常组织中表达,而在肿瘤组织中不表达[10]。在正常组织中,DCR1、DCR2通过与死亡受体竞争性结合TRAIL,而使正常组织逃逸TRAIL的杀伤作用。因此,TRAIL在有选择性的来诱导肿瘤细胞凋亡方面非常有效。TRAIL通过与死亡受体特异性的作用,激活caspase级联反应,放大和传送凋亡信号,从而诱导目标细胞发生凋亡[11]。通过对卵巢癌细胞的研究得出结论,可能存在两种以上的TRAIL信号传导途径,细胞FLICE抑制蛋白的表达。有研究通过转染TRAIL的内皮祖细胞作用于卵巢癌动物模型,发现对移植瘤具有抑制的作用,为卵巢癌靶向治疗应用于临床提供了非常有力的支持[12]。有研究发现无论是与化疗药物联合治疗,还是利用TRAIL单独治疗,均取得了肿瘤细胞株一致的结果引起肿瘤退化,生长变慢,甚至消失,且没有产生很严重的毒副作用[13]。研究表明,TRAIL可抑制许多癌症细胞(包括白血病,淋巴瘤,骨髓瘤,黑色素瘤,乳腺癌,结肠癌,胆管癌,甲状腺癌)的生长,提示TRAIL成为一种强有力的抗肿瘤制剂的可行性[14]。
在原发性卵巢癌中,有88%至少表达一种死亡受体,在化疗前后分别检测受体水平,发现死亡受体的表达率明显增高。因此可见,化疗药物可能通过上凋死亡受体的水平达到TRAIL诱导凋亡的作用,虽然卵巢癌对化疗相对敏感,但从临床治疗来看,治疗效果很是不理想,药物耐受是应该是治疗失败的一个重要因素,多药耐药基因1是第一个被确定的多药耐药相关基因,即当肿瘤细胞长时间接受某一种化疗药物的持续治疗时,就会逐渐产生出对这种化疗药物的耐药性,从而使治疗愈发困难,而且这同时还能够对其他一些结构和功能不同的多种化疗药物衍生出交叉耐药性。耐药性是肿瘤细胞在接受治疗时,为避免化疗药物攻击而产生的非常重要的抵制措施,这也是引起化疗失败的最主要因素之一。研究表明,单独使用顺铂、紫杉醇、阿霉素、TRAIL治疗和使用TRAIL 与这些化疗药物配合治疗存在很大差异,在单独使用TRAIL治疗时,耐药细胞系仍然在抵抗,但在使用TRAIL 与这些化疗药物配合治疗时则耐药细胞系的凋亡水平有了明显提高[15]。在体外试验研究中,使用TRAIL 与这些化疗药物配合治疗时,可减小化疗药物的剂量,而且逆转细胞的抵抗转变为细胞敏感。试验还表明,TNF 还可以利用直接降低MDR1 基因的表达,使细胞内药物浓度不断升高,并进一步逆转由P-gp的经典MDR[16]。然而,作为TNF 超家族成员之一,TRAIL是不是与TNF 相仿,是通过降低耐药相关因子的表达增加化疗药物在肿瘤细胞中的蓄积而逆转肿瘤细胞对化疗药的耐药性,目前还没有相关报道。
由于卵巢癌对化疗药耐药涉及多个基因,因此需要实验同时检测多个基因的表达才能更好地判断预后,本实验通过免疫组化的方法对TRAIL 因子与几种耐药基因MDR1、 LIVIN、TOPOⅠ、TOPOⅡ、PTEN、ERCC1的相关性进行了分析,分析耐药基因表达与TRAIL 因子的关系,如果以单个基因比较,仅MDR1和TRAIL的表达有关,本实验结果显示TRAIL 因子与耐药基因MDR1之间存在着负相关(r=-1,P=0)的联系。TRAIL 或许是利用减小耐药基因MDR1 并减小其编码的P-gp 表达,抑制肿瘤细胞的生长并进一步促使其凋亡,从而参与逆转卵巢癌的多药耐药。更深入的研究TRAIL 逆转卵巢癌MDR 的机制,进一步分析化疗药物与TRAIL 结合应用TRAIL对卵巢癌细胞株耐药基因表达的影响,还有利用TRAIL 受体作为中间环节将TRAIL 与耐药基因联系起来的可能性,都将有待于下一阶段的研究。
另外本实验对TRAIL和耐药因子LIVIN、TOPOⅠ、TOPOⅡ、PTEN、ERCC1的相关性也进行了分析,通过秩相关检验进行两两相关性分析,TRAIL和LIVIN(r=0.105,P=0.895),TRAIL和TOPOⅠ(r=-0.8,P=0.2),TRAIL和TOPOⅡ(r=-0.798,P=0.26),TRAIL和PTEN(r=0.861,P=0.23)TRAIL和ERCC1(r=-0.801,P=0.21) TRAIL和耐药因子LIVIN、、TOPOⅠ、TOPOⅡ、PTEN、ERCC1无相关性。
综上所述,卵巢癌是临床上常见的恶性肿瘤,恶性度高,预后差。随着TRAIL 基因所诱导的新的肿瘤细胞凋亡机制的发现,可能为卵巢癌提供一种新的治疗途径。虽然,应用TRAIL作为化疗药物来对卵巢癌进行治疗的技术还不是很成熟,但是随着体外实验及动
物实验研究的不断深入,已越来越可能成为现实。TRAIL 作为化疗药物应用于卵巢癌的治疗可以提高化疗疗效并与化疗药物具有协同作用,从而可以减少其他化疗药物的剂量,以消弱化疗药物在临床治疗中所产生的毒性作用及不良反应。

