肝细胞癌超声造影灌注参数与ANGPTL4表达水平相关性的初步研究
吴林德,浙江省德清县人民医院超声科 浙江省湖州市 313200
蒿业红,徐珊珊,浙江萧山医院超声科 浙江省杭州市 311200
方苑仲,杭州市余杭区妇幼保健院检验科 浙江省杭州市 311100
0 引言
原发性肝细胞癌(hepatocellular carcinoma,HCC)是一种发病率较高的肝脏恶性肿瘤[1].HCC恶性生物学行为与其微血管新生状态密切相关,深入研究其微血管生成有着重要临床意义[2].血管生成素样蛋白4(angiopoietin like 4,ANGPTL4)作为一种血管生成素样蛋白家族中的分泌型糖蛋白,其在促进肿瘤血管生成、转移及复发中发挥着重要作用[3],而目前其评估方法需采用具有创伤性的病理学检查.本研究运用超声造影(contrastenhanced ultrasound,CEUS)定量分析HCC的血流灌注参数,探讨其与ANGPTL4表达水平的相关性,旨在探讨CEUS在评估活体HCC组织的ANGPTL4表达水平及血管生成中的价值.
1 材料和方法
1.1 材料 选择2018-09/2019-12期间,在浙江萧山医院行手术切除的84例HCC患者作为研究对象.纳入标准:(1)均病理证实为HCC;(2)术前均未曾行任何形式放化疗及药物治疗;(3)无合并其它恶性肿瘤;(4)患者能配合CEUS检查.其中男68例,女16例,年龄29-70岁,平均年龄50.83岁±11.02岁.病灶共计84个,直径1.87-6.19 cm,平均直径4.23 cm±1.10 cm.根据ANGPTL4表达结果分为:ANGPTL4阳性表达组,48例,男38例,女10例,年龄29-70岁,平均年龄51.53岁±10.47岁,直径2.11-6.19 cm,平均直径4.29 cm±1.09 cm,其中高分化12例、中分化10例、低分化26例;ANGPTL4阴性表达组,36例,男30例,女6例,年龄32-67岁,平均49.90岁±11.80岁,直径1.87-5.53 cm,平均4.15 cm±1.12 cm,其中高分化9例、中分化8例、低分化19例.两组间年龄(t=0.666,P=0.507)、性别(χ2=0.232,P=0.630)、直径(t=0.568,P=0.571),病理分级(χ2=0.026,P=0.987)比较无明显统计学差异(P>0.05).
1.2 方法
1.2.1 CEUS检查:CEUS采用Acuson S2000超声诊断仪,配有4C1探头(频率4.0 MHz),随机配备对比脉冲系列成像技术.造影剂采用声诺维(sono Vue),按照说明书配备成混悬液.CEUS由一名高年资且经验丰富的超声医师进行操作分析.首先对病灶进行常规超声检查,明确肿瘤位置、大小、内部回声、边界、血供等情况.启动CEUS,经肘部浅静脉推注造影剂2.4 mL,同步计时,观察并存储造影全过程.选取病灶区域作为感兴趣区,绘制时间-强度曲线,获得病灶的增强强度、达峰时间(图1).
1.2.2 血管内皮生长因子水平、ANGPTL4、微血管密度测定:ANGPTL4表达测定:术后组织标本采用兔抗人ANGPTL4 多克隆抗体(美国Sigma公司),滴度为1:200,按照SABC法常规步骤行免疫组化.随机选取每张切中的5个视野,根据视野中阳性细胞百分比评分:0分,阳性细胞<5%;1分,5%-25%;2分,25%-50%;3分,≥50%.染色强弱评分:仅细胞核染蓝色为阴性;胞核、胞浆以及胞膜染成棕黄色为阳性.0分,阴性;1分,弱阳性;2分,阳性;3分,强阳性.ANGPTL4 表达结果判定:两项之和≤3分判定为阴性表达;>3分判定为阳性表达.
微血管密度(microvessel density,MVD)测定:术后组织标本经甲醛固定,石蜡包埋切片,采用ElivisionTM两步法免疫组化染色.参照Weidner等[4]的校正方法测定MVD.
血清血管内皮生长因子(vascular endothelial growth factor,VEGF)水平测定:清晨,空腹状态,采集患者5 mL肘部静脉血,3000 r/min离心15 min分离血清,-20 ℃冰箱存储.按照酶联免疫吸附试验进行操作,测定血清VEGF水平.
统计学处理应用SPSS 20.0软件统计数据.计量资料以mean±SD表示,两组间比较采用独立样本t检验,多组间比较采用方差分析;计数资料以(%)表示,组间比较采用χ2检验.相关性采用Pearson相关分析.P<0.05为差异有统计学意义.
2 结果
2.1 两组间CEUS参数比较 ANGPTL4阳性表达组病灶的增强强度(enhancement intensity,EI)明显高于ANGPTL4阴性表达组,差异有统计学意义(P<0.05);ANGPTL4阳性表达组病灶的达峰时间(peak to time,TTP)明显短于ANGPTL4阴性表达组,差异有统计学意义(P<0.05)(表1).高分化HCC的EI低于中分化HCC及低分化HCC,差异有统计学意义(P<0.05);中分化HCC的EI低于低分化HCC,差异有统计学意义(P<0.05);高分化HCC的TTP长于中分化HCC及低分化HCC,差异有统计学意义(P<0.05);中分化HCC的TTP长于低分化HCC,差异有统计学意义(P<0.05)(表2).
2.2 两组间ANGPTL4、VEGF、MVD水平比较ANGPTL4阳性表达组的ANGPTL4、MVD及VEGF水平明显高于ANGPTL4阴性表达组,差异有统计学意义(P<0.05)(表3).高分化HCC的ANGPTL4、MVD及VEGF水平低于中分化HCC及低分化HCC,差异有统计学意义(P<0.05);中分化HCC的ANGPTL4、MVD及VEGF水平低于低分化HCC,差异有统计学意义(P<0.05)(表4).
2.3 CEUS参数与ANGPTL4表达水平的相关性 HCC的EI与ANGPTL4表达水平呈正相关(r=0.753,R2=567,P<0.05),HCC的TTP与ANGPTL4表达水平呈负相关(r=-0.730,R2=0.532,P<0.05)(图2).
3 讨论
HCC为富血供肝脏恶性肿瘤,其发生发展、转移复发与血管新生密切相关[5].血管新生是一系列在多因子调控作用下发生的有序而复杂的生物过程.因此,全面了解HCC血管新生状态对于临床制定治疗方案,评估预后有着重要意义.
ANGPTL4作为一种血管生成素样蛋白家族中的分泌型糖蛋白,不仅参与葡萄糖代谢以及脂质代谢,而且在缺氧诱导因子作用下表达上调,促进肿瘤血管新生、转移复发以及细胞分化[6].MVD常被应用于评估肿瘤的微小血管增殖状态,是目前临床评估肿瘤血管生成的“金标准”,在恶性肿瘤中MVD数值越高,肿瘤侵袭能力越强、预后越差[7].VEGF 即是目前所知的特异性最高、作用最强的肿瘤血管生成正向调节因子.本研究结果中,ANGPTL4阳性表达组的ANGPTL4、MVD及VEGF水平明显高于ANGPTL4阴性表达组(P<0.05).证实了随着HCC组织中ANGPTL4表达上调,VEGF合成分泌增加,HCC微小血管生成能力增强,促使HCC内微血管大量增殖,为其提供生长发展所需的血供及营养物质.
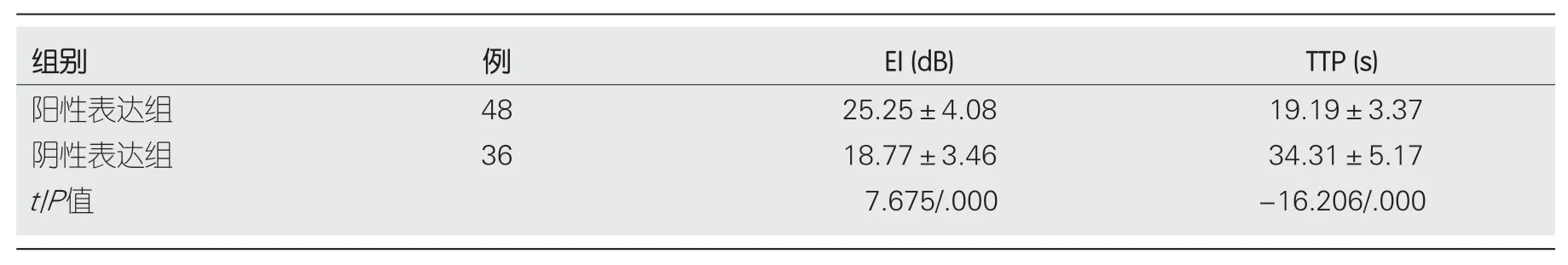
表1 两组间超声造影参数比较
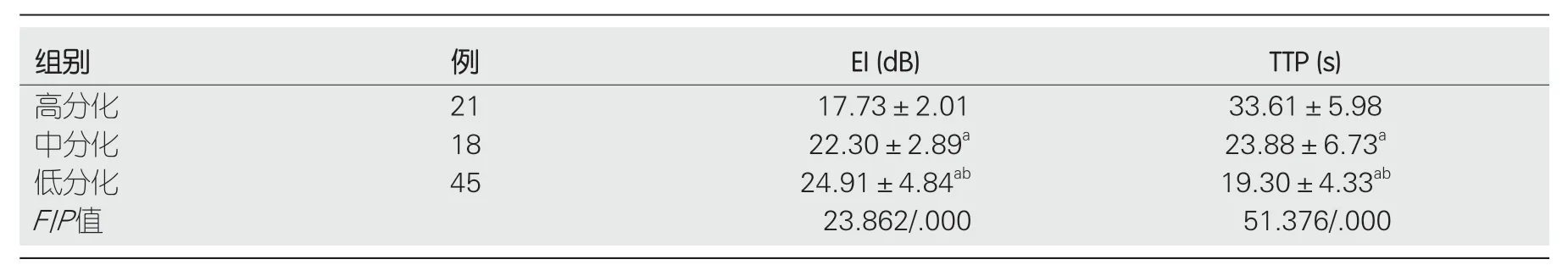
表2 不同病理分级肝细胞癌超声造影参数比较

表3 两组间血管内皮生长因子、ANGPTL4、微血管密度水平比较

表4 不同病理分级肝细胞癌间血管内皮生长因子、ANGPTL4、微血管密度水平比较
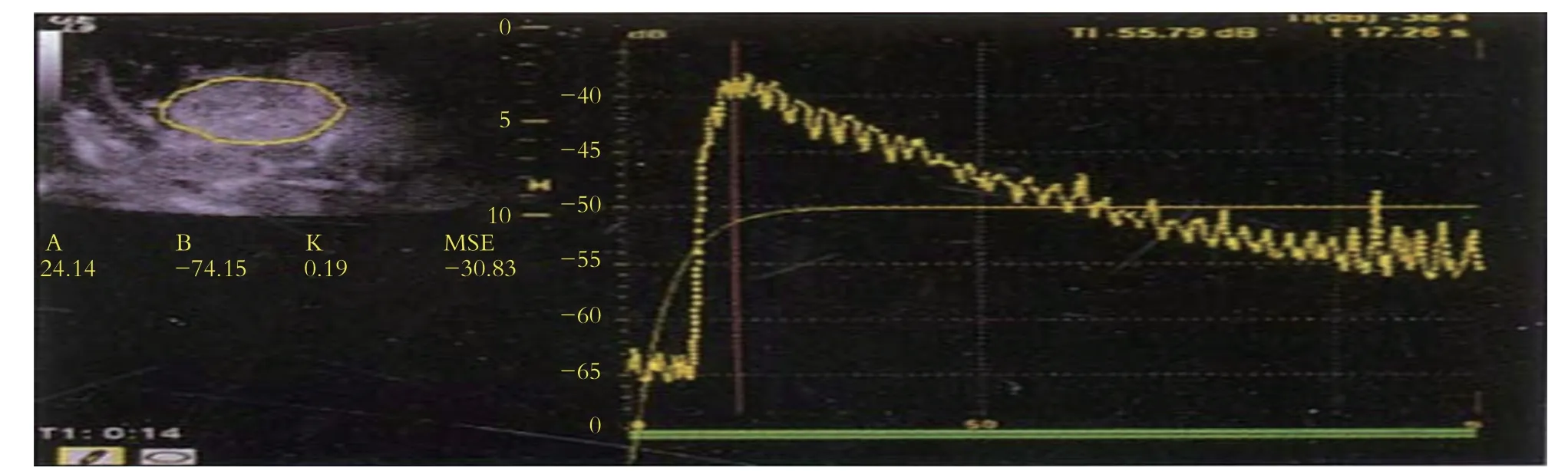
图1 肝细胞癌的时间-强度曲线示意图.
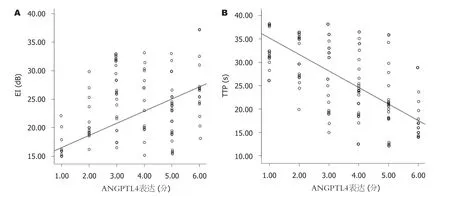
图2 散点图.A:增强强度与ANGPTL4表达水平;B:达峰时间与ANGPTL4表达水平.ANGPTL4:血管生成素样蛋白4;EI:增强强度;TTP:达峰时间.
目前,临床评估ANGPTL4表达率以及表达强度需通过获取组织标本行病理学检查实现.该方法存在创伤性、准确取材依赖性等缺点,应用受到一定限制.随着超声技术的不断发展,CEUS为肿瘤微循环血流灌注检测开辟了一条全新途径.CEUS时所采用的新型造影剂Sono Vue不会渗透至细胞间隙,具有血池示踪剂的药代动力学特性[8].CEUS能通过时间-强度曲线定量分析目标组织的血流动力学状态变化.本研究结果中,ANGPTL4阳性表达组病灶的EI显高于ANGPTL4阴性表达组(P<0.05);而ANGPTL4阳性表达组的TTP明显短于ANGPTL4阴性表达组.说明ANGPTL4阳性表达的HCC组织能在更短的时间内获得更充足的血流灌注量.原因可能是[9,10]:ANGPTL4阳性表达HCC组织通过ANGPTL4、VEGF的表达上调及分泌,诱导组织生成大量微小血管,使单位体积内微小血管数量增多,血流灌注量增大,增强强度增大.同时,由于ANGPTL4阳性表达HCC组织内存在的大量新生微小血管具有基底膜发育不全,血管平滑肌缺失、动静脉短路等特点,使微小血管阻力进一步下降,血流灌注速度增加,达峰时间缩短.本研究结果中,HCC的EI与ANGPTL4表达水平呈正相关(r=0.753,P<0.05),而TTP与ANGPTL4表达水平呈负相关(r=-0.730,P<0.05).提示CEUS可在一定程度上反映ANGPTL4表达水平状态,即EI越大或TTP越短,ANGPTL4表达水平越高.
本研究结果显示,高分化HCC的EI、ANGPTL4、MVD及VEGF水平低于中分化HCC及低分化HCC,且中分化HCC的EI、ANGPTL4、MVD及VEGF水平低于低分化HCC(P<0.05),而高分化HCC的TTP长于中分化HCC及低分化HCC,且中分化HCC的TTP长于低分化HCC,(P<0.05).提示随着HCC恶性程度增加,其微小血管生成状态越旺盛,其EI、ANGPTL4、MVD及VEGF水平呈上升趋势,而TTP呈下降趋势.证实了HCC恶性程度与其血管新生状态密切相关.
总之,HCC的CEUS灌注参数与ANGPTL4表达水平具有一定相关性,能无创性评估活体HCC组织的ANGPTL4表达水平情况,间接反映其血管新生状态.
文章亮点
实验背景
准确评估肝细胞癌(hepatocellular carcinoma,HCC)组织的血管生成素样蛋白4(angiopoietin like 4,ANGPTL4)表达水平,有助于临床诊治及预后评估.
实验动机
运用超声造影(contrast-enhanced ultrasound,CEUS)定量分析HCC的血流灌注参数,探讨其与ANGPTL4表达水平的相关性,以期为临床评估活体HCC血管新生状态提供参考.
实验目标
本篇论文研究的主要目标是探讨HCC的血流灌注参数与ANGPTL4表达水平的相关性.结果显示CEUS能客观反映HCC微循环特点,其血流参数增强强度(enhancement intensity,EI)和达峰时间(peak to time,TTP)与ANGPTL4表达水平具有较好相关性,可间接反映HCC血管新生状态.
实验方法
本篇论文为了达到目标运用CEUS观察HCC微循环血供特征.CEUS能实时显示肿瘤组织的微循环血流灌注状态,从而间接反映其血管新生情况.
实验结果
本篇论文研究达到了实验目标,研究结果显示ANGPTL4阳性表达组病灶的EI、MVD、VEGF水平明显高于ANGPTL4阴性表达组,而TTP明显短于ANGPTL4阴性表达组(P<0.05);HCC的EI与ANGPTL4表达水平呈正相关,而TTP与ANGPTL4表达水平呈负相关.本研究结果说明CEUS能敏感反映HCC血流灌注状态,间接反映ANGPTL4表达情况,有助于临床评估活体HCC的血管新生情况.
实验结论
HCC的微循环血流状态与ANGPTL4、MVD及VEGF水平密切相关.CEUS作为一种无创性的微循环血流监测手段,不仅有助于肿瘤良恶性质的鉴别诊断,而且能动态观察以及定量分析肿瘤的微循环灌注特征,间接反映肿瘤血管新生情况.本研究运用CEUS分析HCC微循环灌注特征,探讨其与ANGPTL4表达水平的相关性,以期间接反映HCC血管新生情况.本研究通过实验发现,HCC的EI、TTP均与ANGPTL4表达水平具有良好相关性.证实了CEUS可用于无创性评估活体HCC的ANGPTL4表达水平,进而间接评估活体HCC血管新生情况.
展望前景
HCC病灶位置较深时,不利于CEUS分析评估,而HCC病灶靠近膈顶或靠近胃肠道时,易受气体干扰而影响CEUS评估.未来研究的方向为CEUS在HCC抗血管生成治疗中的临床应用价值,最佳方法是运用动态三维CEUS分析HCC的微循环血流状态.

