趋化因子-肌萎缩侧索硬化症药物研发新方向
张 钊,楚世峰,董一筱,陈乃宏,
(1.天然药物活性物质与功能国家重点实验室,中国医学科学院药物研究所&神经科学中心,北京 100050;2.天津中医药大学,天津 030619)
趋化因子是一类具有多种免疫和神经功能的小分子分泌蛋白家族,具有调节白细胞转运、组织造血、淋巴系统和血管生成等功能。趋化因子及其在中枢神经系统(central nervous system,CNS)中的受体与脑生理和病理相关,其失调与众多CNS疾病有关。肌萎缩侧索硬化症(amyotrophic lateral sclerosis,ALS)发病机制复杂,至今仍无定论,目前人们普遍接受ALS为多系统功能障碍所致,尸检结果发现ALS病人CNS存在明显的氧化应激及免疫激活。ALS病人相较健康人趋化因子含量明显改变,如T淋巴细胞上CXCR3、CXCR4、CCL2和CCL5表达明显增加。ALS的发病机制与免疫紊乱有关,趋化因子参与免疫细胞的招募,提示趋化因子参与了ALS的病理进程,因此对ALS中趋化因子的作用进行研究具有重要意义。该综述对ALS中的趋化因子研究进展进行梳理分析,以期明确其研究潜能。
1 趋化因子及其功能
1.1 趋化因子及其受体趋化因子是趋化素样细胞因子,通常在组织细胞或免疫细胞受到刺激后分泌,是细胞因子中最大的家族。趋化因子起初以其能募集循环白细胞至炎症或损伤部位的特点而被定义。趋化因子含4个保守的半胱氨酸(C)。根据位于N端的前两个C之间是否插入其它氨基酸(AA)分为4个亚类,即CXC类(插入1个AA)、CC类(不插入AA)、CX3C类(插入3个AA)、C类(N端仅1个C)。目前报道的趋化因子多属于CXC类和CC类,其中CC类数量最多。CXC类趋化因子还依据NH2端是否存在谷氨酸-亮氨酸-精氨酸(ELR)三肽基序,进一步被划分为2个亚家族:ELR阳性趋化因子(ELR+) 以及 ELR阴性趋化因子(ELR-)。
趋化因子基本功能是对表达有相应趋化因子受体的细胞具有定向趋化作用。趋化因子受体通常表达于免疫细胞、内皮细胞等细胞膜上,为GTP-蛋白偶联的跨膜受体(G protein coupled receptor,GPCR)。趋化因子受体胞内第二环具有特征性的天门冬氨酸-精氨酸-酪氨酸盒(DRY box)序列可与G蛋白偶联。根据趋化因子的分类可将其受体依次命名为CXCR、CCR、CX3CR和CR。
1.2 趋化因子功能中枢神经系统损伤时,趋化因子主要由脑内驻留的小胶质细胞以及浸润的免疫细胞产生,以便进一步募集并激活白细胞,加剧炎症反应,对大脑产生不可逆性毒性损伤。近年来研究表明,趋化因子并非只出现在炎症阶段的免疫系统中,很多趋化因子组成型高表达于脑内的神经胶质及神经元,有研究者认为其可能扮演着神经递质或神经调质的重要角色,趋化因子及受体组成的“趋化因子系统”在脑发育和脑功能的运行中起着至关重要的作用。Adler等[1]认为大脑内源性趋化因子系统与神经递质和神经肽系统协同调控大脑功能,趋化因子系统被认为是大脑中的“第三大递质系统”。此外,趋化因子可募集非免疫细胞如神经干细胞、神经祖细胞、内皮细胞及骨髓基质细胞至损伤部位,促进神经新生及血管新生。因此,生理情况下趋化因子参与对大脑功能的组成型调控;病理条件下趋化因子既能募集及激活白细胞、小胶质细胞产生促炎效应,又能招募非免疫细胞,参与病变后修复过程。近年来发现趋化因子在很多神经系统疾病中异常表达[2],但在ALS中的报道甚少,本文将对ALS中趋化因子的表达及功能改变进行详述。
2ALS
ALS是累及皮层和脊髓上、下运动神经元,起病迅速的致死性运动神经退行性疾病。患者生存期短,通常发病后3~4年因呼吸肌功能障碍死于呼吸衰竭。90%以上的ALS为散发性ALS,ALS发病率于50~75岁达到峰值,随后降低,生存率可变性较高[3]。
目前ALS的治疗药物主要有:① 利鲁唑(rilutek),能将ALS病人生存期从11.8个月提高到14.8个月[4]。可改善病人生存状态,却依然无法阻止ALS病情的发展。② Nuedexta®,用于控制ALS的假性延髓情绪(pseudobulbar affect,PBA)。Nuedexta还可改善说话和吞咽能力,但其目前只在美国获批。③ 依达拉奉,虽获美国、日本和中国批准用于ALS的治疗,但其具体临床疗效尚需大量病例验证。④ 丁苯酞。其他辅助药物如鼠神经生长因子注射剂、单唾液酸四己糖神经节苷脂等在我国也用于ALS的治疗。
3 趋化因子在ALS病理进程中的作用
3.1 参与ALS的CC类趋化因子ALS病人与健康人相比趋化因子含量明显改变,如T淋巴细胞上CXCR3、CXCR4、CCL2和CCL5表达明显增加[5],下面将就按趋化因子分类阐述ALS中出现改变的趋化因子及相关效应。
3.1.1单核细胞趋化蛋白1(monocyte chemoattractant protein-1,MCP-1)/CCL2 MCP-1为MCPs家族成员之一,也称CCL2,通过结合其受体CCR2发挥功能。炎症条件下,CCR2在单核细胞的外渗和转运中具有重要功能。ALS病人T淋巴细胞及脑脊液中MCP-1的水平明显增加;SOD1 G93A ALS模型小鼠脊髓腰椎段MCP-1及CCR2表达增加始于症状之前,且CCR2在ALS样症状出现后仍进一步增加;MCP-1主要定位于运动神经元,而CCR2则专一性存在于活化的星形胶质细胞。MCP-1可介导ALS中胶质增生的进程[6]。
ALS中兴奋性毒性细胞死亡可能与GABA(A)受体流入的Cl-离子密切相关。Caioli等[7]发现MCP-1可导致ALS鼠皮层神经元GABA诱发电流的明显增强。MCP-1的作用不依赖于其受体CCR2的激活,但可被苯二氮位点拮抗剂氟马西尼(flumazenil)阻断。ALS鼠来源的皮层神经元GABA(A)受体亚单位表达水平发生变化, 然而在培养的脊髓神经元中,MCP-1造成GABA诱发电流的显著减少,该作用也通过苯二氮位点,提示一种区域特异性的作用机制,MCP-1诱导突变的皮质神经元GABA(A)受体中Cl-的高流入可能加速兴奋毒性损伤。抑制MCP-1的产生可能对ALS产生治疗效果。
Gupta等[8]招募44 位散发性ALS病人及29位正常人对照,构建模型预测发现 CCL2、CCL2 mRNA、VEGFA mRNA、吸烟、饮酒是预测ALS发病风险的自变量(P<0.05),ALS正确预测的总效度达到90.4%,其临床诊断效用需在更大的患者群体中验证。
3.1.2MIP-1α/CCL3 CCL3也称MIP-1α,其通过结合CCR1或CCR5发挥作用。Simpson等[9]发现散发性ALS患者血清中MCP-1α水平升高,但随疾病进展降低。而ALS患者与正常人脑脊液中MCP-1α水平相比无明显差异。脂过氧化产物HNE(4-hydroxy-2,3-nonenal)和MCP-1α在体外实验结果中呈负相关性,低水平的HNE刺激培养的巨噬细胞释放MCP-1α,而高水平的HNE抑制MCP-1α的释放,表明ALS患者的氧化应激增加和免疫激活具有一定的相关性。
3.1.3CCL5/RANTES CCL5可由T淋巴细胞、血小板、内皮细胞、平滑肌细胞和胶质细胞产生。正常T细胞可表达和分泌CCL5,其在受到诱导后活化,对T淋巴细胞和单核细胞具有很强的趋化活性,能促进白细胞向受损或炎症组织迁移。Rentzos等[10]对20位ALS病人、14位非炎症神经障碍患者及13位正常人的血清和脑脊液水平中的CCL5进行检测,发现ALS患者血清及脑脊液中CCL5的水平高于非炎症神经障碍患者和正常对照组,激活的小胶质细胞诱导周围炎症细胞募集到ALS患者炎症部位。然而血清和脑脊液中的CCL5水平与ALS病程并不存在相关性。
3.1.4CCL11/Eotaxin-1 CCL11(Eotaxin-1)是第一个被确定为强效嗜酸性粒细胞趋化剂的C-C类趋化因子,其可促进嗜酸性粒细胞在寄生虫感染、过敏性和自身免疫性疾病(如哮喘、特应性皮炎和炎症性肠病)炎症部位的招募。目前发现,Eotaxin家族有3个成员,分别为Eotaxin-1(CCL11)、Eotaxin-2(CCL24),以及Eotaxin-3(CCL26)。虽然仅有30%的序列同源性,但均可结合趋化因子受体CCR3。CCL11能够透过正常小鼠的血脑屏障,因此外周产生的Eotaxin可在CNS中发挥生理和病理作用。最近的研究表明,CCL11及其相关分子除了在先天免疫中的作用,还可能直接导致CNS的退化。人和小鼠在正常衰老过程中,血浆和脑脊液中的CCL11水平都会升高。但小鼠中CCL11水平异常与神经发生能力下降、认知受损相关。临床研究表明肌萎缩侧索硬化症和老年痴呆患者血浆中CCL11水平升高。Furukawa等[11]分析了ALS、进行性肌萎缩症和多发性运动神经元病患者的脑脊液(这些运动疾病常存在混淆现象),研究结果表明,确诊的ALS患者脑脊液中CCL11的水平与MMN相比明显升高。有趣的是,CCL11浓度升高与疾病进展缓慢相关。
负反转构造的存在说明研究区构造演化经历了由早期挤压应力到晚期拉张应力的转换。早期挤压形成的北西向构造带在晚期拉张应力作用下使研究区具备了良好的油气成藏条件。
3.2 参与ALS的CXC类趋化因子如前所述,CXC类趋化因子进一步分为ELR+和ELR-两个亚家族。ELR+CXC主要包括CXCL1/Gro-α、CXCL2/Gro-β、CXCL5/ENA-78、CXCL8/IL-8、CINC;ELR- CXC主要包括CXCL10/IP-10、CXCL12/SDF-1、CXCL16。
3.2.1CXCL1/Gro-α CXCL1受体为CXCR2,Zhao等[12]对ALS和正常人单核细胞进行RNA测序,发现ALS单核细胞表现出炎症特异性的基因表达谱,其中最显著的差异基因就包括CXCL1及CXCL2。Won等的研究表明,ALS中先天免疫和神经炎症病理进程涉及Toll样和NOD样受体信号通路。CXCL1-CXCR2轴在介导单核细胞浸润中具有重要作用。
3.2.2CXCL10/IP-10 CXCL10为活化的T细胞、NK细胞、树突状细胞和血液单核细胞的强效趋化因子,是许多炎症环境的重要中介,其受体为CXCR3。星形胶质细胞可分泌并对大量免疫调节因子、细胞因子/趋化因子起反应,因此其与中枢神经系统的免疫和炎症事件密切相关。星形胶质可调节的趋化因子包含 CXCL10、CXCL12、CCL2、CCL3、CCL5。正常CNS表达的趋化因子非常有限,但这些分子在ALS中表达明显升高,导致胶质微环境的紊乱,介导炎症的发展及神经元死亡[13]。
此外,Cheng等[14]研究表明,散发性ALS病人中CREST基因Q388X突变与CXCL10表达异常有关。CREST-BRG1复合物通过募集神经元中的组蛋白去乙酰化复合物至CXCL10启动子区,抑制CXCL10基因表达,诱导病理效应。
3.2.3CXCL12/SDF-1 CXCL12最初被称为基质细胞衍生因子-1(stromal cell-derived factor-1,SDF-1),几乎所有的CNS细胞类型中均有表达。CXCL12可以和CXCR4以及CXCR7结合,发挥作用。CXCR4广泛表达于神经元及胶质细胞,在发育期和成年的CNS中均有表达。CXCL12有两种亚型,为SDF-1α和SDF-1β。SDF-1α和SDF-1β可选择性地调节CXCR4依赖的白细胞浸润。SDF1-α既可通过调节谷氨酸释放信号调控神经细胞功能及凋亡,又可介导造血干细胞(HSPCs)向血中迁移并向损伤部位募集。药理性阻断CXCR4能明显延缓ALS模型鼠的疾病进程[15]。Bezzi等发现SDF-1激活CXCR4后,星形胶质细胞通过钙调方式释放谷氨酸,参与突触整合,引发胞外TNF-α的快速释放。依赖TNF-α的自分泌/旁分泌信号通路导致前列腺素的形成,不仅控制谷氨酸的释放和星形胶质细胞的通讯,也会引起胶质紊乱,无法完成胶质细胞协作,从而进一步增强CXCR4刺激下细胞因子的释放。神经胶质细胞通讯障碍可直接导致神经病理效应,通过TNF-α影响CXCR4激活的星型胶质细胞谷氨酸释放,经小胶质细胞放大使神经毒性损伤加剧。胶质与胶质、胶质与神经元之间新的通讯方式,表明干扰CXCR4依赖的星形胶质细胞信号传导的药物对ALS的病理进程有保护作用[16]。
3.3 参与ALS的CX3C类趋化因子CX3CL1/Fractalkine是CX3C趋化因子家族中的唯一成员,是仅有的两种跨膜趋化因子之一(另一个为CXCL16)。CX3CL1有两种形式,分别为膜结合型和可溶型,作用不同,前者作为CX3CR1表达细胞的粘附分子,而后者为强有力的趋化剂。CX3CL1组成型表达于神经元中,可诱导型表达于血管内皮细胞,受体为CX3CR1。CX3CR1在外周组织中多表达于巨噬细胞群,而在大脑中仅由小胶质细胞表达。CX3CL1是炎症条件下促进神经元和小胶质细胞互作的重要媒介。CX3CR1基因有两个主要功能变异V249I和T280M,均损害CX3CR1蛋白的活性,并与多种炎症性疾病相关。Lopez-Lopez等[17]发现V249I 和T280M与罹患ALS的风险均无关,但其会影响ALS 的生存期,推测CX3CR1可能是迄今为止最有效的ALS存活遗传因子,强调了免疫调控在ALS病程中的作用。
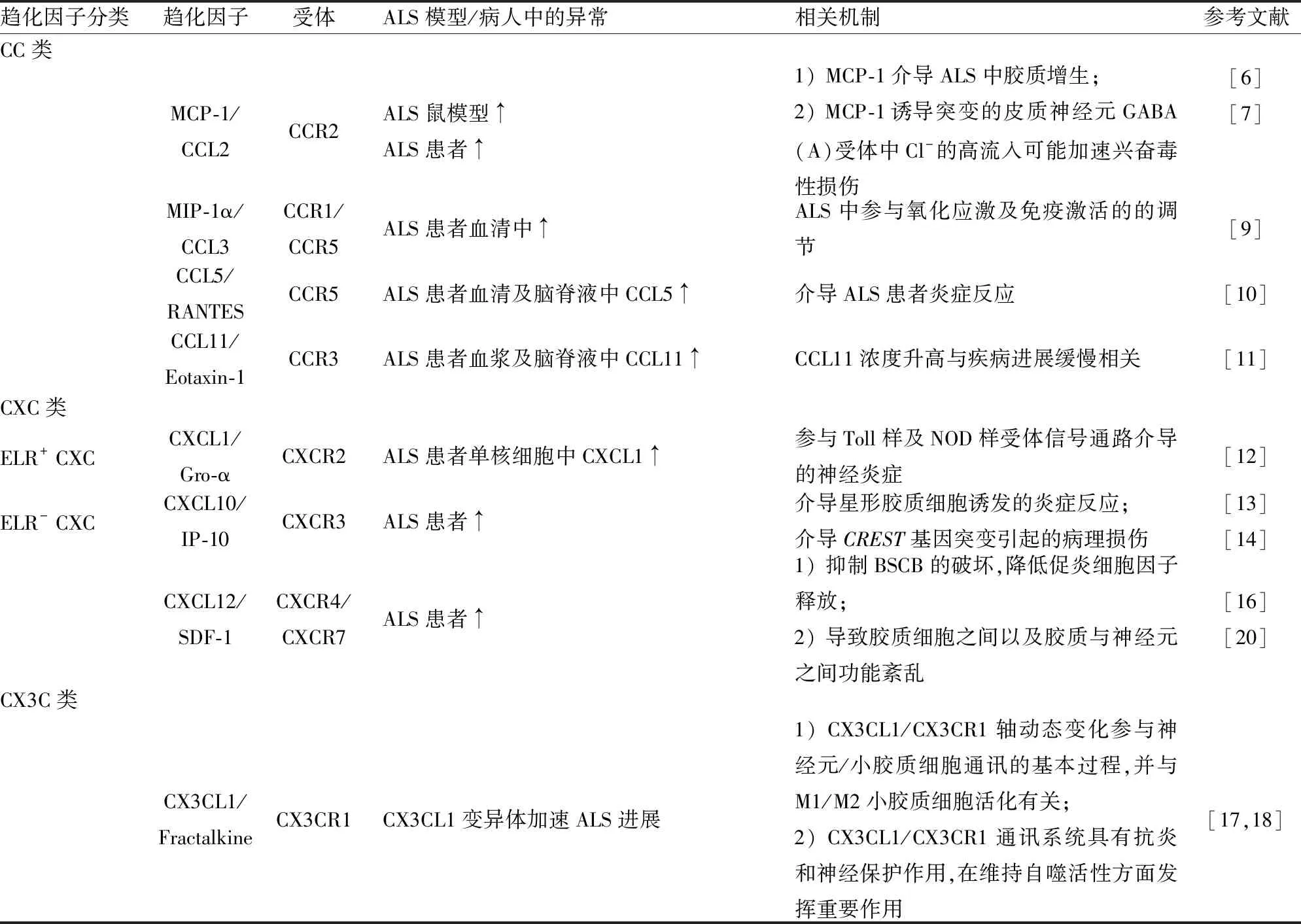
Tab 1 Summary of ALS-related chemokines
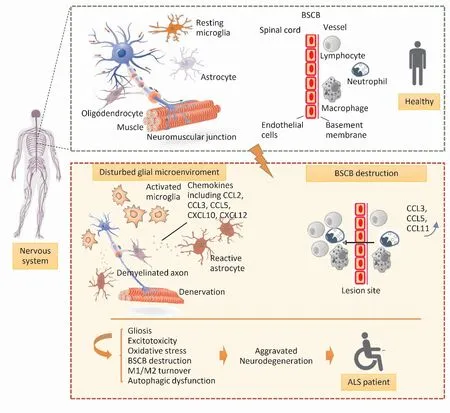
Fig 1 Role of chemokines in pathogenesis of ALS
In ALS, chemokines are released by astrocytes, which destroy the glial microenvironment, cause microglia phenotypic transformation, neuronal excitatory toxicity injury, demyelinating injury, etc. performed as denervation at neuromuscular junction. Chemokines significantly increase in the serum and cerebrospinal fluid of ALS patients, which contributes to the infiltration and migration of immunocytes to the injury site. The above mechanisms aggravate the neurodegeneration of ALS patients.
神经炎症在ALS中的作用受到越来越多的关注,小胶质细胞为神经炎症的重要组成部分,对ALS的进程有双重影响。小胶质细胞初期具有神经保护功能(M2细胞表型),但在慢性期具有明显的毒性作用(经典活化M1表型)。小胶质细胞与运动神经元的交互在ALS病理进程中具有重要作用。CX3CL1主要表达于神经元。其受体CX3CR1主要表达于小胶质细胞。强神经元兴奋可导致CX3CL1从神经元表面脱落,可溶形式的CX3CR1与其附近表达低水平CX3CR1的小胶质细胞相互作用。MNs中CX3CL1表达的动态变化及其受体CX3CR1在小胶质细胞中的表达改变可能参与神经元/小胶质细胞通讯的基本过程。破坏CX3CL1 / CX3CR1轴可激活小胶质,促进IL-1β、TNF-α的过表达。许多进展性神经炎性疾病显示CX3CL1/CX3CR1通讯系统受到破坏。Zhang等[18]研究发现CX3CL1/CX3CR1轴受损,M1/M2小胶质细胞活化不平衡,可能在ALS 的MNs退变发病机制和进展中起重要作用[18]。Liu等[19]的研究表明SOD1G93A;CX3CR1-/-小鼠比SOD1G93A;CX3CR1+/+小鼠生存期短。SOD1G93A;CX3CR1-/-小鼠在ALS终末期的神经元细胞丢失以及小胶质细胞活化较多、SOD1聚集加重、NF-κB通路被激活、自噬-溶酶体降解途径受损、自噬体成熟受损等。表明CX3CL1/CX3CR1通讯系统具有抗炎和神经保护作用,在维持自噬活性方面发挥重要作用[19]。上述研究均表明CNS中CX3CR1/CX3CL1信号的缺失可加重神经退行性病变,调节CX3CL1/CX3CR1轴和小胶质细胞活化为未来ALS治疗提供了可行性。
4 与趋化因子相关的ALS潜在治疗药物
趋化因子在ALS病理进程中的表达具有明显的变化,然而目前ALS的新药研发相对缓慢,靶向趋化因子开发的药物则更少。以趋化因子为靶点的ALS潜在治疗药物主要是CXCR4拮抗剂AMD3100。其它药物多为可影响趋化因子表达的化合物,是否能特异性靶向趋化因子仍待验证。以下将对ALS治疗中与趋化因子有关的活性物质进行简单的梳理。
4.1 Plerixafor(AMD3100)改善ALS屏障通透性ALS鼠慢性给于AMD3100可明显延长小鼠生存期、改善其运动功能。对其机制进行研究发现AMD3100可抑制CXCR4/SDF1结合,进而抑制细胞凋亡并改变HSPCs迁移及归巢;AMD3100还可显著抑制脊髓星形胶质细胞释放促炎因子;慢性给予ALS鼠AMD3100,能增加紧密连接蛋白水平,降低血脊髓屏障的通透性,增加脊髓板X区(成年干细胞形成的地方)运动神经元数目[20]。上述研究均表明基于靶向趋化因子及其受体的小分子AMD3100为ALS治疗提供了新的方向。
4.2 肝细胞生长因子(hepatocyte growth factor,HGF)HGF可减轻ALS模型小鼠脑干运动核的胶质增生和运动神经元变性。Kadoyama等[21]发现与SOD1 G93A小鼠相比,SOD1 G93A/HGF小鼠小胶质细胞和反应性星形胶质细胞的数量明显减少,面部和舌下核运动神经元的丢失减弱。过表达HGF可削弱星形胶质细胞MCP-1的诱导,抑制Caspase-1、-3和-9的活化;增加X染色体连锁抑制G93A小鼠运动神经元凋亡蛋白(XIAP)。表明HGF除直接作用于运动神经元的神经营养活性外,还可通过抑制MCP-1的诱导,缓解神经胶质增生,进而延缓疾病的进展,表明HGF为ALS患者的潜在治疗药物。
4.3 促红细胞生成素(erythropoietin,EPO)促红细胞生成素能明显降低SOD1 G93A小鼠中促炎细胞因子IFN-γ、TNF-α、IL-1β、CCL2/MCP-1、CCL5/RANTES、CXCL10/IP-10 以及IL-17A的表达[22],提示EPO对ALS治疗具有一定地辅助作用。
4.4 Rho激酶抑制剂法舒地尔法舒地尔可以降低SOD1 G93A小鼠促炎细胞因子及趋化因子TNFα、IL-6、CCL2、CCL3以及CCL5的释放,延长ALS小鼠生存期及运动功能,提示其对ALS具有神经保护及免疫调节作用[23]。
4.5 雷公藤红素(Celastrol)雷公藤红素是一种五环萜烯类化合物,可调节多种信号通路,其在SOD1 G93A小鼠模型中可阻断神经元细胞死亡,延长其生存期。研究发现雷公藤红素可负调SDF-1/CXCR4信号通路,明显调控炎症反应中 CCL2、CXCL8、CXCL10、CXCL12、CCR2以及CXCR4的表达[24],目前对Celastrol的研究尚处临床前阶段。
4.6 人参皂苷Rg1人参具有抗炎、刺激免疫应答、增加机体抵抗力等功效,有报道人参根对ALS小鼠具有神经保护功能,小鼠出生30 d后饮用人参混合水,其运动功能减退出现时间明显延后,存活率也上升。张钊等[25]的研究表明人参皂苷Rg1在ALS模型鼠中具有确切地神经保护功能;Rg1可下调剪切应激诱导的促炎细胞因子MCP-1的基因表达和单核细胞黏附,发挥抗炎功能。Rg1对趋化因子的调节是否参与其对ALS的保护作用仍待验证。
5 ALS治疗热点与免疫微环境
人们对ALS的有效治疗仍仅处于起步阶段。具体原因还是对其病理机制的理解尚浅,尤其是对病理过程中的免疫微环境并未予以重视。如基于ALS患者的诱导性多能干细胞与药物筛选是目前针对ALS患者异质性的治疗新思路,但患者自身的免疫微环境及ALS病程的动态性在研究中常被忽略;在干细胞移植治疗中,趋化因子的调控为干细胞感知并影响周围微环境发挥作用。如能阐明趋化因子在ALS中的作用机制,ALS的治疗必将获益。
6 总结与展望
ALS病因复杂,对其研究方兴未艾,本综述对其治疗现状及局限性进行了分析,并着重就其病理过程中参与的趋化因子进行了汇总。趋化因子在ALS的炎症反应中表现形式并不单一,具有动态变化,是ALS中免疫微环境的重要组成部分。针对于ALS临床转换的困难,目前最新的研究方向集中于人源特异性筛选模型的建立、干细胞移植、精准医疗等方面,但人们往往忽略了其病理不同阶段的免疫调节及免疫调节因子本身的个体差异性问题。对其进行深入地研究及区分,才有可能使我们目前的主流研究方向具有可操作性及临床转化性。

