阿魏酸对脂多糖诱导的OA软骨细胞Wnt/β-catenin信号通路的影响
刘新宁 曹滨滨 刘杰 毕建年 赵亮
骨关节炎(OA)是一种常见的关节软骨病变,以继发性骨质増生为主要的病理表现,致病原因由于过度劳损、衰老损伤、先天关节崎形等原因导致关节软骨破环、关节间隙狭窄、滑膜增生等,是困扰中老年人的健康的重要疾病之一[1-3]。患者长期忍受OA带来的困扰,极大影响生活质量,给家庭带来负担,给社会造成经济损失[4]。因此寻找新的治疗OA的方法成为医学工作者不断探寻的课题。软骨细胞是关节内合成分泌的重要细胞,能够调控关节内环境的稳定性[5],当关节内环境紊乱时,软骨细胞识别异常作出应答,调整细胞外基质的合成[6],保持关节内环境的稳定。因此软骨细胞OA是研究OA机制的好思路。Wnt/β-catenin是机体内重要的信号通路,广泛参与多种细胞的生命活动,如组织分化、损伤再生、细胞内环境维持、抗应激损伤等[7]。研究表明Wnt/β-catenin通路的激活影响软骨细胞的的增殖、分化、移行,在维持骨关节的正常结构、修复损伤过程中Wnt/β-catenin通路起重要的作用[8]。阿魏酸是从植物细胞壁提取的低毒、多酚类化合物[9]。研究表明阿魏酸具有抗氧化、抗血栓、抗炎症、抗血脂等作用,具有强大的抗炎、修复、治疗作用,广泛应用于医药领域和食品领域[10]。本研究采用LPS诱导的OA软骨细胞为模型,从Wnt/β-catenin信号通路入手探讨阿魏酸对OA软骨细胞的保护作用,为治疗OA提供理论支撑。
1 材料与方法
1.1 试验材料与主要试剂 清洁级新西兰大白兔购自福建医科大学实验动物中心提供,合格证号:SCXK(闽)2004-000;阿魏酸、LPS、Ⅱ型胶原酶采购自Sigma公司;胰蛋白酶、DMEM培养基、Ⅱ型胶原抗体购自武汉博士生物工程有限公司;BCA蛋白浓度测定试剂盒化学发光试剂盒购自广东锐博生物科技技术股份有限公司;兔抗MMP-13、兔抗COL2、兔抗大鼠wnt2、兔抗大鼠磷酸化GSK-3p (p-GSK-3p)(Ser9)抗体、兔抗β-catenin、兔抗GAPDH以及山羊抗兔IgG采购自美国abcam公司。
1.2 软骨细胞分离培养 从健康的4月龄新西兰大鼠膝盖中取软骨细胞,0.25%胰蛋白酶消化,37℃ 消化30 min,弃去胰蛋白酶,加入DMEM培养基过夜,1 200 r/min离心10 min,弃上清,加入DMEM培养基混匀,置于37℃ 恒温箱中,37℃,5%CO2培养传代。
1.3 分组处理 取对数期的软骨细胞,将细胞分为4组,空白组、OA模型组、OA+FA低剂量组、OA+FA高剂量组,2 μg/ml的LPS加入培养基中培养软骨细胞4 h,构建OA软骨细胞模型,OA+FA低剂量组、OA+FA高剂量组分别加入5 μmol/ml、20 μmol/ml的阿魏酸进行共培养。
1.4 软骨细胞的形态学观察及鉴定 取进入对数期的软骨细胞进行细胞爬片,PBS清洗,加入4%多聚甲醛覆盖爬片,25℃固定30 min,PBS清洗,滴加1%甲苯胺蓝染色30 min无菌水水浸洗30 min,95%的乙醇漂洗10 min;干燥后,中性树胶封片,观察、摄片。
1.5 CCK-8法检测软骨细胞的增殖率 取对数期的软骨细胞,调整细胞浓度为1×105个/ml,取100 μl加入到96孔板中,加入DMEM培养基放置于37℃,5%CO2培养24 h,将阿魏酸分别稀释到80、40、20、10、5 μg/ml、每孔加入10 mg/ml的CCK-8溶液,5%CO2培养4 h,弃去CCK-8溶液,加入200 μl DMSO溶液,震荡10 min,使其完全溶解,全自动酶标仪波长490 nm处测量各孔的吸光值。按照上述方法检测阿魏酸对经LPS处理过软骨细胞增殖的影响。
1.6 实时定量PCR检测COL2、MMP-13基因的表达 取4组细胞加入裂解液,混合作用10 min,12 000 r/min 4℃离心10 min,离心取上清,加入Trizol与氯仿震荡混合均匀,12 000 r/min 离心20 min,加入异丙醇,12 000 r/min离心后,弃上层清液,取管底絮状沉淀,加入Trizol与乙醇混合液,离心弃上清,沉淀则为细胞RNA。将RNA用DEPC水溶解,反转录试剂盒转录cDNA。按照SYBR方法进行实时定量PCR,并以U6为内参。反应条件为94℃,30 s,1 cycle;95℃,5 s,60℃,30 s,40 cycles;95℃,5 s,60℃,1 min,95℃,1 cycle。结果用2-ΔΔCT表示。检测各组基因的表达量。引物COL2上游5’-GTGTGTAACCCACACG-3’下游5’-GGGAGTAACACTGTGGT-3’,MMP-13上游5’-AC
ACGTAACCCCAG-3’下游5’-GGTAGTAACACTGTAAC
A-3’。
1.7 蛋白免疫印迹检测Wnt2、GSK-3β、β-catenin、COL2、MMP-13、Bcl-2、Bax蛋白的表达 加入细胞裂解液,冰上放置20~30 min,超声裂解30 s,12 000 r/min,4℃离心10 min,收集上清,置于-20℃保存。BCA定量法检测蛋白浓度,待测样品和Loading buffer混合,100℃水域变性5 min,然后加入至制备好的SDS-PAGE凝胶(5%浓缩胶,10%分离胶)上样孔中,每孔25 μl,浓缩胶时调整电压为60 V,分离胶电压为120 V,结束后取出凝胶,4℃转膜1.5 h,采用5%脱脂奶粉封闭PVDF膜2 h,加入一抗,4℃过夜,TBST洗膜后加入辣根过氧化物标记的羊抗兔IgG,37℃孕育2 h。加入ECL显影,采用自动凝胶成像系统采集图像,以GAPDH作为内参,分析蛋白水平。

2 结果
2.1 软骨细胞的鉴定 软骨细胞甲苯胺蓝染色结果显示,软骨细胞均分散分布,呈路石样,细胞浆呈浅蓝色,细胞核呈深蓝色的圆球的蓝染,高倍镜下可见细胞,形态不规则、梭形透光度良好的多层细胞,细胞核呈颜色较深的圆球状,证明培养的细胞为软骨细胞。见图1。
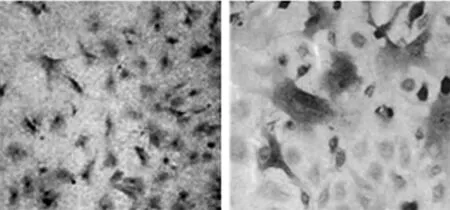

正常软骨细胞(甲苯胺蓝染色×40)正常软骨细胞(甲苯胺蓝染色×100)
图1 新西兰大白兔软骨细胞的鉴定
2.2 不同浓度的阿魏酸对正常软骨细胞增殖的影响 4组处理的OD值与空白组孔OD值比值,10、20、40 μg/ml软骨细胞的增殖率的表达显著高于5 μg/ml,差异有统计学意义(P<0.05),80 μg/ml软骨细胞的增值率的表达显著低于5 μg/ml,差异有统计学意义(P<0.05),选取5 μg/ml作为低剂量组,40 μg/ml作为高剂量组。见表1。


阿魏酸浓度(μg/ml)OD/空白组孔OD值51.02±0.06101.26±0.19*201.45±0.18*401.74±0.21*800.84±0.12*
注:与5 μg/ml组比较,*P<0.05
2.3 阿魏酸对LPS诱导的OA软骨细胞增殖的影响 空白组的软骨细胞的增值率的表达显著低于模型组,差异有统计学意义(P<0.05),低剂量组、高剂量组软骨细胞的增殖率的表达显著高于模型组,差异有统计学意义(P<0.05),且高剂量组的软骨细胞的增殖水平更高,差异有统计学意义(P<0.05)。见表2。


组别细胞增殖率空白组 98.78±1.11模型组 17.26±1.56*低剂量组54.32±4.12*#高剂量组72.32±2.21*#△
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05;与低剂量组比较,△P<0.05
2.4 阿魏酸对LPS诱导的OA软骨细胞COL2、MMP-13表达的影响 模型组的COL2基因及蛋白表达显著低于空白组,差异有统计学意义(P<0.05),低剂量组、高剂量组COL2基因及蛋白的表达量显著高于模型组,差异有统计学意义(P<0.05),且高剂量组的COL2的表达水平更高,差异有统计学意义(P<0.05)MMP-13基因及蛋白的表达,模型组的MMP-13基因及蛋白的表达显著高于空白组,差异有统计学意义(P<0.05),低剂量组、高剂量组MMP-13基因及蛋白的表达显著低于模型组,差异有统计学意义(P<0.05),且低剂量组的MMP-13的表达水平更高,差异有统计学意义(P<0.05)。见表3,图2。
2.5 阿魏酸对LPS诱导的OA软骨细胞凋亡的影响 模型组的Bcl-2/Bax显著低于空白组,差异有统计学意义(P<0.05),低剂量组、高剂量组Bcl-2/Bax显著高于模型组,差异有统计学意义(P<0.05),且高剂量组的Bcl-2/Bax水平更高,差异有统计学意义(P<0.05)。见图3,表4。
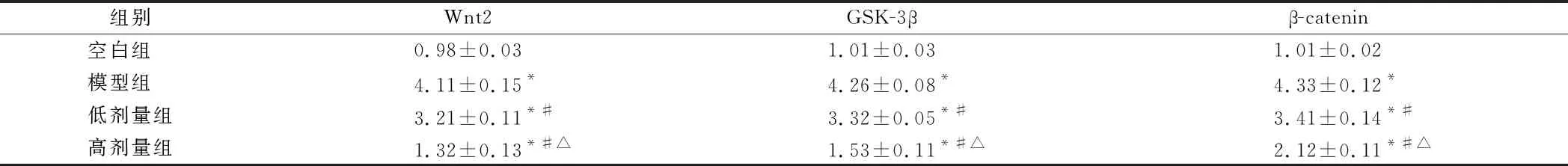
2.6 阿魏酸对软骨细胞蛋白Wnt2、GSK-3β、β-catenin的影响 与空白组相比,模型组Wnt2、GSK-3β、β-catenin水平明显升高,阿魏酸呈剂量依赖性抑制Wnt2、GSK-3β、β-catenin蛋白表达,差异有统计学意义(P<0.05)。见图4,表5。

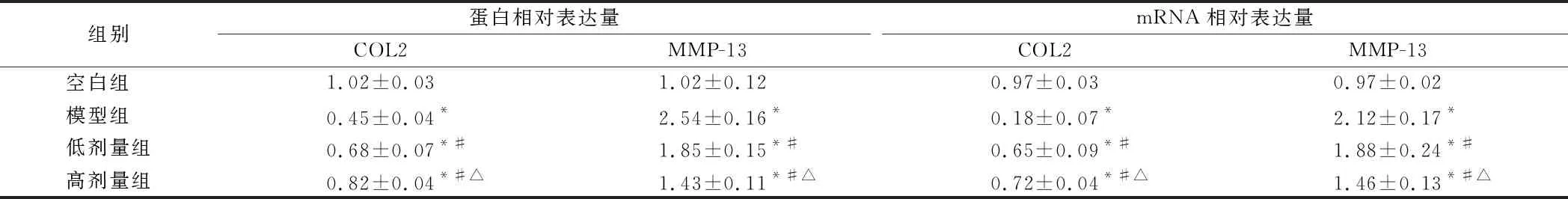
组别蛋白相对表达量COL2MMP-13mRNA相对表达量COL2MMP-13空白组 1.02±0.031.02±0.120.97±0.030.97±0.02模型组 0.45±0.04*2.54±0.16*0.18±0.07*2.12±0.17*低剂量组0.68±0.07*#1.85±0.15*#0.65±0.09*#1.88±0.24*#高剂量组0.82±0.04*#△1.43±0.11*#△0.72±0.04*#△1.46±0.13*#△
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05;与低剂量组比较,△P<0.05
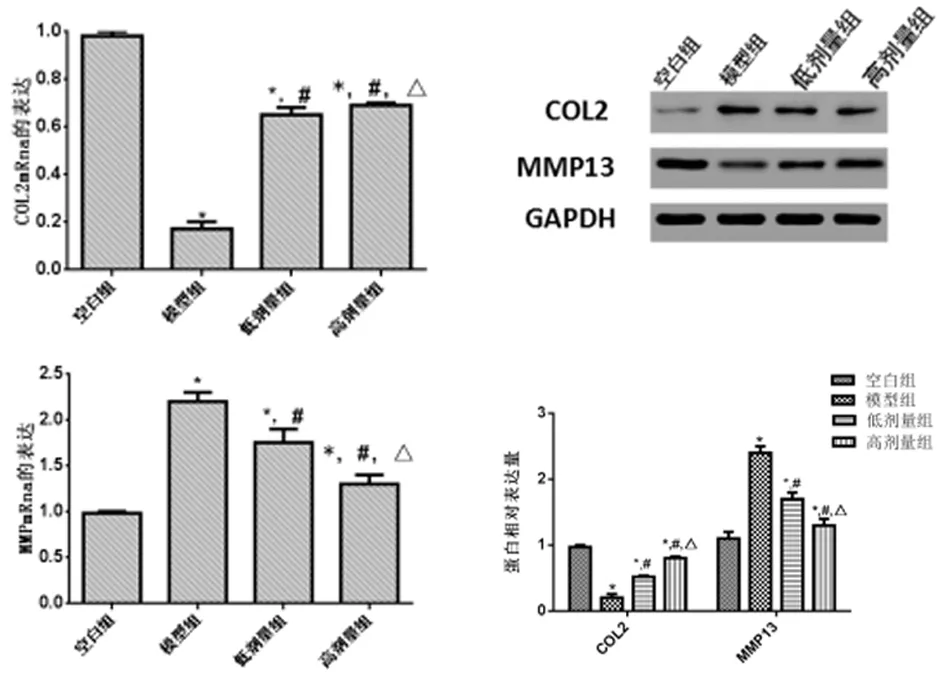
图2 阿魏酸LPS诱导的OA软骨细胞COL2、MMP-13的表达(与空白组比较,*P<0.05;与模型组比较,#P<0.05;与低剂量组比较,△P<0.05)
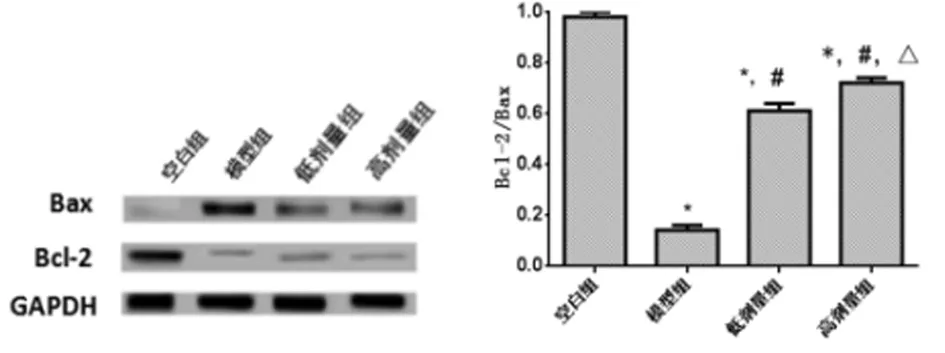
图3 阿魏酸对LPS诱导的OA软骨细胞凋亡(与空白组比较,*P<0.05;与模型组比较,#P<0.05;与低剂量组比较,△P<0.05)


组别Bcl-2/Bax空白组 1.01±0.02模型组 0.15±0.05*低剂量组0.61±0.07*#高剂量组0.72±0.05*#△
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05;与低剂量组比较,△P<0.05

图4 阿魏酸LPS诱导的OA软骨细胞蛋白Wnt2、GSK-3β、β-catenin的影响(与空白组比较,*P<0.05;与模型组比较,#P<0.05;与低剂量组比较,△P<0.05)

组别Wnt2GSK-3ββ-catenin空白组 0.98±0.031.01±0.031.01±0.02模型组 4.11±0.15*4.26±0.08*4.33±0.12*低剂量组3.21±0.11*#3.32±0.05*#3.41±0.14*#高剂量组1.32±0.13*#△1.53±0.11*#△2.12±0.11*#△
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05;与低剂量组比较,△P<0.05
3 讨论
阿魏酸具有降血脂、抗血拴、抗氧化等生物活性,能够减少机体合 IL-1β,提高机体超氧化歧化酶的活性,减少丙二醛的含量缓解OA患者的临床症状,对OA引发并发症具有良好的改善作用[11]。本研究采用LPS构建OA软骨细胞模型,然后观察阿魏酸对OA软骨细胞的作用,结果显示阿魏酸能够明显改善COL2蛋白的表达。孔长旺等[12]研究表明白阿魏酸能够显著提高COL2蛋白的表达,减少骨细胞的损害,对软骨细胞起到保护作用。与本文研究结果一致。
OA是软骨细胞和基质的退行性改变的一种骨关节疾病,主要以关节疼痛、积液渗出、活动受限为主要的临床特点。文献报道称OA最先出现骨细胞增殖障碍,细胞活性降低[13],随着病情的发展会出现关节细胞坏死,最终引起骨关节代谢性增生[14],本研究中的结果显示模型组的软骨细胞增殖活性显著低于空白组,差异有统计学意义(P<0.05),提示软骨细胞的功能状态受到了严重的损害,而低剂量组和高剂量组的细胞增殖率显著高于模型组,差异有统计学意义(P<0.05),说明阿魏酸具有保护OA软骨细胞的功能。
OA发生机制是由于蛋白酶降解细胞胞外基质及基底膜成分导致软骨细胞内环境失衡,导致细胞间质合成紊乱,大量软骨组织被溶解,抑制骨细胞分泌型溶解蛋白对维持软骨细胞的内环境,维持骨关节正常的生命活动起重要的作用[15]。MMP-13是由软骨细胞合成分泌的一种胶原酶,主要溶解Ⅱ型胶原蛋白,发生OA时,细胞碎片上调MMP-13的表达,阻碍Ⅱ型胶原蛋白的表达,加速骨蛋白的多糖的流失,使软骨细胞遭受损害[16]。本研究免疫细胞化学染色结果显示软骨基质蛋白MMP-13在OA软骨细胞的表达增高,提示骨关节基质遭到大量破坏,低剂量组和高剂量组的MMP-13表达量显著低于模型组,随浓度的增加抑制作用更强。说明阿魏酸具有保护骨关节软骨基质的作用。细胞Bax作为促凋亡基因,主要通过与线粒体结合,促进其释放促凋亡蛋白诱导凋亡,而Bcl-2则会阻止Bax与线粒体结合,从而抑制细胞凋亡[17],本研究中结果显示模型组的Bcl-2/Bax显著低于空白组,低剂量组、高剂量组Bcl-2/Bax显著高于模型组,提示白阿魏酸能够抑制软骨细胞的凋亡。
文献报道称Wnt/β-catenin信号通路与骨细胞的移行、粘附、分化、骨关节正常生长、损伤修复过程有关,该信号通路激活会加重OA的发展,经典的β-catenin信号通路活化表现为β-catenin在细胞质中积累并移向细胞核,与T细胞核因子和淋巴增强因子共同作用,启动Wnt下游转录[18]。研究表明GSK-3β能够促进β-catenin的降解,在多种肿瘤模型中已经证实抑制GSK-3β能够促进β-catenin信号通路激活[19]。研究人员将新型没食子酸作用于软骨细胞,发现该没食子酸能激活Wnt/p-catenin通路,促进软骨细胞增殖。研究结果显示采用LPS诱导OA模型后,Wnt2、β-catenin水平明显升高,且促进了GSK-3β的磷酸化,从而提示Wnt/β-catenin信号通路参与了OA的发生发展,采用阿魏酸处理后,Wnt2、β-catenin以及p-GSK-3p水平明显降低,说明白阿魏酸可能是通过抑制Wnt/β-catenin信号通路来保护DCM的心脏功能[20]。
综上所述,阿魏酸可以降低溶解蛋白的表达,提高OA软骨细胞的增殖,抑制OA软骨细胞的凋亡,其作用机制可能与Wntβ-catenin通路有关。

