循环肿瘤细胞与其多巴胺受体1表达联合检测在乳腺癌疗效监控中的应用研究
徐 彬,杨清峰,赵小玉,余元勋,李建平,刘 萍,冷雪峰,王迎新
在全球,乳腺癌是女性恶性肿瘤中发病率与死亡数最高的肿瘤,每年乳腺癌新发病例约167.1万,死亡病例约52.2 万[1];中国乳腺癌发生率占全球发病例数和死亡例数的11.2%和9.2%,乳腺癌的复发率、转移率较高[2]。近年来分子生物液体活检在乳腺癌筛查、监测、转移、复发预测中有较大进展,循环肿瘤细胞(circulating tumor cells,CTCs)是目前生物液体活检中应用较多的疗效监控的肿瘤检测指标,检测 CTCs 有其无创性、可重复性、时效性的特点[3]。CTCs检测技术常用的Cell Search系统,已被美国 FDA 批准可应用于临床检测,计数 CTCs 作为监测转移性乳腺癌无进展生存期和总生存期的预后生物标志物[4],但单一标志物容易造成部分 CTCs 会被漏检[5],故联合其他标志物,是提高CTCs检测的敏感度、特异度的重要方法。血液中的乳腺癌CTCs能表达5种多巴胺受体(dopamine receptor,DR)(DRD1,DRD2,DRD3,DRD4,DRD5)[6]等,但在正常造血干细胞不表达;DR有可能成为检测血中CTCs的生物标志物。已有学者正在研发DR调节剂,以进行乳腺癌治疗试验[7]。
现在经常用差相富集-免疫荧光原位杂交技术(subtraction enrichment and immunostaining fluorescence in situ hybridization,SE-iFISH)检测CTCs,同时联合荧光定量PCR技术(fluorescent quantitative PCR,Q-PCR)检测CTC多巴胺受体表达水平,探索其在乳腺癌监测、转移、复发预测中的应用价值。
1 材料与方法
1.1 病例资料样本随机选取自2018年4月~2019年5月安徽省妇幼保健院就诊患者,均为安徽汉族人,共计40例;SE-iFISH测试组包括:① 20例健康体检女性,年龄41~55(48.7±6.16)岁;② 20例为治疗前乳腺癌女性,均未接受相关治疗,年龄48~69(55.6±8.21) 岁。另在20例治疗前乳腺癌女性中选取6例乳腺癌患者为术后观察组。参与研究者,均签署知情同意书。
对SE-iFISH测试组,采集外周血7.5 ml、ACD抗凝,应用SE-iFISH 检测CTCs,评判检测的灵敏度、特异度。再在术后3、6个月对观察组6例乳腺癌患者进行外周血采集、SE-iFISH 检测CTCs、Q-PCR检测CTC DRD1。
1.2 SE-iFISH检测SE-iFISH 检测CTCs的试剂盒,由赛特生物医药科技有限公司提供,具体操作步骤基本如下:
采集7.5 ml外周静脉血到ACD抗凝管中。2 000 r/min离心8 min,去除血浆;在离心管中,加入3 ml密度梯度分离液,离心并去除该分离液上叠加的红细胞。再1 800 r/min离心8 min,将含白细胞和CTCs的液层,吸到另一离心管中,加200 μl磁珠,摇床摇动室温孵育20 min后,1 800 r/min离心8 min,去除白细胞和磁珠,CTCs混合液移到15 ml离心管中。加入抗原修复液修复抗原后,再加入anti-D45抗体与anti-CK18抗体、 抗体稀释液的混合液,室温避光孵育20 min,2 500r/min离心5 min,弃大部分上清液至余下100 μl,沉淀细胞后,加入100 μl固定液混匀、涂片,32 ℃过夜烘干玻片。在玻片进行原位CEP8探针杂交。最后滴加5 μl DAPI染液封片并于荧光显微镜下观察。
结果判读:CTCs的表型为:CK+/CD45-/DAPI+/CEP8+=2;CK+/CD45-/DAPI+/CEP8+>2;CK-/CD45-/DAPI+/CEP8+>2。
1.3 CTCs DR Q-PCR检测采集7.5 ml外周静脉血到ACD抗凝管中。按照上述步骤去除血浆、红细胞、白细胞后,将含有CTCs的细胞混合液,通过细胞总RNA提取试剂盒(DP430),进行CTCs的RNA抽提,然后用Quant one step qRT-PCR Kit(SYBR Green,FP303)进行 Q-PCR检测。引物序列见表1。最后进行数据分析。

表1 相关引物序列
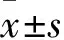
2 结果
2.1 乳腺癌术后患者CTCs计数与临床病理特征的关系CTCs的计数与乳腺癌的分子分型有关(P=0.007),但与患者的年龄、肿瘤分期、组织分级、淋巴结转移、病理类型、ER、PR、HER-2、Ki-67 表达情况无关(P>0.05)。见表 2。
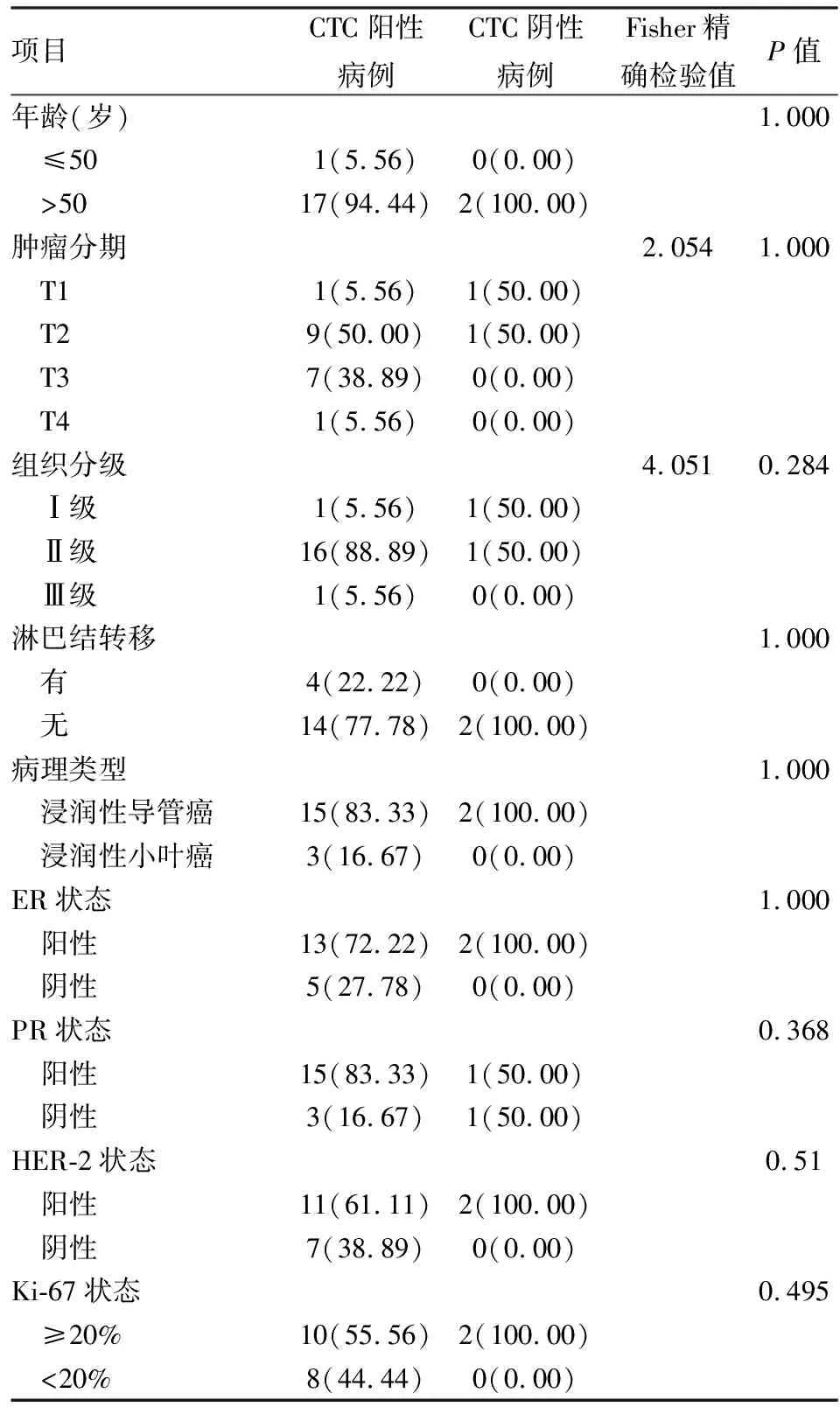
表2 20例乳腺癌术后患者CTC计数与临床
2.2 SE-iFISH在乳腺癌外周血CTCs检测中有较高的灵敏度、特异度结果显示,20例健康人CTCs的检出率为0。而随机选取的20例治疗前乳腺癌患者中,18例检出了CTCs(90.0%),其平均值为7.85 CTCs/7.5 ml外周血(图1A、B、C)。说明该检测方法灵敏度、特异度较好,适合本研究应用。
2.3 DRD1在乳腺癌CTCs上的表达量比DRD2、DRD3和DRD4更高结果显示,20例乳腺癌患者CTCs细胞的DRD 平均CT值:DRD1为21.60、DRD2 为40.02、DRD3为32.62、DRD4为41.40,对照GAPDH为18.68(图2)。与DRD2、DRD3和DRD4的反应CT值比,DRD1的反应CT值较高,可能较适合本实验研究。

图1 SE-iFISH检测CTCs结果 ×400(merge即合并图)
A:20例治疗前乳腺癌患者7.5 ml外周血的CTCs检出值;B图:CTCs细胞相关标志物检测结果;C:红细胞相关标志物检测结果;橙色:CEP8染色;红色:CD45染色;绿色:CK18染色;蓝色:DAPI染色

图2 乳腺癌CTCs细胞的DRD1、DRD2、DRD3
2.4 联合CTCs、CTC DRD1表达量检测对乳腺癌监控有较好的效果为了研究CTCs和CTCs DRD1表达量在乳腺癌病情进展中的变化,选择6例治疗前乳腺癌患者(患者1、2、6为T3期,患者3、4、5为T2期)进入术后观察组,进行术后3、6个月时的外周血采集、SE-iFISH 检测CTCs结果见图3、Q-PCR检测CTCs DRD1见图3;同时结合临床B超、CT检查,观察患者乳腺癌疗效、进展情况。
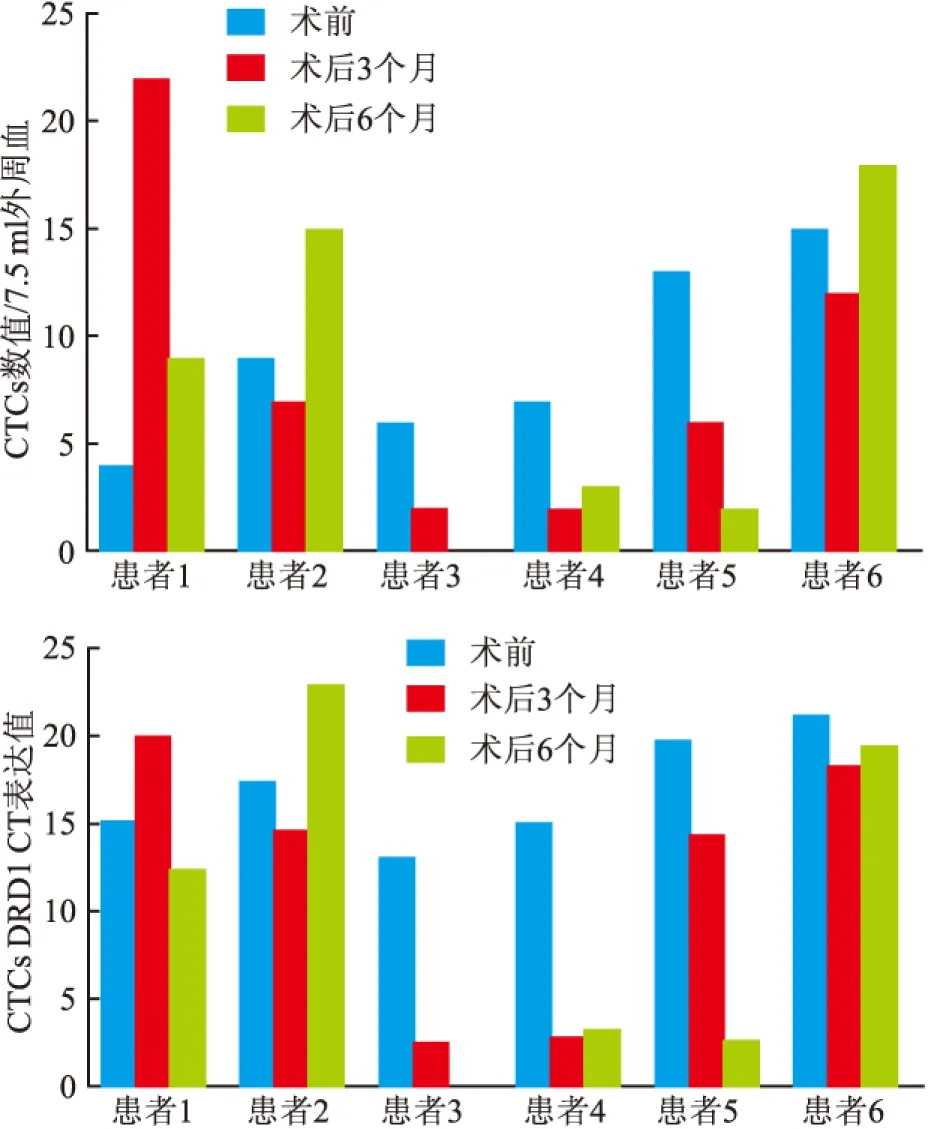
图3 患者1、2、3、4、5、6术前、术后3、6个月CTCs数值
总体看,结果分两类:第一类是T2期的患者3、4、5的CTCs和CTCs DRD1 2-△△Ct都呈下降趋势(图4);临床CT、B超等的后续监控结果也显示预后良好。第二类是T3期的患者1、2、6的CTCs和CTCs DRD1 2-△△Ct开始呈下降趋势,后来呈上升趋势(图4),后续监控发现第二类患者病情预后不良,并发生转移。总体看,两类患者 CTCs和CTCs DRD1 2-△△Ct与T分期、乳腺癌进展有较好的一致性,可以有效辅助临床监控。
3 讨论
Cell Search平台检测的CTCs数量变化对转移性乳腺癌患者有预后价值,可评估转移复发风险,动态监测疗效,指导个体化用药,Yu et al[8]研究发现,乳腺癌患者血常含有间质细胞表型的CTCs,并能通过上皮细胞-间质细胞转化迁入血循环,其中含有少数有高度转移潜能的CTCs,在肿瘤的发生、浸润、进展中有重要作用。乳腺癌患者外周血中CTCs数量极少,约为单个核细胞数目的 1/105[9],因此要有高度特异和灵敏的CTCs检测方法。本研究通过SE-iFISH CTCs检测,20例健康人CTCs的筛查结果为0,而20例治疗前的乳腺癌患者的CTCs有90%的检出阳性率,说明该方法灵敏度和特异度较好,对后续鉴定所使用标志物的选择更为灵活。
图4 患者1、2、3、4、5、6术前、术后3、6个月CTCs和CTCs DRD1 2-△△Ct监控统计图
Giordano et al[10]分析发现,CTCs能预测转移性乳腺癌患者的生存率,外周血CTCs数量与患者的转移、耐药、预后不良相关。乳腺癌患者在接受有效治疗后,血中CTCs数量会减少。Jiang et al[11]对294例转移性乳腺癌患者研究证实,CTCs在我国转移性乳腺癌监控中有应用价值,115例患者中,检出CTCs≥5/7.5 ml,CTCs数量增加与转移相关。CTCs已被写入美国AJCC指南(第八版)和2019年中国乳腺癌诊治指南,作为远处转移的标准之一。对血CTCs的筛查,有利于发现转移、监测疗效、评估预后[12]。
Sachlos et al[13]发现,DR可能是乳腺癌肿瘤干细胞(cancer stem cells,CSCs)的生物标志物,DR在有5种(正常乳腺干细胞不表达),参与乳腺癌细胞的增殖、转移,DR拮抗剂硫利达嗪、三氟拉嗪,能抑制CSCs细胞膜的D2受体,抑制CTCs增殖;提示其外周血CSCs的DR是较理想的标志物,与乳腺癌治疗、预后相关,约30% 晚期乳腺癌表达DRD1,常有更大肿瘤、更多淋巴结转移、更短生存[14]。CTCs DRD1的表达量更高,本实验选取检测DRD1。
在进行乳腺癌病情监控时,因各种原因一些受试者未进行多次检测,只有术前检测数据,仅6例乳腺癌患者做了术后3、6个月的DRD1血水平检测。从检测总体结果看,T3期的患者其CTCs和CTC DRD1 术前检出值比T2期患者的高;6个月时复查检出CTCs较多、CTCs DRD1水平升高,后续发生癌症转移,且预后不良。T2期患者6个月复查检出CTCs较少、CTCs DRD1水平降低,其后续预后良好,目前没有复发迹象。但因入组人数较少,监控次数较少,后续还需要继续入组更多的患者,并对其疾病进展进行长期监控,从而获得更多的数据,并进行更加精确的分析以明确CTCs DRD1检测对乳腺癌患者临床应用的价值,为乳腺癌DR靶向药的应用提供更多的理论依据,研究中患者的随访工作还在进行中。

