空间立构pH敏感喜树碱新型纳米胶束药动学研究
徐文霞,赵 科,刘 源,孙文霞,任 静
(四川省药物制剂及装备工程技术研究中心,四川抗菌素工业研究所,成都大学,成都 610052)
喜树碱(camptothecin,CPT)是S-期型抗癌药物,临床具有显著的抗癌活性[1,2]。但天然喜树碱内酯环不稳定,具有例如血尿、尿频、腹泻等严重的不良反应[3,4],限制了其临床使用。聚乳酸作为一种天然高分子材料,具有良好的生物降解性能和优良的生物相容性;而空间立构复合物是一种由两个互补的有规立构聚合物之间的立体选择性相互作用而形成的复合物,它与其母体对映物相比有着稳定性更好的显著优点。聚合物胶束具有特殊的核-壳结构(疏水嵌段为内核,亲水嵌段为外壳),其内核载药,增溶难溶性药物;而外壳可避免胶束被体内网状内皮系统( reticulo-endothelial system,RES) 识别和摄取,延长药物在体内的循环时间,并保持其稳定[5]。因此,聚乳酸空间立构复合物作为药物载体具有独特的物理化学稳定性,在药物传输领域有着极大的应用潜力[6-8]。本实验室前期已制备得到聚乳酸空间立构复合物为载体的喜树碱新型纳米胶束(camptothecin nanomicelles, CPT-NC),体外质量评价良好,现分别采用大鼠及小鼠对其体内过程进行进一步的研究和评价,以为制剂产品开发奠定生物药剂学基础。
1 材料与方法
1.1 动物SD大鼠20只(雌雄各半,SPF级,200~250 g),昆明种小鼠24只(雌雄各半,SPF级,25~30 g),均由成都中医药大学实验动物研究中心提供,合格证号:SYXK(川) 2015-030。
1.2 药品与试剂CPT对照品,含量>98%,批号:drk-0333-920417,购自成都德锐可生物科技有限公司;CPT原料药,含量98%,批号:C-12246,购自天津希恩思生化科技有限公司;盐酸伊立替康(内标)对照品,含量 98%,批号:C023D130909,购自四川协力制药有限公司;CPT-NC,自制。生理盐水,含量0.9%,购自四川科伦药业股份有限公司;甲醇、乙腈为色谱纯;其余试剂均为分析纯。
1.3 仪器LC-10A高效液相色谱仪,日本岛津公司产品;BSA224S万分之一电子天平,赛多利斯科学仪器(北京)有限公司产品;BP-211D电子分析天平,德国Sartorius公司产品;Allrgra X-30系列离心机,贝克曼库尔特商贸(中国有限公司)产品;XW-80A旋涡混合器,上海精科实业有限公司产品。
1.4 溶液配制
1.4.1对照品溶液 称取CPT对照品10.0 mg,置于50 mL容量瓶中,用甲醇溶解,超声波振荡20 min,至样品完全溶解,甲醇定容得200 mg·L-1CPT储备液;取储备液适量用甲醇稀释得到浓度为50、25、5、2.5、0.5、0.25、0.05 mg·L-1的内酯型CPT对照品系列工作溶液。
1.4.2内标溶液 称取盐酸伊立替康对照品适量,用甲醇配制成浓度为20 mg·L-1的溶液作为内标溶液。
1.4.3CPT混悬型注射液(CPT-Free) 取CPT适量,用少量聚氧乙烯蓖麻油和乙醇(体积比为1 ∶ 1)溶解,然后保存在-20 ℃的冰箱中备用,注射前直接用生理盐水稀释即可。
1.5 药动学给药方案及血样本采集20只SD大鼠,雌雄各半,随机分成4组(编号A,B,C,D),每组5只。A、B、C组给予CPT-NC,给药剂量分别为0.25、0.5、1mg·kg-1;D组给予CPT-Free,给药剂量为0.5 mg·kg-1。CPT-NC与CPT-Free使用前均用生理盐水稀释至使用浓度,尾静脉注射给药。给药前禁食12 h,给药后继续禁食24 h,全程不禁水,分别于给药前以及给药后5、15、30 min,以及1、2、4、8、12、24 h眼眶取血0.5 mL,置肝素化离心管中,8 000 r·min-1离心5 min,分离血浆置-20 ℃冰箱中保存待测。
1.6 组织分布给药方案及样本采集选取雌雄各半共24只小鼠,并随机分成2组,尾静脉注射CPT-NC或 CPT-Free,给药剂量0.8 mg·kg-1,给药后分别于0.5、1、4、12 h(每组每个点3只)进行眼眶取血,小鼠处死后取出心、肝、脾、肺和肾,并用生理盐水冲洗干净,用滤纸吸干,称重,以3倍量的生理盐水混合匀浆。血浆样品与组织匀浆液置-20 ℃冰箱中保存待测。
1.7 测定条件与样本处理
1.7.1色谱条件 色谱柱:HypersiL BDS-C18 (5 μm,200 mm×4.6 mm);流动相:乙腈 ∶ 磷酸盐缓冲液(pH 5.0)= 29 ∶ 71;流速:1 mL·min-1;检测波长:254 nm;柱温:25 ℃;进样量:20 μL。
1.7.2血浆样品处理 取血浆样品100 μL,同时加入内标溶液20 μL、甲醇20 μL、乙酸乙酯300 μL,涡旋混合1 min;然后12 000 r·min-1离心5 min,取上清液空气流挥干后加入100 μL甲醇复溶,涡旋混合1 min后再12 000 r·min-1离心5 min,取上清液20 μL注入色谱仪,记录色谱峰,以内标法按随行标准曲线测定血浆样品的浓度。
1.7.3组织样品处理 组织样品处理方式同“1.7.2”项。
1.8 方法学考察
1.8.1专属性 在“2.4”色谱条件下,分别将空白血浆(空白组织)、加入对照品溶液和内标物的模拟血浆样品(组织样品)和血浆样品(组织样品)处理后进样检测,记录色谱图观察内源性杂质的色谱峰对内标物和内酯型CPT的色谱峰测定是否有干扰,验证其专属性。
1.8.2标准曲线与定量限 取大鼠空白血浆100 μL,加入不同质量浓度的内酯型CPT对照品工作溶液20 μL,配制成含CPT 0.05、0.1、0.5、1、5、10 mg·L-1的模拟血浆样品;同法取小鼠空白生物样品配制成含CPT 0.01、0.05、0.1、0.5、1、5 mg·L-1的模拟血浆样品。按照“2.4”项下方法处理,以CPT与内标峰面积比值为纵坐标(Y),CPT浓度为横坐标(X),采用加权最小二乘法进行回归运算。定量限确定采用信噪比法,制备系列浓度的生物样品,HPLC进样测定峰面积,计算样品信号强度(S)与基线噪音强度(N)的比例,以S/N=10时的最低样品浓度作为定量限。
1.8.3精密度与方法回收率 取大鼠空白血浆,制成含CPT 0.05、0.1、1、5 mg·L-1的质控样品(QC样品)各5份;取小鼠空白血浆,制成含CPT 0.01、0.1、1、5 mg·L-1的QC样品各5份。HPLC进样分析,每一浓度平行5样本分析,连续测定3天,根据每批随行标准曲线,计算QC样品中CPT的浓度,以测得值与加入值之比计算方法回收率,并计算日内和日间精密度。
1.8.4萃取回收率 取空白血浆(空白组织),制成含CPT 1 mg·L-1(0.1 mg·L-1)的QC样品5份;不加空白血浆(空白组织),同法制备制成含CPT 1 mg·L-1(0.1 mg·L-1)的甲醇溶液5份,分别取20 μL注入色谱仪,记录色谱峰,得到萃取的CPT与内标峰面积和未经萃取的CPT与内标峰面积;以峰面积比值计算CPT与内标的萃取回收率。
1.8.5稳定性 取适量大鼠空白血浆样品,配制成含CPT 0.1、1、5 mg·L-1的血浆样品;取适量小鼠匀浆组织或血浆样品,配制成含CPT 0.01、0.1、1 mg·L-1的匀浆组织或血浆样品。将样品放置冰箱中,经3次冷冻-融化循环、室温下放置4 h以及样品处理后上清液经室温放置8 h后,HPLC进样分析,考察样品的稳定性。
2 结果
2.1 方法学评价
2.1.1大鼠体内分析方法学评价 专属性 如Fig 1所示,大鼠血浆中内酯型CPT及其内标盐酸伊立替康的出峰时间为8 min和5 min左右;内源性物质不干扰内酯型CPT及其内标的测定,方法专属性良好。

Fig 1 HPLC chromatogram of rat plasma sample
A: Blank plasma; B: Blank plasma+CPT+internal standard; C: Plasma samples after administration; 1: Lactone CPT;2: Internal standard
标准曲线与定量下限 内酯型CPT线性回归方程为:Y=0.39X+1.8×10-3,R2=0.9997;在(0.05~10)mg·L-1浓度范围内,线性关系良好,定量下限为0.05 mg·L-1。
精密度与方法回收率 如Tab 1所示,定量下限、低、中、高4个浓度QC样品的日内和日间精密度(RSD%)均小于15%,方法回收率大于98%。
萃取回收率 CPT与内标的萃取回收率分别为(57.08±1.96)%和(62.89±2.93)%,RSD小于5%,说明该提取方法稳定可靠。
稳定性 0.1、1、5 mg·L-1的大鼠血浆样品经3次冷冻-融化循环、室温下放置4 h以及样品处理后上清液经室温放置8 h后,稳定性结果RSD均小于8.04%,表明在上述条件下CPT稳定性良好。
2.1.2小鼠生物样品测定方法学评价 专属性 结果显示,各生物样品中的内源性物质不会干扰CPT及内标的测定。小鼠血浆与各组织色谱图如Fig 2所示,内酯型CPT及其内标盐酸伊立替康的出峰时间为8 min和5 min左右,以肝组织色谱图为代表,其他组织与之类似。
标准曲线与定量下限 CPT在血浆与各组织的标准曲线见Tab 2。在线性范围(0.01~5)mg·L-1内,线性关系良好,经实验测得CPT的定量限为10 μg·L-1。
精密度与方法回收率 测得CPT在小鼠血浆和各组织中定量下限、低、中、高4个浓度QC样品的日内精密度为3.54%~9.04%,日间精密度为 2.67%~8.56%,方法回收率在98.4%~104.0%内波动。
萃取回收率 各生物样品中CPT和内标的萃取回收率稳定,RSD均小于10%,说明该提取方法稳定可靠。
稳定性 0.01、0.1、1mg·L-1的小鼠生物样品经3次冷冻-融化循环、室温下放置4 h以及样品处理后上清液经室温放置8 h后,稳定性结果RSD均小于9.18%,表明在上述条件下CPT稳定性良好。
2.2 血药浓度——时间曲线大鼠尾静脉注射CPT-Free和CPT-NC的平均血药浓度—时间曲线见Fig 3。由Fig 3可见,高、中、低3个剂量下,CPT-NC组随着给药剂量的增大,各时间点血药浓度变化趋势一致,AUC(0-t)相应增大。而在相同给药剂量下,CPT-NC组的AUC(0-t)明显大于CPT-Free组,且CPT-Free组的血药浓度下降较CPT-NC组快。
2.3 药动学参数大鼠体内药代动力学参数结果见Tab 3。如Tab 3所示,低、中、高剂量下,载CPT纳米胶束的Cmax分别为(3.07±0.89、4.04±0.50和6.30±0.53)mg·L-1,AUC(0-t)分别为(30.13±3.18、43.49±4.56和56.58±6.18)mg·L-1·h,两者随着给药剂量的增加而增加,在(0.25~1) mg·kg-1给药剂量下呈线性关系。在相同给药剂量下,结果载药胶束的AUC(0-t)为(43.49±4.56)mg·L-1·h,CPT的AUC(0-t)为(33.01±2.95)mg·L-1·h,载药胶束AUC为CPT的1.32倍,差异具有统计学意义(P<0.01)。载药胶束的t1/2为(9.73±0.19)h,CPT的t1/2为(8.31±1.93)h,前者是后者的1.17倍,差异具有统计学意义(P<0.05)。
Fig 2 HPLC chromatogram of biological samples (A1. Blank plasma; A2. Blank plasma + CPT + internal standard; A3. Plasma samples after administration; B1. Blank liver; B2. Blank liver+ CPT + internal standard;B3. Liver samples after administration;1. Lactone CPT;2. Internal standard)

Fig 3 Average plasma concentration-time curve of CPT-free and CPT-NC after intravenous administration (n=5)

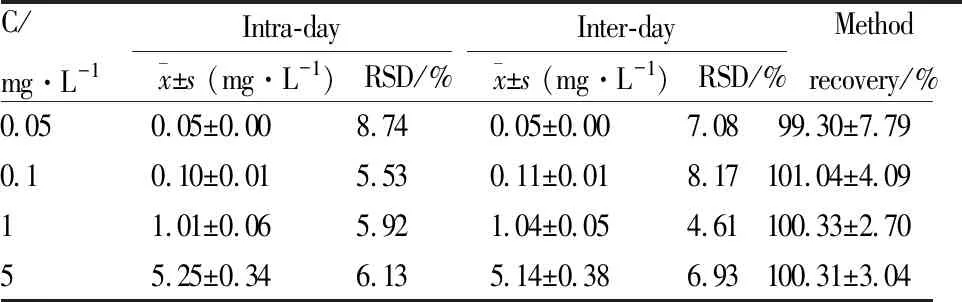
C/mg·L-1Intra-day x±s (mg·L-1)RSD/%Inter-dayx±s (mg·L-1)RSD/%Methodrecovery/%0.050.05±0.008.740.05±0.007.0899.30±7.790.10.10±0.015.530.11±0.018.17101.04±4.0911.01±0.065.921.04±0.054.61100.33±2.7055.25±0.346.135.14±0.386.93100.31±3.04

Tab 2 Standard curves of CPT in plasma and tissues(n=6)
2.4 组织分布结果小鼠尾静脉注射CPT-Free和CPT-NC后不同时间内酯型CPT含量变化见Tab 4。
从表中可见,给药0.5 h后,CPT-NC组在血浆中的浓度最大,CPT-Free组在肝组织的浓度最大,两给药组在心、肝、脾、肺、肾等多组织中均能检测到一定浓度的内酯型CPT,表明注射给药后内酯型CPT能较快分布到多种组织器官中。给药1 h后,两给药组的脾、肺和肾中内酯型CPT浓度均有提升,特别是载药胶束组在肺组织中达到峰值。给药4 h后,各组织中CPT浓度均有一定程度的降低,至12 h各组织中仍能检测到内酯型CPT。CPT-Free组的内酯型CPT在组织中暴露量的大小顺序为肝>肺>心>脾>肾;CPT-NC组的内酯型CPT在组织中暴露量的大小顺序为肺>心>肝>脾>肾。

Tab 3 Pharmacokinetic parameters of CPT-free and CPT-NC in
*P<0.05,**P<0.01vsCPT-free

Tab 4 CPT concentration at different time points in plasma and tissue of mice after CPT-free and CPT-CN injection(n=3,
*P<0.05,**P<0.01vsCPT-free
3 讨论
CPT自然状态下存在两种形式:闭合内酯型和开环羧酸盐型。在缓冲体系中,内酯型与羧酸盐型的CPT之间存在着动态平衡[9],但只有闭合内酯型的CPT能够抑制Topo Ⅰ,因此本研究选择测定内酯型CPT含量更能反映CPT在体内的真实情况。大鼠药动学研究结果显示,CPT-NC组的Cmax和AUC(0-t)随着给药剂量的增加而增加,在(0.25~1)mg·kg-1给药剂量下呈线性关系。在相同给药剂量下,CPT-NC组的AUC(0-t)为CPT-Free组的AUC(0-t)的1.32倍,表明胶束载药系统对内酯型CPT具有保护作用,可以抑制内酯环CPT的开环。CPT-NC组的t1/2为CPT-Free组的t1/2的1.17倍。以上结果反映载药胶束能有效保护内酯型CPT,提高其生物利用度,增强治疗效果。该纳米载药胶束提高 CPT生物利用度的原因可能是: 其核-壳结构上的聚乙二醇可以减少载体与血液成分的相互作用,减少RES 系统的摄取和肾脏的清除,从而延长载药胶束在体内的半衰期;加上空间立构复合物稳定性更好,可以有效保护CPT的内酯环;另外,CPT属于难溶性药物,通过胶束疏水端的包裹可以增加其溶解度,改善其在体内的吸收和分布;综上所述,该新型纳米载药胶束可以有效提高CPT的生物利用度,并增强其治疗效果。
小鼠体内组织分布的结果显示:小鼠尾静脉注射给药后内酯型CPT在各组织中分布广泛,各组织中均检出内酯型CPT,且分布迅速,特别是肝和肺组织中。该载药胶束可以通过其天然被动靶向发挥作用,如其对心脏和肝脏的靶向性;但一般被肺组织截留的粒子粒径需大于7 μm,这远远大于纳米胶束200 nm的粒径,因此,其对肺的高亲和性可能是因为聚乳酸空间立构复合胶束表面带正电荷,而表面带正电荷的粒子由于静电作用更易被肺组织摄取。在整个体内过程中,CPT-NC组进入肺中的内酯型CPT含量都比CPT-Free组高很多,说明载药胶束在肺中的靶向作用更强,提示我们载药胶束对肺癌可能有较好的治疗作用。而且,CPT-NC组在脾和肾脏中的分布较低,可以减轻对脾肾患者的毒副作用,在临床治疗上有重要意义。

