抗体滴定在血液细胞流式细胞术中的应用
张晓茹, 张明英, 刘怡宁, 付莉霞, 邢文, 周圆*
1.中国医学科学院&北京协和医学院血液病医院(血液学研究所), 实验血液学国家重点实验室, 国家血液病临床医学研究中心, 天津 300020;2.天津医科大学第二医院, 天津 300211
流式细胞术是一种利用流式细胞仪(flow cytometer)检测标记的荧光信号,对单细胞悬液中细胞、血小板、细胞器等生物粒子实现高速、逐一的细胞定量分析和分选的生物技术。随着多参数流式细胞术的应用,其已成为血液病研究和诊断不可或缺的生物技术之一,但是在流式细胞术的实验过程中面临诸多问题,如存在非特异染色、抗体价格昂贵等。合适的抗体浓度是染色成功的关键,抗体浓度过高时会增加抗原阴性细胞的非特异染色,使抗原阳性细胞与抗原阴性细胞分离效果不佳;抗体浓度过低时会使抗原阳性细胞荧光信号偏低,降低荧光测量的灵敏度[1-3]。因此,找到抗体的最佳使用浓度不仅可以节约成本,更可以使阳性群和阴性群达到最佳分离效果,提高实验准确性[4]。其他条件如细胞数量、染色时间和固定与否都对染色效果有一定影响。抗体滴定是确定最佳抗体浓度和抗体数量、消除非特异染色、实现信噪比最高的方法。染色指数(staining index,SI)是可靠地衡量阳性细胞群和阴性细胞群之间分离程度的一个指标,它与荧光素阳性群的平均荧光强度(mean fluorescent intensity,MFI)成正比,与荧光素阴性群的MFI成反比,抗体滴定的目的即找到染色指数最高的实验条件。血液细胞包括骨髓细胞和外周血细胞,本研究以小鼠骨髓细胞为被标记细胞,选择利用非串联荧光染料FITC标记的大鼠抗小鼠CD11b抗体(FITC Rat Anti-Mouse CD11b)和串联荧光染料APC-eFluor780标记的大鼠抗小鼠CD11b抗体(APC-eFluor780 Rat Anti-Mouse CD11b)进行标记,首先阐明如何通过计算不同浓度抗体标记后的染色指数确定合适抗体浓度区间,进而分析了细胞数量、染色时间及固定步骤等因素对抗体染色指数的影响,以期为今后通过抗体滴定优化血液细胞流式分析的应用提供实验依据。
1 材料与方法
1.1 实验动物
SPF级别的C57BL6小鼠由中国医学科学院&北京协和医学院血液病医院(血液学研究所)实验血液学国家重点实验室动物中心提供。
1.2 主要试剂和仪器
EDTA 购自美国Gibco公司;磷酸盐缓冲液(phosphate buffer saline,PBS)购自索莱宝公司;胎牛血清(fetal bovine serum,FBS)购自以色列Biological Industries公司;ACK红细胞裂解液购自索莱宝公司;抗体FITC Rat Anti-Mouse CD11b (REF:11-0112-82,clone:M1/70,0.5 mg·mL-1)和APC-eFluor780 Rat Anti-Mouse CD11b (REF:47-0112-82,clone:M1/70,0.2 mg·mL-1)购自美国eBioscience公司;死活细胞染料DAPI购自美国Sigma公司。小型低温离心机购自美国Eppendorf公司;血细胞计数板购自美国Drew Scientific公司;流式细胞仪CantoⅡ购自美国Becton Dickinson公司。
1.3 小鼠骨髓单细胞悬液制备
引颈法处死小鼠,75%乙醇溶液浸泡1 min,取小鼠下肢骨,用含2% FBS、2 μmol·L-1EDTA的PBS-EDTA(PBE)冲出小鼠骨髓细胞,100目尼龙膜过滤得到单细胞悬液,1 500 r·min-1、4 ℃离心5 min,弃上清后加入5 mL ACK红细胞裂解液室温裂解8 min,1 500 r·min-1、4 ℃离心5 min,弃上清后加入10 mL PBS洗涤1次,1 500 r·min-1、4 ℃离心5 min,弃上清后加入5 mL含2% FBS的PBE重悬细胞并计算用于抗体滴定的细胞数。
1.4 测定抗体最佳染色浓度
首先将小鼠骨髓细胞按照1×106cells·管-1加入13个1.5 mL EP管中,1 500 r·min-1、4 ℃离心5 min,用含2%FBS的PBS调整终体积至42 μL·管-1,放置冰上。依次向其中12管细胞悬液中加入用含2% FBS的PBE倍比稀释的FITC Rat Anti-Mouse CD11b抗体稀释液8 μL至终体积为50 μL,使抗体终浓度依次为20.000、10.000、5.000、2.500、1.250、0.625、0.313、0.156、0.078、0.039、0.019、0.009 μg·mL-1。另取一管细胞悬液加入8 μL含2% FBS的PBE作为阴性对照。随后,将细胞悬液涡旋混匀,4 ℃避光孵育30 min,每管加入1 mL含2% FBS的PBE,1 500 r·min-1、4 ℃离心5 min,弃上清,再向每管加入300 μL含2% FBS的PBE重悬细胞,并转移到流式管中,上机前按1∶1 000的比例加入1 mg·mL-1DAPI,用流式细胞仪检测细胞平均荧光强度。根据以下公式确定每管的染色指数:SI=[MFI(阳性)-MFI(阴性)]/2RSD(阴性)[5-6]。
同时,还选取了针对同一抗原表位但是为串联荧光染料标记的抗体APC-eFluor780 Rat Anti-Mouse CD11b,按上述方法进行了同样的滴度测定,12个浓度梯度管依次为8.000、4.000、2.000、1.000、0.500、0.250、0.125、0.063、0.031、0.016、0.008、0.004 μg·mL-1。
1.5 测定其他因素变化对抗体染色的影响
确定了抗体的最佳染色浓度后,测定细胞数量、染色时间和固定步骤等实验条件对染色效果的影响。非串联荧光染料稳定性好、染色效果佳,是实验中最常用到的荧光染料。但是随着抗体颜色数量的增加,实验中也经常用到串联荧光染料,串联荧光染料是通过共价键方式将2种染料串联,其中一种染料的发射光谱与另外一种染料的激发光谱部分重叠。在处理样本过程中,串联荧光染料容易降解,重新分解为原来的2种染料,因此在探究细胞数量、染色时间和固定步骤对染色效果的影响时,对非串联与串联荧光染料标记2种抗体的染色结果均进行了分析。
1.5.1 测定血液细胞数量对抗体染色的影响
将细胞悬液用倍比稀释的方法加入7个1.5 mL EP管中,使每管细胞数目依次为1.000×107、5.000×106、2.500×106、1.250×106、6.250×105、3.125×105、1.563×105个,体积为40 μL。每管中加入10 μL浓度为6.25 μg·mL-1的FITC Rat Anti-Mouse CD11b抗体稀释液至终体积为50 μL,每管混合物中抗体终浓度分别为1.25 μg·mL-1。将加入抗体的细胞混合物涡旋混匀,4 ℃避光孵育30 min后,每管加入1 mL含2% FBS的PBE,1 500 r·min-1、4 ℃离心5 min,弃上清,每管加入300 μL含2% FBS的PBE重悬细胞,并转移到流式管中,上机前按1∶1 000的比例加入1 mg·mL-1DAPI,用流式细胞仪检测细胞平均荧光强度。APC-eFluor780 Rat Anti-Mouse CD11b抗体的处理流程与上述一致,所用抗体稀释液浓度为2.5 μg·mL-1,每管混合物中抗体终浓度为0.5 μg·mL-1。
1.5.2 测定抗体孵育时间对染色的影响 将细胞按照1×106cells·管-1加入4个1.5 mL EP管中,调整体积为40 μL,放置冰上。每管中加入10 μL 6.25 μg·mL-1的FITC Rat Anti-Mouse CD11b抗体稀释液,使每管中抗体终浓度分别为1.25 μg·mL-1。将细胞涡旋混匀,置于4 ℃,分别避光孵育30、40、50、60 min后,每管加入1 mL含2% FBS的PBE,1 500 r·min-1、4 ℃离心5 min,弃上清,每管加入300 μL含2% FBS的PBE重悬细胞,并转移到流式管中,上机前按1∶1 000的比例加入1 mg·mL-1DAPI,用流式细胞仪检测细胞平均荧光强度。APC-eFluor780 Rat Anti-Mouse CD11b抗体的处理流程与上述一致,所用抗体稀释液浓度为2.5 μg·mL-1,每管混合物中抗体终浓度为0.5 μg·mL-1。
1.5.3 测定固定步骤对抗体染色的影响 将细胞按照1×106cells·管-1加入4个1.5 mL EP管中,体积为40 μL,放置冰上。其中2管加入非串联荧光染料抗体(6.25 μg·mL-1的FITC Rat Anti-Mouse CD11b抗体)稀释液10 μL,至每管混合物中抗体浓度为1.25 μg·mL-1。另外2管加入串联荧光染料抗体(2.5 μg·mL-1的APC-eFluor780 Rat Anti-Mouse CD11b抗体)稀释液10 μL,至每管混合物中抗体浓度为0.5 μg·mL-1。将细胞涡旋混匀,4 ℃避光孵育30 min后,加入1 mL含2% FBS的PBE,1 500 r·min-1、4 ℃离心5 min,弃上清,不同抗体标记管中各取1管加入300 μL含2% FBS的PBE重悬细胞,转移到流式管中,上机前按1∶1 000的比例加入1 mg·mL-1DAPI,用流式细胞仪检测平均荧光强度;不同抗体标记管中的另一管加入300 μL的2%多聚甲醛(paraformaldehyde,PFA)重悬细胞并置于4 ℃固定24 h后流式细胞仪上机分析。
1.6 统计分析
流式数据用FlowjoV10软件分析,利用GraphPad Prism7.0对实验数据进行统计和作图。Pairedt-test用于两组之间比较。实验数据以均值±标准差(Mean±SD)表示,P<0.05被认为有统计学意义。
2 结果与分析
2.1 抗体最佳染色浓度的测定
为了确定抗体浓度对细胞染色效果的影响,在细胞数量(1×106cells·管-1)、染色时间(30 min)固定的情况下,对不同抗体染色浓度的标记效果进行了分析。如图1A、C所示,FITC Rat Anti-Mouse CD11b抗体在染色浓度低于0.156 μg·mL-1时,阴性群与阳性群分离效果不佳,染色指数较低;抗体染色浓度在0.156~2.500 μg·mL-1时,染色指数较高;抗体染色浓度继续增大时,染色指数反而下降,当抗体浓度达到抗体说明书推荐的5.000 μg·mL-1时,染色指数比0.156 μg·mL-1时还要低。如图1B、D所示,APC-eFluor780 Rat Anti-Mouse CD11b抗体在浓度低于0.250 μg·mL-1时,阴性群与阳性群分离效果不佳,染色指数较低;抗体浓度在0.250~1.000 μg·mL-1时,染色指数较高;抗体浓度继续增大,染色指数反而下降。当抗体浓度增加到说明书推荐的1.250 μg·mL-1时,染色效果不如浓度为0.250~1.000 μg·mL-1时。可见,在进行抗体染色时,无论是非串联荧光染料抗体还是串联荧光染料抗体,都有一个抗体染色浓度的最佳区间,使用说明书推荐的抗体浓度可能达不到最佳的实验效果还造成一定程度的浪费。
A-B:固定细胞数与染色时间,不同浓度的FITC Rat Anti-Mouse CD11b与APC-eFluor780 Rat Anti-Mouse抗体标记小鼠骨髓细胞后的细胞阴性群与阳性群分离结果;C-D:根据A、B中的平均荧光强度计算的染色指数。图1 抗体浓度对抗体染色指数的影响Fig.1 Effect of antibody concentration on staining index
2.2 细胞数量对抗体染色效果的影响
为了确定被染色细胞数量对流式抗体染色的影响,固定抗体浓度(FITC标记的 Rat Anti-Mouse CD11b抗体为1.25 μg·mL-1, APC-eFluor780 标记的Rat Anti-Mouse CD11b抗体为0.5 μg·mL-1)和染色时间(30 min),对含有不同数量细胞悬液的标记效果进行了分析。如图2A、B所示,对于FITC Rat Anti-Mouse CD11b抗体,在细胞数量为1.56×105~5.00×106cells·管-1这样一个较宽泛的范围内,阳性群和阴性群的分离效果区别不大,染色指数相近,其中,细胞数量在1.25×106cells·管-1时细胞群分离效果最佳,染色指数最高;但当细胞数量过高,达到1.00×107cells·管-1时,染色指数明显下降。如图2C、D所示,对于APC-eFluor780 Rat Anti-Mouse CD11b抗体,在细胞数量为1.56×105cells·管-1染色指数最高,染色效果最佳;当细胞数量增加至3.12×105cells·管-1时,染色指数由24.7降为23.4;继续增加细胞数量至6.25×105cells·管-1时,染色指数迅速下降至13.6,随着细胞数量继续增多,染色指数呈逐渐下降趋势。
可见即使是针对同一抗原表位的不同抗体,进行样品标记的合适的细胞数量范围也不尽一致。如本实验中,非串联荧光染料标记的抗体在一定范围内细胞数量的改变不会对染色效果有明显的影响,而串联荧光染料标记的抗体则对细胞数增加更为敏感。总之,无论是何种抗体,如果进行较多数量的细胞染色(如进行细胞分选),有必要对合适的抗体浓度重新进行滴定,以免影响染色效果。

A、C:固定抗体浓度与染色时间,分析细胞数量对非串联荧光染料与串联荧光染料染色时阴性群与阳性群分离结果的影响; B、D:根据A、C中的平均荧光强度计算的染色指数结果。图2 细胞数量对抗体染色指数的影响Fig.2 Effect of cell quantity on antibody staining index
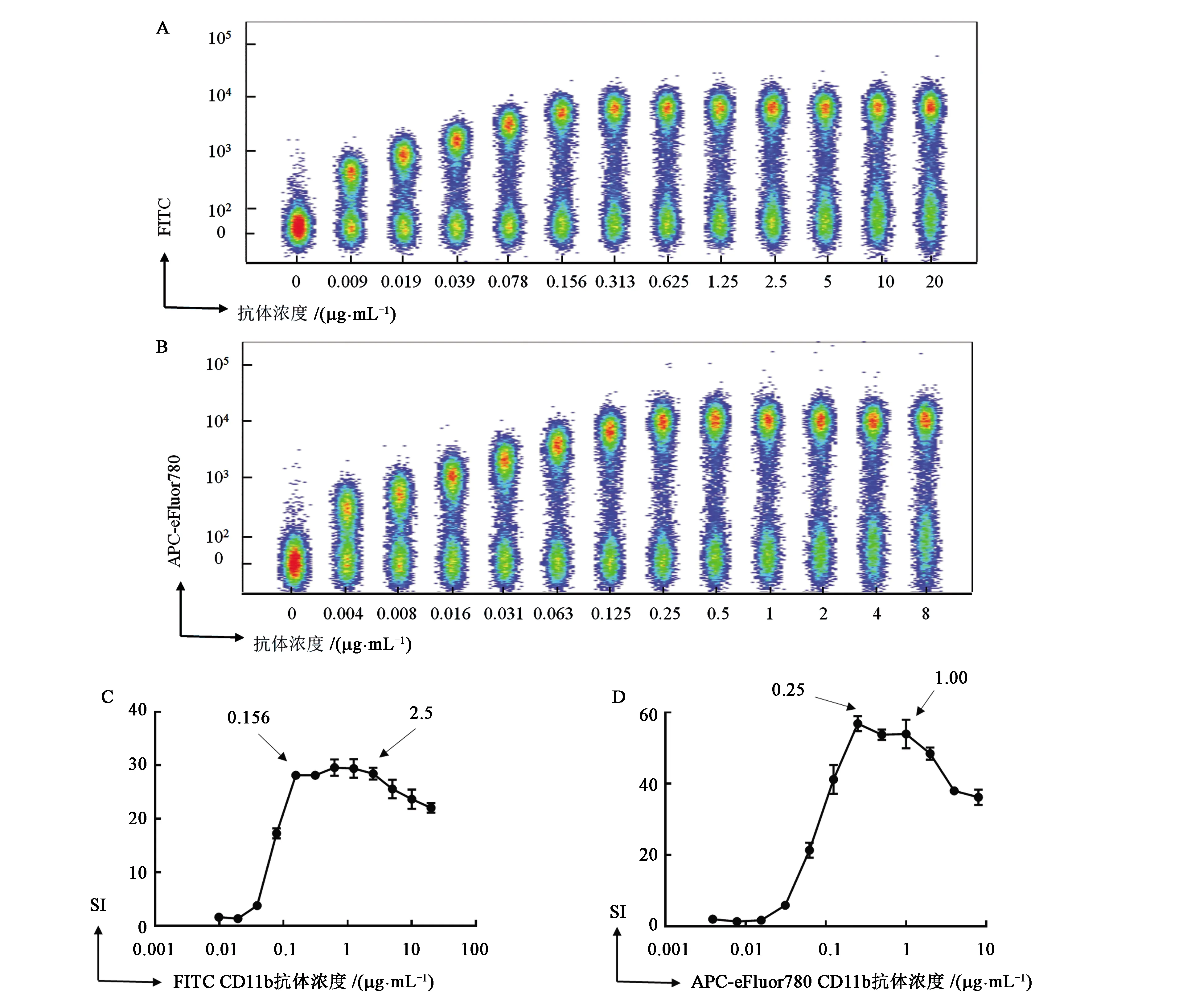
2.3 染色时间对抗体染色效果的影响
一般进行流式抗体染色会选择30 min的染色时间,但为了获得最佳的抗体染色效果,探究了延长染色时间是否会提高阳性群和阴性群的分离效果。在固定细胞数量(1×106cells·管-1)和抗体浓度(FITC Rat Anti-Mouse CD11b抗体为1.25 μg·mL-1, APC-eFluor780 Rat Anti-Mouse CD11b抗体为0.5 μg·mL-1)的情况下,分别测定了30、40、50、60 min孵育时间条件下的染色指数,观察延长抗体染色时间对染色效果的影响。如图3A、B所示,对于FITC Rat Anti-Mouse CD11b抗体,染色时间由30 min延长至40 min时,染色指数从24.10降低到23.03;继续增加染色时间至50 min时,染色指数降为21.16;增加染色时间至60 min时染色指数下降为21.08。如图3C、D所示,对于APC-eFluor780 Rat Anti-Mouse CD11b抗体,染色时间由30 min延长至40 min时,染色指数从8.8升高为16.1;继续延长染色时间至40、50 min时,染色指数升高为16.6、21.0。
A、C:固定抗体浓度与细胞数量,分析染色时间对非串联荧光染料与串联荧光染料染色时阴性群与阳性群分离结果的影响; B、D:根据A、C中的平均荧光强度计算的染色指数结果。图3 染色时间对抗体染色指数的影响Fig.3 Effects of staining time on antibody staining index
可见,对于非串联荧光染料标记的抗体,随着染色时间的增加,不会提高染色效果,反而会因为阴性群的非特异性染色增加使染色指数轻度降低;而对于串联荧光染料标记的抗体,随着染色时间的延长,阴性群与阳性群的分离效果越来越佳,染色指数不断升高。结合前述细胞数量对染色指数的结果综合分析,即使在细胞数相对较多的情况下,某些抗体,如本实验中用到的APC-eFlour780 Rat Anti-Mouse CD11b抗体,也可以通过延长染色时间提高分离效果。
2.4 固定对染色效果的影响
虽然染色后的新鲜标本立即进行流式细胞分析最为理想,但是有时受实验安排及仪器所限,需要对样本进行PFA固定后次日再进行分析。为了研究PFA固定步骤对细胞染色效果的影响,在细胞数量(1×106cells·管-1)、抗体浓度(1.25 μg·mL-1)和染色时间(30 min)不变的情况下,比较了FITC Rat Anti-Mouse CD11b和APC-eFluor780 Rat Anti-Mouse CD11b抗体在PFA固定前后染色指数的变化。如图4所示,FITC Rat Anti-Mouse CD11b抗体染色经2% PFA固定24 h后,染色指数从25.34降为9.91,可见固定前后的染色效果显著下降(P<0.01)。APC-eFluor780 Rat Anti-Mouse CD11b抗体染色经2% PFA固定24 h后,染色指数从38.81降为24.86,固定步骤使染色效果显著下降(P<0.05)。可见,PFA溶液固定会使非串联荧光染料与串联荧光染料抗体染色效果均显著下降。
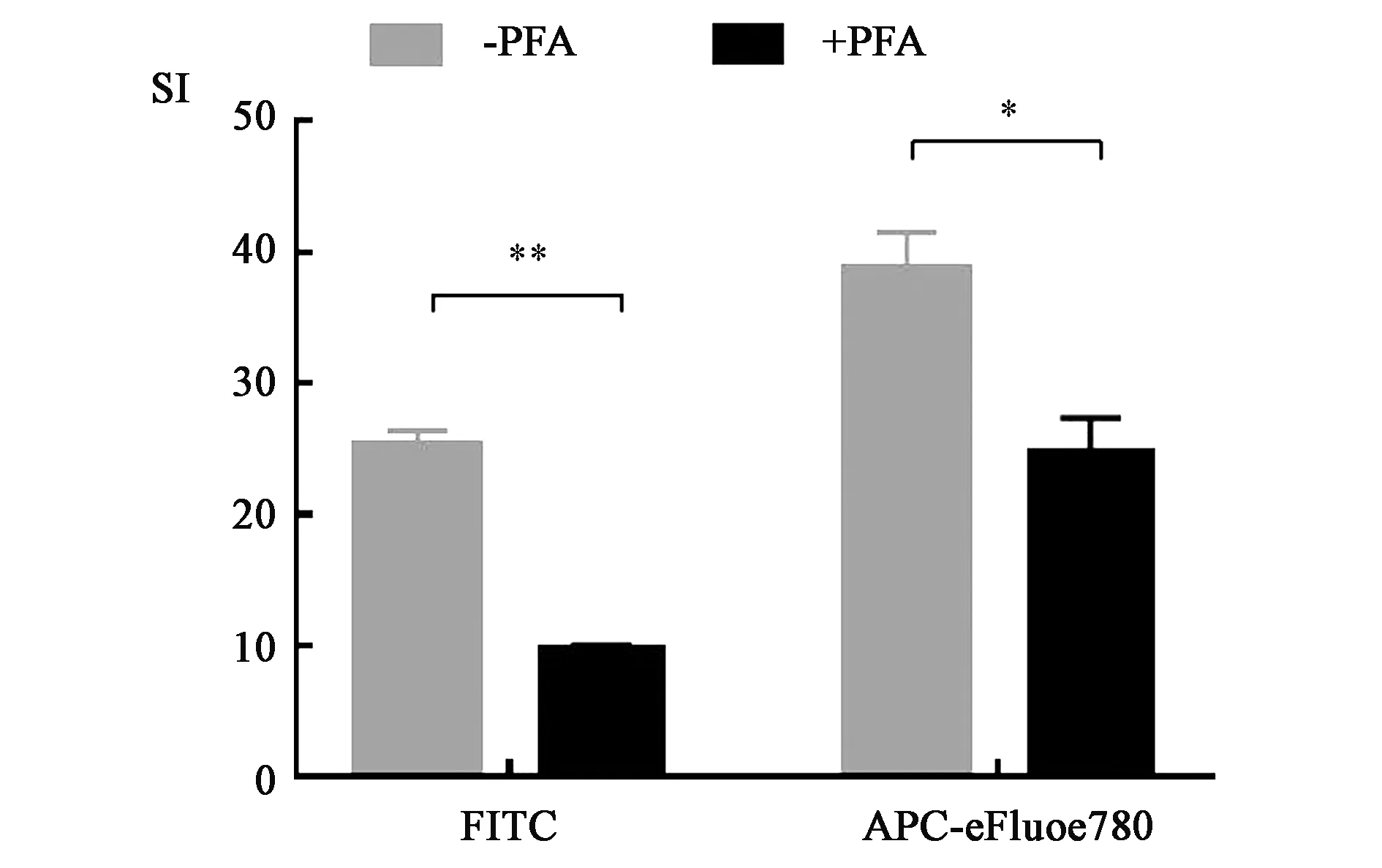
注:*与**分别表示PFA固定前后的染色指数间的差异在P<0.05与P<0.01水平上具有统计学意义。图4 PFA固定对抗体染色指数的影响Fig.4 Effect of fixation with PFA on staining index
3 讨论
随着流式细胞技术的不断提高,尤其是多参数流式技术的日益纯熟[7-8],流式细胞术应用范围越来越广泛,使用几种独特的抗原组合标记即可将细胞划分到特定的细胞群体和分化阶段[9-11],应用流式细胞术进行免疫表型分析已成为多种血液恶性肿瘤诊断和分类的重要工具[12-15]。流式细胞分析中的一个关键问题是能否可靠地区分抗原阳性细胞和抗原阴性细胞,并准确测量抗原阳性细胞的数量[16-17]。
上机分析之前的样本处理,尤其是对细胞进行荧光抗体染色,是实验成功的重要一步,抗原阴性细胞和其他颗粒(如碎片)的背景荧光会影响流式细胞术对抗原阳性细胞的精确测量。抗体的非特异性结合是引起背景荧光的主要原因之一,其主要通过选择特异性抗体并优化抗体浓度和数量来消除[18-19]。购买的商品化抗体都会给出一个推荐的抗体使用浓度,这个浓度一般可以保证阳性细胞群充分染色。但由于不同实验所应用的细胞和实验条件不同,完全按照说明书推荐浓度使用往往会过量,导致阴性细胞群的非特异染色增强,且造成一定程度的抗体浪费,尤其在多参数流式细胞术中抗体量是影响实验成本的重要因素[20]。而抗体滴定可以对所用流式抗体找到最佳的抗体用量和染色条件。
本研究以常见的小鼠髓系细胞表面分子CD11b为例,阐明了如何通过抗体滴定的方法确认一定实验条件下抗体的最佳使用浓度范围。结果显示,抗体浓度过高会导致背景非特异性结合增加,从而降低荧光测量的灵敏度;抗体浓度过低会导致阳性信号降低,从而降低荧光测量的灵敏度。无论是FITC标记还是APC-eFluor780标记的抗体,其最佳染色浓度区间均低于推荐用量,如本实验中用到的FITC标记的大鼠抗小鼠CD11b推荐抗体浓度是5 μg·mL-1,滴定结果显示抗体浓度在0.156 μg·mL-1时即可达到较高的染色指数,抗体浓度高于1.25 μg·mL-1时染色指数反而开始下降。
此外,针对细胞数量、染色时间和固定步骤对染色效果的影响,本研究在选取固定的抗体浓度和其他变量时,改变其中1个变量来考察单因素对染色效果的影响。FITC Rat Anti-Mouse CD11b抗体浓度选择为1.25 μg·mL-1,因为抗体浓度滴定结果显示此抗体在此浓度下染色指数最高;APC-eFluor780 Rat Anti-Mouse抗体浓度选择为0.5 μg·mL-1,因为此抗体在浓度为0.25 μg·mL-1时即达到最高染色指数,但是考虑到低于此抗体浓度时,染色指数骤然下降,选取了高于此浓度的0.5 μg·mL-1作为后续研究的固定浓度。
本研究阐明了FITC Rat Anti-Mouse CD11b抗体染色时细胞数量在1.56×105~5.00×106cells·管-1这样一个比较宽泛的范围内(但注意细胞悬液体积要固定,因为这决定了抗体浓度),使用同一抗体浓度都可以达到抗原阳性细胞和阴性细胞较好的分离效果。而针对同一抗原表位的APC-eFluor780 Rat Anti-Mouse CD11b抗体在细胞数量最低的1.56×105cells·管-1时,染色效果最佳,增加细胞数量时染色指数呈不断下降趋势,提示了使用此抗体时应注意控制细胞数量。
染色时间及染色后是否固定对结果也有一定影响。染色时间延长是否会提高染色效果取决于染料的不同,对于非串联荧光染料标记的抗体,随着染色时间的增加,染色指数轻度降低;而对于串联荧光染料标记的抗体,随着染色时间的延长,染色指数不断升高。PFA固定会导致阳性信号减弱同时使非特异性结合增强,最终导致2种染料标记的抗体对应的染色指数均显著降低。因此,在具体实验中根据自己的需求确定最佳抗体染色条件至关重要。
在抗体滴定时,需要和实验中保持一致的染色条件,如样本类型、细胞数量、染色时间和温度以及同批号的染色试剂,多抗体染色时需要将每个抗体单独滴定,确定其最适浓度,然后用完整的抗体染色种类测试样本是否需要对某个抗体浓度做调整[21-23]。活细胞与固定细胞不同,针对同一蛋白在细胞表面染色与在细胞内染色不同,因此根据自己的实验需求,选择合适的抗体并对抗体预先进行滴定,将对流式分析的优化有重要意义。

