辣椒根际促生菌的分离筛选及抗病促生特性研究
杨茉 高婷 李滟璟 魏崇瑶 高淼 马莲菊
(1. 沈阳师范大学生命科学学院,沈阳 110034;2. 中国农业科学院农业资源与农业区划研究所 农业农村部农业微生物资源收集与保藏重点实验室,北京 100081)
辣椒(Capsicum annuumL.)为一年生或有限多年生草本植物,属于茄科辣椒属,富含维生素及氨基酸等营养物质,具有解热、镇痛、增加食欲、帮助消化、降脂减肥、预防肿瘤等功效。随着辣椒种植面积的不断扩大,连作现象十分普遍,长期连作使土壤从“细菌型”的高肥土壤转化成性质不良的“真菌型”土壤,土传病原菌日渐积累[1-2],导致辣椒病害加剧,严重影响辣椒产量,造成20%-50%,甚至高达70%的减产,已严重影响和制约辣椒产业发展[3]。目前辣椒病害的防治方法主要是使用化学药剂,长期使用化学试剂不但造成环境污染,而且威胁人畜健康[4]。研究表明生物防治具有绿色、安全、高效等特点,是最为理想的防治方法之一[5]。
植物根际促生菌(Plant growth promoting rhizobacteria,PGPR)是一类生活在植物根际,能够促进植物生长、防治病害、增加作物产量的微生物统称[6]。PGPR 数量巨大,种类繁多,不仅对植物有显著的促生长作用,对抑制土传病害发生、增强植物抗逆境胁迫能力、改善和维护土壤生态质量具有重要作用[7-9]。PGPR 定殖到植物根际或进入植物体内后,可通过产抗生素、产水解酶、释放挥发性抑菌气体、诱导系统性抗性(ISR)、分泌铁载体、分泌植物激素、固氮等机理,有效抑制病原菌生长,克服土传病害及达到促生增产的功效[7,10]。刘泽平等[11]从水稻根际土壤分离得到6 株PGPR 菌株,研究发现6 株菌株均能产生生长素,其中LZP03、LZP05 和LZP06 具有较强促生能力。容良燕等[12]将PGPR 菌株制成复合接种剂施于玉米田间,玉米株高、穗长、穗粗、单位面积穗数、穗粒数和经济产量均有提高,并能代替20%-30%化肥。蒋永梅[13]从辣椒等4 种植物根际分离筛选了56 株PGPR 菌株,其中辣椒根际分离筛选出6 株固氮菌和9 株溶磷菌。吕雅悠等[14]用PGPR 菌株A21-4 灌根处理辣椒,发现实验组辣椒植株成株期茎粗、根系活力和叶绿素含量显著提高,辣椒果实的蛋白质、维生素C 和硝态氮的含量也均有提高,且辣椒根系土壤的速效氮、磷、钾含量等显著提高。张杨等[15]利用具有产IAA 和ACC 脱氨酶能力的辣椒PGPR 菌株研制成生物育苗基质,研究发现添加菌株的生物基质对辣椒苗有提高根系定殖和促幼苗生长的能力,且对移苗后的生长仍具有显著的促进作用并能有效在根系定殖。
本研究从江苏省徐州市丰县辣椒根际土壤中分离根际促生菌,研究其固氮、解磷、促生和抗病能力,旨在筛选高效优质的多功能根际促生菌,为辣椒根际促生菌作为生物肥料和生物农药的开发应用奠定基础。
1 材料与方法
1.1 材料
1.1.1 土壤样品及病原菌来源 供试土样:2018 年8 月采自江苏省徐州市丰县。将采集样品分别装入无菌纸袋中,带回实验室进行菌株分离。
供试病原菌:立枯丝核菌Rhizoctonia solani、辣椒疫霉菌Phytophthora capsici Leonian、辣椒炭疽菌Colletotrichum capsici bulterg和辣椒镰孢菌Fusarium oxysporum由中国农业微生物菌种保藏中心提供。
1.1.2 主要培养基 牛肉膏蛋白胨培养基:牛肉膏3 g,蛋白胨10 g,NaCl 5 g,琼脂18 g,蒸馏水定容至1 L;马铃薯葡萄糖琼脂培养基:马铃薯200 g,葡萄糖20 g,琼脂18 g,蒸馏水定容至1 L;Ashby培 养 基:KH2PO40.2 g,MgSO40.2 g,NaCl 0.2 g,CaCO45 g,甘露醇10 g,CaSO40.1 g,琼脂15 g,蒸馏水定容至1 L,pH 7.0;PKO 无机磷培养基:葡萄糖10 g,(NH4)2SO40.5 g,NaCl 0.2 g,KCl 0.2 g,FeSO4·7H2O 0.003 g,MnSO40.03 g,MgSO4·7H2O 0.03 g,酵母膏0.5 g,Ca3(PO4)25 g,琼脂20 g,蒸馏水定容至1 L,pH 6.8-7.0;孟金娜有机磷培养基:葡萄糖10 g,(NH4)2SO40.5 g,NaCl 0.3 g,KCl 0.3 g,FeSO4·7H2O 0.03 g,MnSO4·4H2O 0.03 g,蛋 黄 卵磷脂0.2 g,CaCO35 g,酵母膏0.4 g,琼脂20 g,蒸馏水定容至1 L,pH 7.0;Salkowski 比色液:FeCl34.5 g,溶于10.8 mol/L 浓H2SO4硫酸中,冷却后定容至1 L。
1.2 方法
1.2.1 PGPR 菌株的分离纯化 供试土样于2018 年8 月采自江苏省徐州市丰县生长的健康辣椒植株根际,将样品装入无菌纸袋中,带回实验室,4℃保存。取辣椒根际土10 g,放入带有玻璃珠的90 mL 生理盐水中,180 r/min 震荡30 min,梯度稀释后涂布于牛肉膏平板和Ashby 平板上,置于28℃恒温培养箱培养,挑取形态不同菌落进一步纯化,纯化后转接至斜面,4℃保存备用。
1.2.2 PGPR 菌株的鉴定
1.2.2.1 形态学鉴定 将菌株接种于牛肉膏蛋白胨培养基,30℃培养,观察记录各细菌菌落形状、大小、颜色等特征,结合《伯杰细菌鉴定手册》(第八版)进行形态学鉴定。
1.2.2.2 分子生物学鉴定 采用菌落PCR 方法扩增16S rDNA。引物采用16S rDNA 的通用引物,由上海生工合成,27f:5′-AGAGTTTGATCCTGGCTCAG-3′,1492r:5′-TACGGTTACCTTGTTACGACTT-3′, 采 用50 μL PCR 反应体系进行PCR 扩增。扩增产物测序由生物工程(上海)股份有限公司完成,通过NCBI数据库在线比对测序结果,构建系统发育树。
1.2.3 菌株特性测定
1.2.3.1 解磷特性测定 采用透明圈法,将纯化的菌株分别点接至PKO 无机磷培养基和孟金娜有机磷平板,每组3 次重复,28℃培养14 d,测量解磷透明圈的直径与菌落直径,计算透明圈直径与菌落直径比值D/d 和E/e。
1.2.3.2 分泌IAA 能力 测定将菌株接种于含L-色氨酸(100 mg/L)的液体培养基中,28℃、180 r/min避光震荡培养24 h,测定OD600值,计算菌体生长量。将菌悬液以10 000 r/min 离心10 min 后,取上清液加入等体积Salkowski 比色液,避光静置30 min,测定其OD530值。计算菌浓度OD600值=1 时,单位体积发酵液中IAA 含量。
分别测定各浓度3-吲哚乙酸标准液OD530值,绘制IAA 标准曲线,并在标准曲线上查出各菌株分泌IAA 浓度。
1.2.3.3 抗病能力测定 采用对峙培养法,将病原菌菌饼(直径5 mm)接种于PDA 平板,将待测细菌点接至距病原菌3.5 cm 处,以不接种细菌的平板为对照,每个处理重复3次。平板置于30℃下培养5-7 d,待对照组菌落长满全皿时,测量每个细菌的抑菌圈半径,计算其抑菌率。
抑菌率=(对照组病原菌菌落半径-处理组病原菌菌落半径)/对照组病原菌菌落半径×100%
2 结果
2.1 PGPR菌株的分离筛选
从辣椒根际土中共分离到58 株细菌,经进一步筛选,最终得到13 株具有固氮功能的根际促生菌,其菌株编号分别为T22、N1、N3、N7、N8、N9、N12、N16、N26、N29、N30、N31、N32。
2.2 PGPR菌株的鉴定
经16S rDNA 序 列BLAST 比 对,13 株 细 菌 中T22(MN555349)、N3(MN555366)、N7(MN555367)、N8(MN555368)、N9(MN555369)、N12(MN555375)和N32(MN555373)属于Bacillus,N29(MN559430)属 于Pseudomonas,N1(MN555365) 属 于Lelliottia,N16(MN555377) 属 于Siccibacter,N26(MN555435)属于Achromobacter,N30(MN555371)属 于Microbacterium,N31(MN555372) 属 于Paenibacillus。用MEGA7.0 构建菌株的系统进化树见图1。
2.3 辣椒PGPR菌株解磷能力
2.3.1 解有机磷能力 在13 株辣椒PGPR 菌中,有7 株菌具有解有机磷能力,可以在孟金娜有机磷平板上形成透明圈,其中N1、N16 和N30 解有机磷能力显著高于其他菌株,能力最强的菌株为N16,D/d值为1.72±0.30(表1)。
2.3.2 解无机磷能力 在13 株辣椒PGPR 菌中,有5 株菌可解无机磷,可以在PKO 无机磷平板上形成透明圈,其中N3 菌株的解无机磷能力最强,E/e 值为1.47(表1)。
2.3.3 分泌IAA 能力 在13 株PGPR 菌株中,菌株 N1、N16 和N32 具有产生 IAA 能力,其中N1 菌株产 IAA 能力显著高于其他菌株,达到18.49 μg/mL (表2)。
2.3.4 抗病能力 在13 株PGPR 菌株中,具有对辣椒病原菌拮抗能力的菌株5 株,分别为T22、N1、N7、N12 和N16。菌株T22 和N12 对被测4 种辣椒病原菌均有拮抗效果,而菌株N1、N7 和N16 只对其中的两种病原菌具有拮抗效果。菌株T22 对立枯丝核菌和辣椒疫霉菌的抑菌率均可达到50%以上;菌株N7 和N16 对立枯丝核菌的拮抗能力较好,抑菌率分别达到74.98±3.10%和75.87±2.69%;菌株N12 对立枯丝核菌、辣椒疫霉菌和辣椒镰孢菌3 种病原菌的拮抗能力均较强,抑菌率可达到55%以上(表3)。

图1 基于16S rDNA 序列构建的13 株辣椒PGPR 菌株的系统进化树
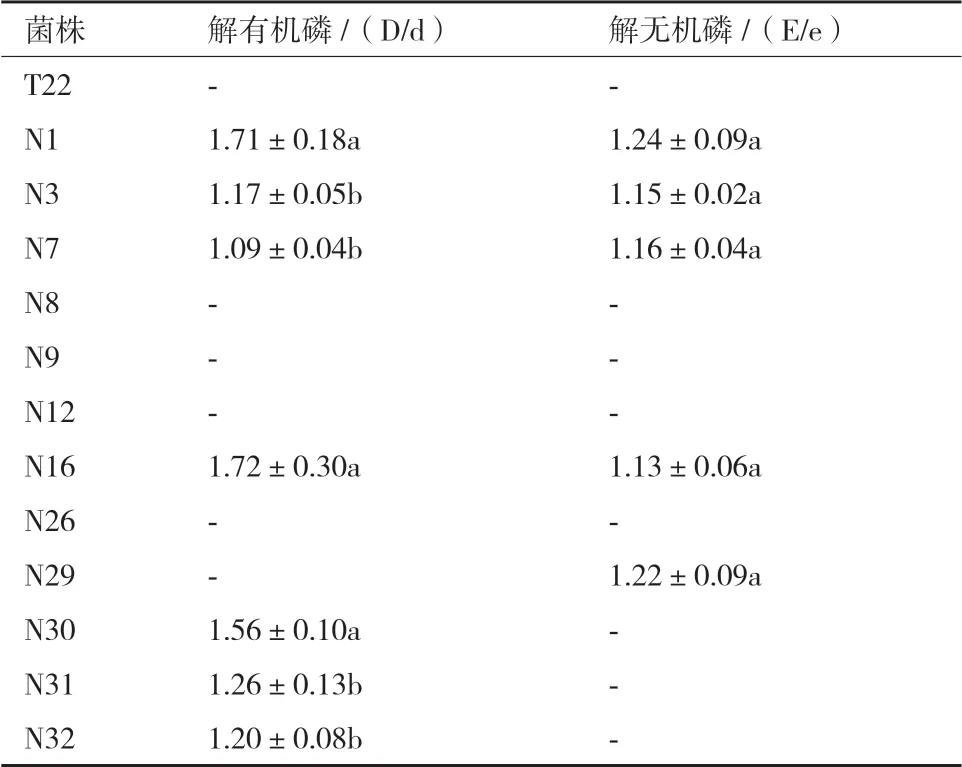
表1 13 株PGPR 菌的解磷结果

表2 13 株PGPR 菌分泌IAA 测定结果
3 讨论
以往人们为追求辣椒增产而过分依赖化肥和农药,对环境和土壤造成较多负面影响,现在已经意识到生态环境与农业可持续发展的重要性,开始寻找化肥和农药的替代品。研究表明PGPR 菌株具有固氮、溶磷、产生嗜铁素和分泌植物激素等能力,对植物生长具有促进作用[16]。徐姗姗[17]将PGPR 菌液接种于烟草幼苗中,对烟草幼苗有显著的促生效果,也有学者将PGPR 菌株制成菌肥作用于非宿主植物猫尾草和小黑麦上,猫尾草茎粗增加33.74%,小黑麦根平均直径和体积分别增加22.5%和152%,有明显的促生效果[18]。张英等[19]筛选优良牧草PGPR 菌株,获得固氮菌71 株、溶解无机磷菌株73 株和溶解有机磷菌株78 株。本研究筛选仅得到13 株PGPR 菌株,13 株均具有固氮能力,7 株可解有机磷,5 株可解无机磷,分析原因可能是由于植物本身特性、不同地理气候、土壤理化性质等因素对根际微生物的数量产生的影响不同造成的[20-21]。徐伟慧等[22]在研究西瓜PGPR 菌株分泌激素能力和菌株间拮抗作用中发现,12 株PGPR均能分泌IAA,制成复合菌剂接种于西瓜幼苗,发现复合菌剂R2 对西瓜幼苗根长、根表面积、根体积、根尖数和根部干重分别提高191.8%、302.4%、160.0%、206.5%和139.6%,具有明显的促生效应。本研究筛选到的PGPR 菌株N1、N3 和N16 可分泌IAA,其中N1 分泌IAA 可达到18.49 μg/mL,说明这3 株PGPR 菌株对植物生长有潜在的促生能力。
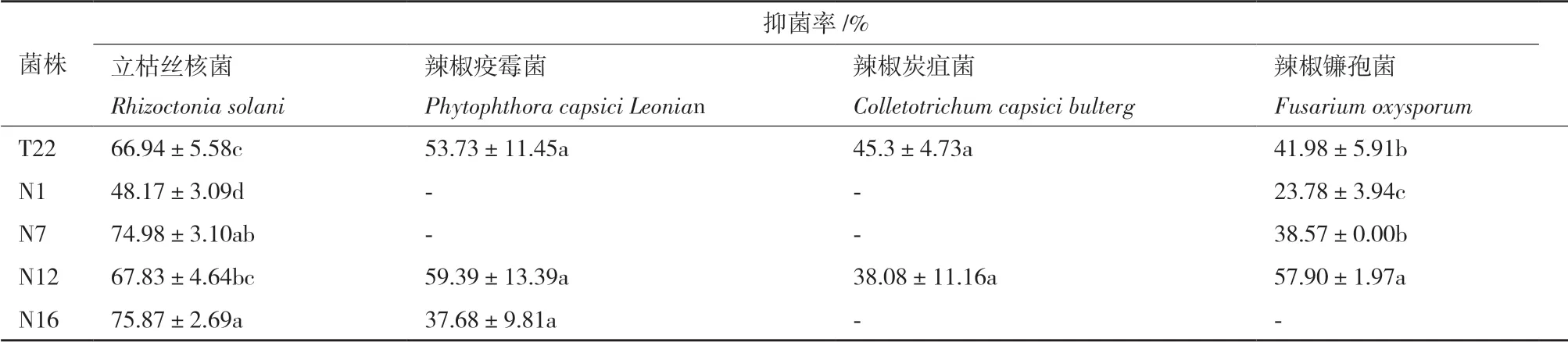
表3 5 株辣椒PGPR 菌对辣椒病原菌的拮抗效果
研究发现在农业生产中使用PGPR 菌株不仅能有效提高植物产量,PGPR 菌株对植物病害还有较好的生防功能。李海云等[23]筛选获得的57 株PGPR 菌株中有固氮菌24 株,溶磷菌33 株,其中NCRP2 菌株对小麦长蠕孢病菌Helminthosporium triticivulgaris、番茄早疫病菌Alternaria solani、黄瓜枯萎病菌F. oxysporum、马铃薯立枯丝核病菌R. solani、油菜菌核病菌Sclerotinias clerotiorum和玉米小斑病菌Bipolaria maydis均有抑制作用。Gowtham等[24]在温室实验中用PGPR 菌株对辣椒种子进行预处理并接种病原菌C. truncatum,发现实验组抗病效果显著,其中B. amyloliquefaciens抗病率最高达到71%,且与对照组相比,PGPR 菌株处理过的辣椒种子的发芽率、幼苗活力、株高、鲜重、干重和叶片数均有不同程度的提高。本研究13 株PGPR菌 种 中T22、N3、N7、N8、N9、N12 和N32 都 属于Bacillus,且T22、N7 和N12 都对病原菌有较强的拮抗能力,T22 和N12 对本实验中的4 种病原菌均有拮抗功能,N7 对R. solani的拮抗率高达74.98±3.10%。PGPR 菌株绿脓假单胞菌SLC-2 和枯草芽孢杆菌YJ20 能有效拮抗9 种病原真菌,抑制病原真菌菌丝和孢子的正常生长;两菌株处理感染尖孢镰刀菌的紫花苜蓿后,可以显著提高紫花苜蓿木质素、抗氧化酶活性(SOD、CAT、POD、PAL、LOX)以及病程相关蛋白含量(几丁质酶、β-1,3 葡聚糖酶),提高紫花苜蓿抗病能力[25]。本研究中,菌 株T22、N1、N7、N12 和N16 能 有 效 拮 抗4 种辣椒病原真菌,抑制病原菌正常生长,表示这5 株PGPR 菌株对植物生长有潜在的抗病能力。
研究表明当PGPR 菌株实际应用于作物时,其性能将会受到土壤、植物、气候、温度、土壤微生物等诸多因素影响,因此本研究中所得PGPR 菌株还需要盆栽实验以进行进一步探究。
4 结论
本试验从江苏省徐州市丰县辣椒根际土壤中分离筛选出13 株PGPR 菌,通过形态学特征及16S rDNA 序列比对鉴定分别属于Bacillus、Pseudomonas、Lelliottia、Siccibacter、Achromobacter、Microbacterium和Paenibacillus;13 株PGPR 菌株均有固氮功能,其中7 株可解有机磷,5 株可解无机磷,3 株具有分泌IAA 能力,5 株具有抗病能力。

