葫芦素E通过抑制MAPKs/NF-κB通路减轻哮喘小鼠气道炎症*
姜京植, 徐 畅, 王重阳, 李良昌, 李 莉, 李俊峰, 延光海
(延边大学医学院解剖学教研室,吉林省过敏性疾病重点实验室,吉林延吉133002)
哮喘是呼吸系统一种常见的疾病,是世界医学界公认为的4大顽症之一,其主要特征是嗜酸性粒细胞浸润、气道炎症、黏液生成增加和气道高反应性[1]。哮喘与相关1型辅助性T细胞(Th1)/Th2丰度失衡有着密切的关系[2]。哮喘上调Th2细胞产生的白细胞介素(interlukin,IL)-4、IL-5和 IL-13[3]。Th1细胞因子,包括干扰素γ(interferon-γ,IFN-γ)和IL-12参与调节细胞免疫应答。这些细胞因子通过对抗Th2介导的免疫反应来减少IgE合成,从而抑制哮喘的发展[4]。当Th1/Th2丰度动态平衡被破坏时,疾病就会发生。研究显示,丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)和核因子 κB(nuclear factor-κB,NF-κB)信号通路的激活在哮喘发病过程中发挥作用[5]。因此,MAPKs和NF-κB信号通路可作为哮喘重要的治疗分子靶点。可以通过抑制MAPKs和NF-κB信号通路的方法来治疗哮喘。
葫芦素E(cucurbitin E,CuE)是从葫芦中分离得到的一种中药化学成分。近年来有研究表明,葫芦素E具有抗炎、抗肿瘤和抗氧化等多种药理作用[6]。这些发现促使我们推测,葫芦素E可能是一种很好的预防和治疗过敏性哮喘的候选药物。为了解决这一问题,我们研究葫芦素E对哮喘小鼠气道炎症反应的作用及机制。
材料和方法
1 材料
1.1 动物及分组 清洁级BALB/c小鼠(7周龄)40只,雌性,购于延吉市健康科学中心,饲养于延边大学实验动物中心清洁级动物房。动物随机分为正常对照(control)组、模型(model)组、葫芦素E低剂量(low-dose CuE)组、葫芦素E高剂量(high-dose CuE)组和地塞米松(dexamethasone,Dexa)组,每组8只。实验前,小鼠在标准实验室条件下用水和标准食品饲养1周。所有动物实验均按照延边大学医学院动物保护与利用机构委员会(延吉市)批准的指导方针进行。
1.2 药品试剂与仪器 葫芦素E购于Sigma;卵清蛋白(ovalbumin,OVA)购于Sigma;氢氧化铝购于Pierce;抗磷酸化c-Jun氨基末端激酶(phosphorylated c-Jun N-terminal kinase,p-JNK)抗体(sc135642)、抗磷酸化细胞外信号调节激酶1/2(phosphorylated extracellular signal-regulated kinase 1/2,p-ERK1/2)抗体(sc7976)、抗磷酸化 p38 MAPK(phosphorylated p38 MAPK,p-p38 MAPK)抗体(sc101759)、抗p65抗体(ab16502)、抗磷酸化p65(phosphorylated p65,pp65)抗体(ab53489)和 β-actin抗体(ab8226)购于Santa Cruz及Abcam;IL-4、IL-5、IL-13及IFN-γ酶联免疫检测试剂盒购于上海帝肯公司;BCA蛋白试剂盒购于Rainbio。超声波雾化器为OMRON产品;化学发光成像系统为Bio-Rad产品。
2 方法
2.1 模型制备 模型组、葫芦素E低剂量组、葫芦素E高剂量组和地塞米松组小鼠第1、7和14天腹腔注射致敏液200μL(致敏液的组成为10μg卵清蛋白,1 mg氢氧化铝佐剂和生理盐水)。对照组用等量生理盐水代替。从第21~23天,致敏小鼠暴露于1%OVA的气溶胶中20 min。支气管激发实验在排气塑料室(18 cm×14 cm×8 cm)进行。气溶胶粒子直径约3~5μm。对照组暴露于雾化吸入的PBS中。治疗组从第17天起,每只小鼠灌胃CuE(100或200 mg/kg),每日1次,连续7 d。地塞米松组在暴露于1%OVA气溶胶刺激前1 h腹腔注射地塞米松,自第21天起,每天注射1次。最后一次注射后,小鼠24 h内被处死。
2.2 支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)炎症细胞计数 左侧肺以生理盐水(37℃)灌洗,收集BALF,2 500 r/min离心10 min。回收细胞进行瑞氏染色,光镜下分类计数炎症细胞数量。
2.3 肺组织病理学分析 小鼠肺组织用4%多聚甲醛固定24 h,石蜡包埋。对肺切片进行苏木精-伊红(hematoxylin and eosin,HE)和高碘酸-希夫(periodic acid-Schiff,PAS)染色。光镜检查。HE染色观察反映支气管炎症的肺组织形态学改变。PAS染色评价杯状细胞增生。测定气道上皮中PAS染色阳性细胞的百分比,以估计粘液的产生量。在200倍放大显微镜视野下,随机选取各切片,进行光强度分析。
2.4 酶联免疫吸附实验 按照制造商的说明书,采用特异性ELISA试剂盒检测BALF中IL-4、IL-5、IL-13和IFN-γ。然后,用微板阅读器在450 nm处测量吸光度。
2.5 Western blot分析 小鼠肺组织在样品缓冲液中溶解后变性。由BCA蛋白试剂盒测定蛋白浓度。由SDS-PAGE分离等量的蛋白质样品。分离后蛋白质被转移到NC膜上。再用5%脱脂奶粉溶液封闭,并在4℃下与抗体共同孵育过夜。冲洗后,将膜与辣根过氧化物酶标记的山羊抗兔Ⅱ抗在室温下孵育2 h,用ECL检测试剂检测蛋白条带。
2.6 免疫组化 石蜡切片进行免疫组化分析。即经脱蜡固定后,加入抗NF-κB p65抗体和Ⅱ抗孵育,之后染色封片,应用Image-Pro Plus 6.0对结果进行分析,数据以各组积分吸光度均值与对照组的比值表示。
3 统计学处理
采用SPSS 17.0分析数据,计量资料用均数±标准差(mean±SD)表示,选用单因素方差分析(one-way ANOVA)统计方法,组间两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 葫芦素E对小鼠BALF中炎症细胞数量的影响
与对照组比,模型组BALF中嗜酸性粒细胞、淋巴细胞和中性粒细胞数量显著升高;经葫芦素E或地塞米松处理后,这些细胞的数量显著减少(P<0.05),见图1。此结果表明葫芦素E可减少OVA诱导哮喘小鼠BALF中相关炎症细胞的数量。
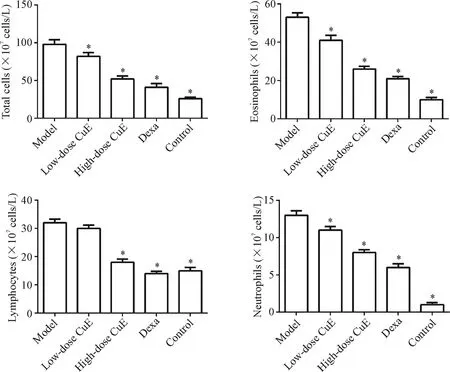
Figure 1.The effect of CuEon the numbers of inflammatory cells in BALFof the mice.Mean±SD.n=7.*P<0.05 vs model group.图1 葫芦素E对小鼠BALF中炎症细胞数量的影响
2 葫芦素E对小鼠BALF中炎症细胞因子含量的影响
与正常组比,模型组BALF中炎性细胞因子IL-4、IL-5及IL-13含量明显增高(P<0.05),而IFN-γ含量明显降低(P<0.05);与模型组比,葫芦素E高剂量组和地塞米松组IL-4、IL-5及IL-13细胞因子含量明显降低(P<0.05);与模型组比,葫芦素E低剂量组IL-4及IL-13细胞因子含量明显降低(P<0.05),而IL-5含量无明显变化(P>0.05);与模型组比高、低剂量葫芦素E组或地塞米松组IFN-γ含量明显增高。结果见图2。
3 葫芦素E对小鼠肺组织病理学表现的影响
用HE染色法测定肺切片中炎症细胞数,正常组未见异常;模型组与正常组比,气道周围有大量浸润性炎症细胞(P<0.05);葫芦素E高剂量组和地塞米松组炎症细胞浸润明显少于模型组(P<0.05)。用PAS染色测定杯状细胞的产生,正常组的上皮杯状细胞产生和黏液分泌正常。模型组PAS阳性细胞百分率明显高于正常组(P<0.05),而葫芦素E组和地塞米松组则气道上皮杯状细胞产生和黏液分泌明显降低(P<0.05)。结果见图3。
4 葫芦素E对小鼠肺组织MAPKs信号通路活性的影响
与正常组比,模型组肺部p-JNK、p-ERK1/2及pp38 MAPK的含量明显升高(P<0.05);与模型组比葫芦素E高剂量组或地塞米松组,肺部上述指标含量明显降低(P<0.05),但葫芦素E处理组上述指标含量仍高于正常组(P<0.05)。结果见图4。
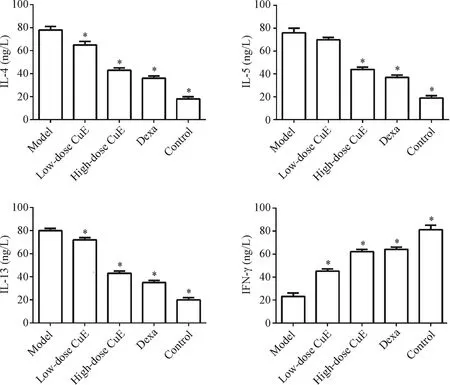
Figure 2.The effect of CuE on inflammatory cytokines content in BALF of mice.ELISA was used to detect the levels of IL-4,IL-5,IL-13 and IFN-γ in BALF.Mean±SD.n=3.*P<0.05 vs model group.图2 葫芦素E对小鼠BALF中炎症细胞因子含量的影响
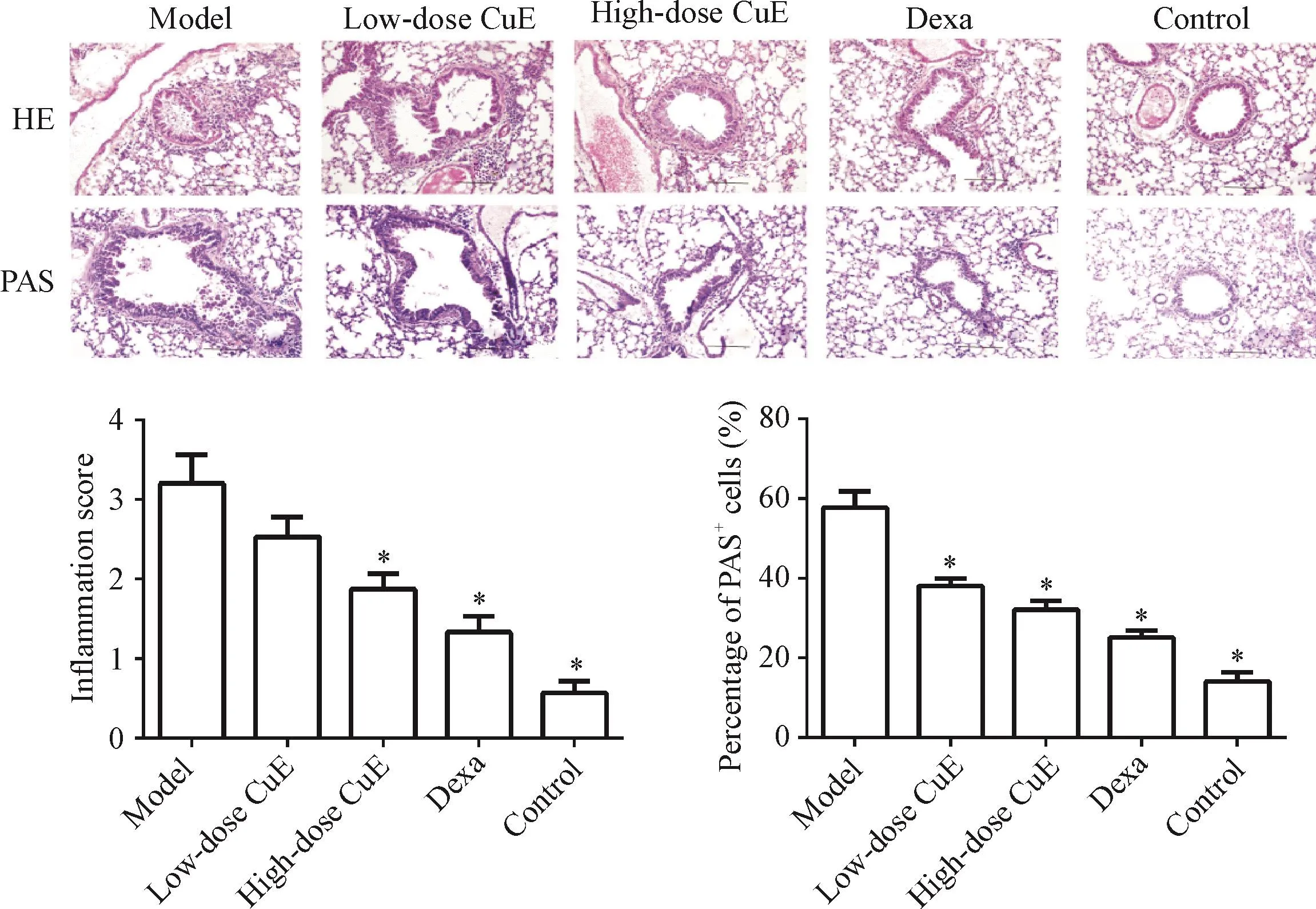
Figure 3.The effect of CuEon lung histomorphological lesions in the mice(×100).Mean±SD.n=3.*P<0.05 vs model group.图3 葫芦素E对小鼠肺组织病理表现的影响
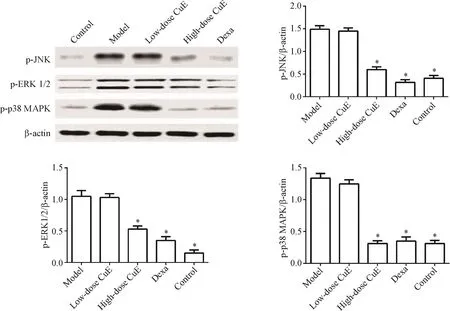
Figure 4.The effect of CuEon MAPKs signaling pathway activity in lung tissues of mice.Theprotein levelsof p-JNK,p-ERK1/2 and pp38 MAPK were determined by Western blot.Mean±SD.n=3.*P<0.05 vs model group.图4 葫芦素E对小鼠肺组织MAPKs信号通路活性的影响
5 葫芦素E对小鼠肺组织NF-κB信号通路活性的影响
用Western blot方法检测p-p65蛋白的水平,结果显示,与正常组相比,模型组肺部p-p65含量明显升高(P<0.05);与模型组比,葫芦素E高剂量组,肺部p-p65含量明显降低(P<0.05),见图5A。用免疫组化的方法检测p-p65蛋白的表达,结果显示,模型组较正常组肺部p-p65含量明显升高(P<0.05);与模型组比,葫芦素E组肺部p-p65含量降低(P<0.05),见图5B。
讨 论
在本研究中,我们利用OVA诱导的小鼠哮喘模型来探索葫芦素E对过敏性气道炎症的影响。以地塞米松为标准参考药物,比较葫芦素E抗哮喘活性。首先观察了葫芦素E对哮喘小鼠肺部炎症的影响。结果表明,葫芦素E明显降低了哮喘小鼠BALF的炎症细胞数量、抑制了肺组织炎症反应。本研究结果显示,葫芦素E明显减轻了OVA诱导小鼠的肺泡损伤。既往研究也显示葫芦素E对炎症具有一定疗效,王力先等[7]发现葫芦素E具有潜在免疫调节作用。乔静等[8]发现葫芦素E对脂多糖诱导的RAW264.7巨噬细胞炎症反应有影响。
细胞因子如IL-4、IL-5、IL-13及IFN-γ在慢性变应性炎症的进展中是必需的。据我们所知,过敏性哮喘表现为Th2细胞活性被激活,Th1细胞活性降低,发病机制为Th1/Th2细胞因子失衡[9]。Th2细胞释放IL-4、IL-5和IL-13等Th2型细胞因子,促进哮喘的发展。然而,Th1细胞因子,如IFN-γ,则抑制了哮喘气道炎症反应。结果表明,葫芦素E能明显降低BALF中IL-4、IL-5和IL-13的含量,提高IFN-γ的含量。因此,葫芦素E可能通过诱导Th1/Th2平衡免疫反应而减轻哮喘小鼠气道炎症反应。
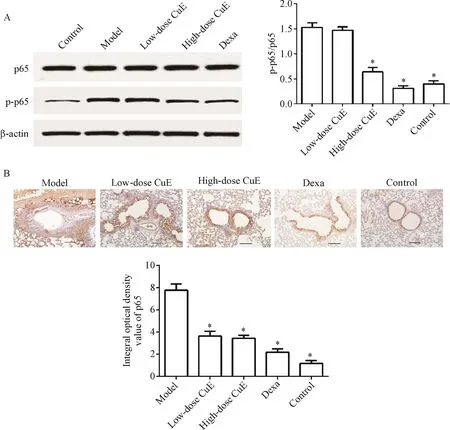
Figure 5.The effect of CuEon NF-κBsignaling activity in the lung tissues of mice(×100).A:p-p65 protein level was determined by Western blot;B:p-p65 protein expression was detected by immunohistochemical staining.Mean±SD.n=3.*P<0.05 vs model group.图5 葫芦素E对小鼠肺组织NF-κB信号通路活性的影响
研究显示,MAPKs和NF-κB信号通路的激活在哮喘发病过程中发挥作用。MAPKs信号通路在炎症反应中发挥重要作用,MAPKs信号通路主要包括JNK、ERK1/2和p38 MAPK介导的3条级联反应。有研究表明哮喘动物MAPKs信号通路较正常动物活性增强。本研究显示,模型组小鼠肺部p-JNK、p-ERK1/2及p-p38 MAPK含量较正常组明显升高,这与既往报道相一致[10]。本研究中,高剂量葫芦素E组明显降低了哮喘小鼠肺部p-JNK、p-ERK1/2及pp38 MAPK含量,表明高剂量葫芦素E可抑制OVA诱导的MAPK信号通路过度激活。目前已知,p38是MAPK家族控制炎症反应最重要的成员,它可由LPS、渗透性应激和紫外线照射而激活。活化的p38 MAPK可磷酸化IκB,导致IκB降解,进而激活NF-κB。其它研究也显示哮喘动物NF-κB通路活性较正常动物增加[11],与本研究结果一致。本研究显示,模型组p-p65表达升高,表明NF-κB通路激活,高剂量葫芦素E使哮喘小鼠p-p65表达较模型组明显降低,表明葫芦素E可明显抑制NF-κB通路活性。
如前所述,OVA引起了小鼠炎性因子分泌以及MAPKs/NF-κB信号通路激活。与文献报道一致,上述炎症因子的过度分泌及通路的激活,可引起肺部炎症加剧,肺泡损伤,并引起气道重塑[12]。针对此,大量研究以药物对哮喘进行干预,旨在降低炎症因子的过度分泌及MAPKs/NF-κB信号通路的过度激活。结果表明,能作用于上述靶点的药物,可明显减轻哮喘病变。
Shang等[13]发现葫芦素 E 通过抑制 HMGB1-TLR4-NF-κB信号通路,减轻脂多糖诱发的支气管上皮细胞损伤、炎症和MUC5AC的表达。本文进行了动物实验。这样,使葫芦素E在哮喘中作用的研究更具有说服力。葫芦素E对哮喘中的MAPK信号通路的影响是这篇文章中没有进行论述的。本研究中,葫芦素E明显降低了OVA引起的炎症因子分泌及MAPKs/NF-κB信号通路激活,同时减轻了小鼠肺部炎症以及肺泡损伤,理论上推测小鼠哮喘的好转可能与葫芦素E抑制炎症因子水平及MAPKs/NF-κB信号通路有关。在既往报道中,虽然有众多的中药提取物表现出了一定的抗哮喘作用,但与阳性对照药地塞米松比较,多数提取物均未达到或优于地塞米松的疗效[14]。与此类似,本研究中葫芦素E虽然明显抑制了炎症因子分泌及MAPKs/NF-κB信号通路活性,但其各数据仍未达到正常水平。因此,葫芦素E仅有部分缓解哮喘气道炎症作用。
总之,葫芦素E可明显缓解哮喘小鼠肺部炎症反应,同时抑制了MAPKs和NF-κB信号通路活性。故推测,葫芦素E减轻哮喘小鼠气道炎症与抑制MAPKs/NF-κB信号通路有关。

