miR-375对人类诱导多能干细胞向胰岛素分泌细胞分化的影响*
邓春艳, 王晗月, 李 宁, 蒋豆蔻, 俞丽娜, 欧阳志斌, 李富荣△
[暨南大学第二临床医学院(深圳市人民医院)1生物治疗室,2转化医学协同创新中心,深圳市干细胞研究与临床转化重点实验室,广东深圳518020;3暨南大学基础医学院病理生理学系,广东广州510632]
据世界卫生组织最新公布数据显示,糖尿病已成为紧随心脑血管疾病和恶性肿瘤之后的第3大疾病。尽管糖尿病患者可以通过补充胰岛素非常有效地控制血糖,但与健康患者相比,接受治疗的患者总体预期寿命缩短、生活质量改善,因此目前的研究主要是利用多种方法来产生功能完整的胰岛素分泌细胞(insulin-producing cells,IPCs)[1]。干细胞在一定条件下能诱导分化为IPCs,已经逐渐成为人们寻找胰岛β细胞替代物的新资源[2]。但是,体外干细胞(包括胚胎干细胞、诱导多能干细胞和成体干细胞)分化为胰岛β细胞效率低、成熟度差的问题限制着临床应用。
近年来有研究发现,微小RNA(microRNA,miRNA,miR)在干细胞自我更新和分化过程中发挥着重要的调控作用,调控某种特异性miRNA表达,可以促进干细胞向特定组织细胞的定向分化[3]。miR-375在人类和小鼠的胰岛中是表达最强的一种miRNA,对胰岛β细胞的成熟具有重要的作用[4]。miR-375前体经过在5′端和3′端的加工处理后可以形成miR-375-5p和miR-375-3p两个成熟的miRNAs,目前miR-375-5p的功能尚不明确,多数研究中证实的对胰岛发育具有重要调控作用的是miR-375-3p。因此,本研究通过构建miR-375-3p过表达体系,探讨miR-375过表达对人类诱导多能干细胞(human induced pluripotent stem cells,hiPSCs)向 IPCs分化的影响及可能机制。
材料和方法
1 材料及试剂
hiPSCs系NF1-4-iPS-C11为中国科学院广州生物医药与健康研究院惠赠,它是通过逆转录病毒转染OCT4、SOX2、c-Myc和Klf4基因导入人皮肤成纤维细胞重编程而产生的;人胰腺细胞系HPC-Y5来源于上海中科院细胞库。mTeSRTM1培养基购自STEMCELL Technologies;Matrigel购自BD;胰酶购自Hy-Clone;诱导分化过程中使用的DMEM/F12、F12、IMDM、DMEM/H、ITS-X supplement、B-27 supplement和N-2 supplement均购自Gibco;wortmannin购自Selleck;nicotinamide、exendin-4和retinoic acid(RA)购自Sigma;抗碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、骨形成蛋白 4(bone morphogenetic protein 4,BMP4)、胰岛素和C肽抗体购自PeproTech;总RNA提取试剂TRIzol购自Life;反转录试剂盒Prime ScriptTMRT reagent Kit和real-time PCR试剂盒SYBR Premix Ex TaqTMII购自TaKaRa;One Step PrimeScript miRNA cDNA Synthesis Kit和SPoly(T)plus miRNA qPCR-assay primer set购自深圳市盎然生物科技有限公司;BCA蛋白浓度检测试剂盒购自上海碧云天生物技术有限公司;LipofectamineTM2000购自 Invitrogen;Dual-Luciferase®Reporter(DLRTM)Assay System购自Promega。
2 主要方法
2.1 hiPSCs的培养 采用无饲养层细胞培养方式,hiPSCs生长在Matrigel包被的培养皿中,用mTeSRTM1培养基培养,每天更换新鲜的培养基。当细胞铺板率达到80%~90%时进行传代。
2.2 过表达miR-375的hiPSCs系的建立 采用Primer Premier 5.0软件设计并合成miR-375-3p的引物(5′-CGCCGCGGCCGCCGACGTGTCAGC-3′和 5′-GACTGCGGCCGCACAGCCTCTCCCACCCGTACGG-3′),PCR扩增片段后克隆至慢病毒载体CV130-SV40-puromycin,引物的合成及慢病毒原液的制备均由上海吉凯基因化学技术有限公司完成,同时构建空载体对照组。
2.3 hiPSCs的体外诱导分化 干细胞向IPCs分化的经典诱导方法参照文献[5]。第1阶段(第0~4天):诱导液为DMEM/F12中添加0.2%BSA、0.5×N-2 supplement、0.5× B-27 supplement、100 μg/L activin A和1μmol/L wortmannin,每天更换新鲜诱导液,连续诱导4 d;第2阶段(第4~8天):诱导液为F12与IMDM以1∶1比例混合,添加0.5%BSA、0.5× ITS-X supplement、0.5× B-27 supplement、2 μmol/L RA、20 μg/L FGF7和50μg/L Noggin,混合均匀,每天更换新鲜诱导液,连续诱导4 d;第3阶段(第8~13天):诱导液为DMEM/H中添加0.5%BSA、1×ITS-X supplement、1× N-2 supplement和50 μg/L EGF,混合均匀,每天更换新鲜诱导液,连续诱导5 d;第4阶段(第13~21天):诱导液为 DMEM/F12中添加 1× ITS-X supplement、10 μg/L bFGF、50 μg/L exendin-4、10 μg/L BMP4和10 mmol/L nicotinamide,混合均匀,每天更换新鲜诱导液。实验分为hiPSCs组(正常hiPSCs组)、miR-375-hiPSCs组(miR-375过表达组)和NeghiPSCs组(空载体对照组),各组细胞均按照上述方法进行诱导。诱导期间收集各组第0、7、14和21天的细胞用于后续监测。流式细胞术及C肽抗体染色检测各诱导阶段的分化效率。诱导结束采用免疫荧光染色检测胰岛素蛋白表达。通过体外葡萄糖刺激实验ELISA试剂盒测定诱导的IPCs释放的胰岛素和C肽含量来评估成熟度,并与人胰腺细胞系HPC-Y5来源的正常胰岛细胞对比。
2.4 S-Poly(T)plus RT-qPCR法检测miRNA-375的表达 将待检测细胞提取总RNA,按照TRIzol总RNA提取试剂盒的操作说明书进行,测定纯度和浓度后按照One Step PrimeScript miRNA cDNA Synthesis Kit说明书建立反应体系合成cDNA,按照S-Poly(T)Plus miRNA qPCR-assay说明书配制反应体系检测 miR-375(hsa-miR-375-3p,编号 MIMAT0000728,序列为 5′-UUUGUUCGUUCGGCUCGCGUGA-3′),以SNORD44为内参照,反应条件为:95℃ 3 min;95℃10 s,60℃ 30 s,40 cycles。以第0天的正常 hiPSCs作为对照,采用2-ΔΔCt法计算miR-375的相对表达水平。
2.5 real-time PCR法检测各阶段标志性基因的表达 诱导期间收集的各组细胞,按照TRIzol总RNA提取试剂的操作说明书进行总RNA的提取,测定纯度和浓度后按照试剂盒说明书建立反应体系合成cDNA并完成real-time PCR检测(引物序列见表1),动态监测各组hiPSCs分化为胰腺β细胞的过程中相关转录因子Pdx1、Pax6、Nkx6.1、MafA、insulin、glucokinase和HNF4α的表达变化,以GAPDH为内参照,反应条件为:95℃ 30 s;95℃ 5 s,60℃ 35 s,40 cycles。以第0天的正常hiPSCs作为对照,采用2-ΔΔCt法计算各基因的相对表达量。

表1 real-time PCR引物序列Table 1.The sequences of the primers used for real-time PCRanalysis
2.6 双萤光素酶报告基因实验 采用生物信息学软件(miRDB和TargetScan)预测miR-375可能的靶基因,构建含靶基因3′端非翻译区(3′-untranslated region,3′UTR)序列的萤光素酶报告基因载体和含miR-375的表达质粒,将两者共转染293T细胞,通过化学发光仪检测萤光素酶的活性,若活性降低,则通过验证;如果验证正确,则构建含有miRNA突变靶位点的萤光素酶报告基因载体,再次进行验证。
2.7 miR-375-hiPSCs中靶基因表达水平的检测分别采用real-time PCR(方法同前)和Western blot检测各组细胞中靶基因的mRNA和蛋白表达水平,验证调控是否发生在转录或翻译水平。Western blot方法如下:各组细胞经RIPA裂解液裂解,提取总蛋白,BCA蛋白定量法测定蛋白浓度后定量,加等量蛋白于加样孔中,顺序完成电泳、半干法转膜、5%脱脂奶粉封闭、I抗孵育及洗膜、II抗孵育及洗膜、显色,βactin作为内参照,显影之后Quantiy One软件对条带进行灰度分析。
3 统计学处理
统计学分析处理采用SPSS 19.0软件。所有数据分析采用均数±标准差(mean±SD)表示,多组间均数比较采用单因素方差分析(one-way ANOVA),两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 过表达miR-375的hiPSCs系的构建
将过表达miR-375的慢病毒和阴性对照病毒分别感染hiPSCs,嘌呤霉素筛选5 d后收取miR-375-hiPSCs和 Neg-hiPSCs的样本,S-Poly(T)plus RT-qPCR法检测miR-375的表达水平。Neg-hiPSCs与较未转染的hiPSCs相比miR-375表达水平差异无统计学显著性(P>0.05),miR-375-hiPSCs的miR-375表达水平较Neg-hiPSCs提高约10倍(P<0.05),见图1A。
2 IPCs的分化效率及成熟度
IPCs诱导结束后,免疫荧光检测miR-375-hiPSCs组和空载体组胰岛功能标志性蛋白胰岛素的表达和定位。结果显示,胞浆内可见胰岛素表达,且miR-375-hiPSCs组的表达率显著高于空载体组,见图1B。
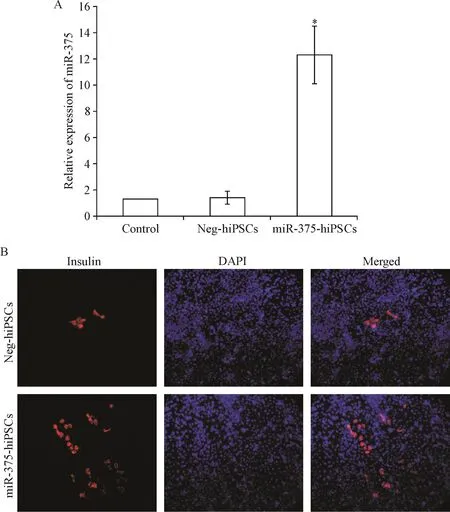
Figure 1.The expression of miR-375 in different hiPSCs groups(A)and the expression of insulin in induced miR-375-hiPSCs and Neg-hiPSCs into IPCs(B;21 d after induction,×200).Mean±SD.n=5.*P<0.05 vs control group.图1 不同组别hiPSCs中miR-375的表达及hiPSCs向IPCs分化后胰岛素蛋白的表达
流式细胞术结果显示,对照hiPSCs和NeghiPSCs经四步法诱导21 d分化为IPCs,C肽阳性率分别约为(22.5±2.9)%和(23.6±3.4)%,差异无统计学显著性(P>0.05),miR-375-hiPSCs组的C肽阳性率提高至(38.6±3.8)%,较上述两对照组显著增加(P<0.01),见图2A。
miR-375-hiPSCs经21 d诱导分化后,将诱导分化的IPCs与成年胰岛细胞进行葡萄糖刺激实验,采用ELISA测定培养上清中释放的胰岛素与C肽含量来评估成熟度。在低糖(2.5 mmol/L)和高糖(27.5 mmol/L)刺激下,对照hiPSCs和Neg-hiPSCs组分化的IPCs释放的胰岛素和C肽含量的差异无统计学显著性(P>0.05),与miR-375-hiPSCs组比较差异具有统计学意义(P<0.05);低、高糖刺激下,hiPSCs组和Neg-hiPSCs组分化的IPCs释放的胰岛素和C肽仅为成年胰岛细胞释放量的1/8,而miR-375-hiPSCs分化的IPCs释放的胰岛素和C肽含量为成年胰岛细胞释放量的1/5,见图2B、C。
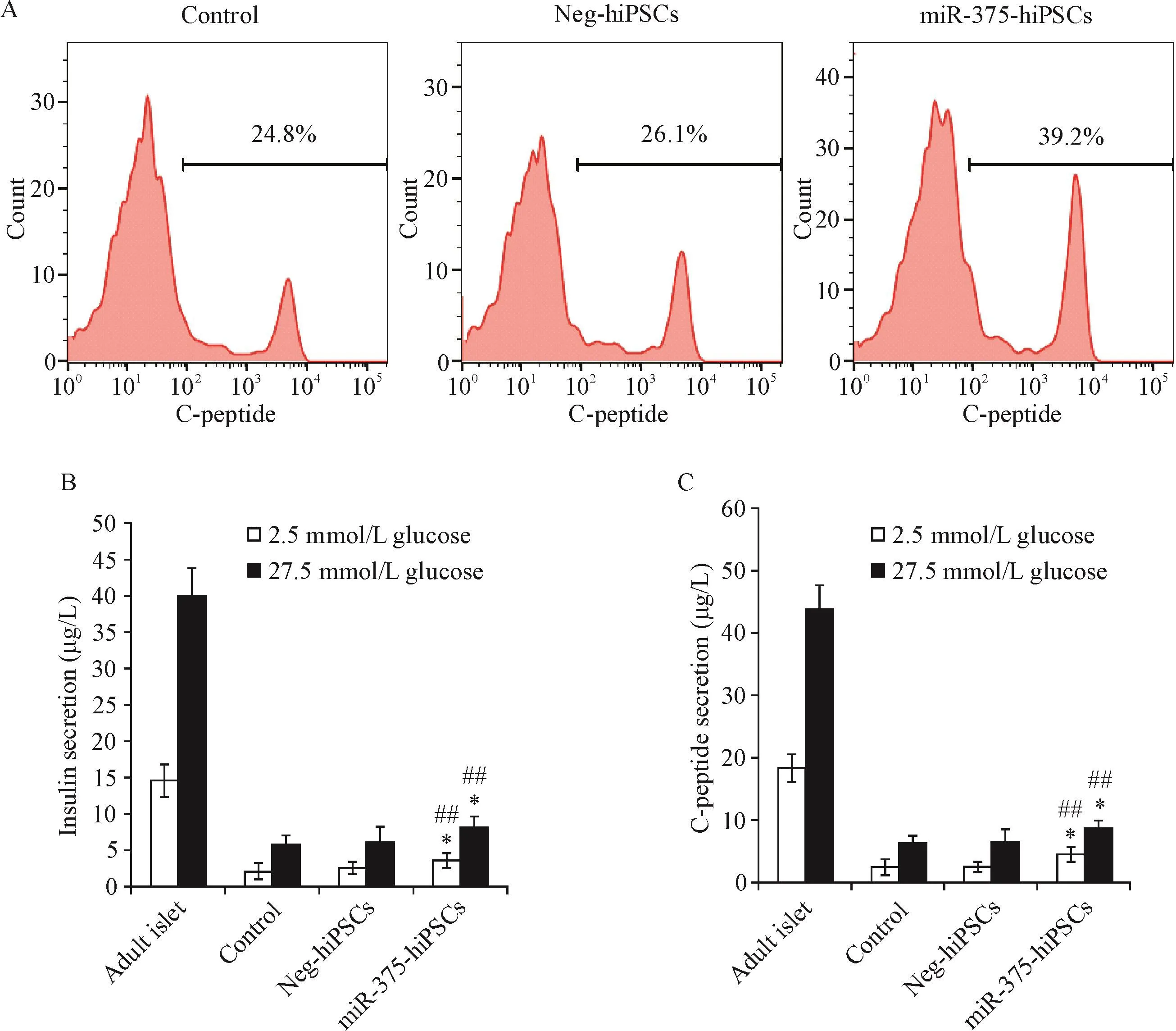
Figure 2.The efficiency and maturity of differentiated IPCs from hiPSCs.A:flow cytometric results of C-peptide-positive cells in each group;Band C:the insulin and C-peptide secretion of the differentiated IPCs in each group was compared with that of the adult isletβ cells after glucose tolerance test.Mean±SD.n=5.*P<0.05 vs control group;##P<0.01 vs adult islet group.图2 诱导分化的IPCs的效率和成熟度检测结果
3 miR-375-hiPSCs分化过程中基因表达的变化
对细胞分化过程中miR-375进行监测:显示在诱导过程第0、7、14和21天,3组hiPSCs(control、NeghiPSCs和miR-375-hiPSCs)中miR-375的表达均逐渐升高,miR-375-hiPSCs组升高最明显,与control和Neg-hiPSCs组之间的差异具有统计学意义(P<0.05),而Neg-hiPSCs与control之间的差异无统计学显著性,见图3A。此结果证明,分化过程中miR-375在miR-375-hiPSCs组细胞中高效过表达。
动态监测hiPSCs分化为IPCs过程中胰腺β细胞发育相关转录因子的表达变化,发现miR-375-hiPSCs组在诱导分化的第7天开始,HNF4α、Pdx1、Pax6和Nkx6.1的表达水平迅速增加,其中Pdx1的表达在第14天达到最高峰,随后略有下降,但仍维持在较高水平,其余均在第21天达最高峰;glucokinase、MafA及insulin的表达在第0、7和14天均维持在较低水平,第21天迅速达到最高峰;control组和Neg-hiPSCs组在经典四步法诱导的基础上虽然也表现出相应的变化趋势,但表达量明显低于miR-375-hiPSCs组,差异有统计学意义(P<0.05),见图3B~H。这些结果提示miR-375过表达促进了hiPSCs向IPCs分化过程中β细胞发育关键转录因子的表达。
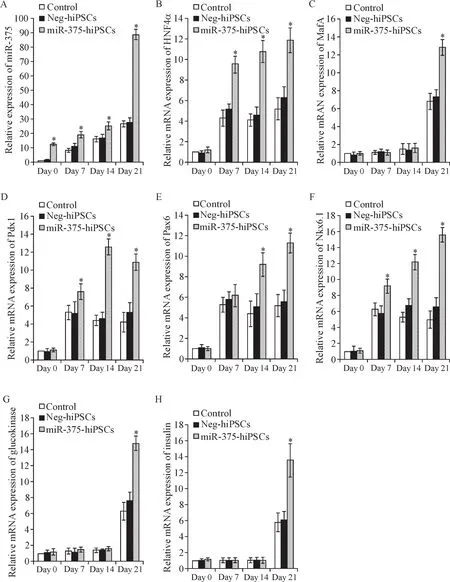
Figure 3.The gene expression changes during differentiation in different hiPSCs groups.A:the expression of miR-375 during differentiation at different time points;B~H:the mRNA expression of genes related to the development of pancreaticβ cells during differentiation at different time points.Data were normalized to normal hiPSCs in control group at Day 0.Mean±SD.n=5.*P<0.05 vs control group at the same time point.图3 不同组别hiPSCs分化过程中基因表达的变化
4 miR-375靶基因的预测与验证
TargetScan软件分析预测发现miR-375可能的靶基因中与胰腺发育相关的包括:抑制元件1沉默转录因子(repressor element-1-silencing transcription factor,REST;又称神经元限制性沉默因子,即neuron restrictive silencer factor,NRSF)和无翅型MMTV整合位点家族成员5A(wingless type MMTV integration site family,member 5A,WNT5A),其 mRNA 的3′UTR可与miR-375成熟序列的碱基互补配对,即REST和WNT5A很可能是miR-375的作用靶点之一。双萤光素酶报告基因实验结果显示,含有野生型质粒的萤光素酶活性明显减少,差异有统计学意义(P<0.05),而含有突变型质粒的萤光素酶活性的差异无统计学显著性,从结构上证实了miR-375与靶基因REST和WNT5A的3′UTR的特异性结合,见图4A、B。
5 miR-375-hiPSCs中靶基因的表达水平
real-time PCR结果显示,hiPSCs与miR-375-hiPSCs中REST和WNT5A的mRNA转录水平的差异无统计学显著性,见图4C;Western blot结果显示,miR-375-hiPSCs中REST和WNT5A的蛋白表达水平较正常hiPSCs组明显下降,见图4D。上述结果提示,miR-375对靶基因REST和WNT5A的影响主要发生在翻译水平,符合miRNA对靶基因抑制作用的特点。
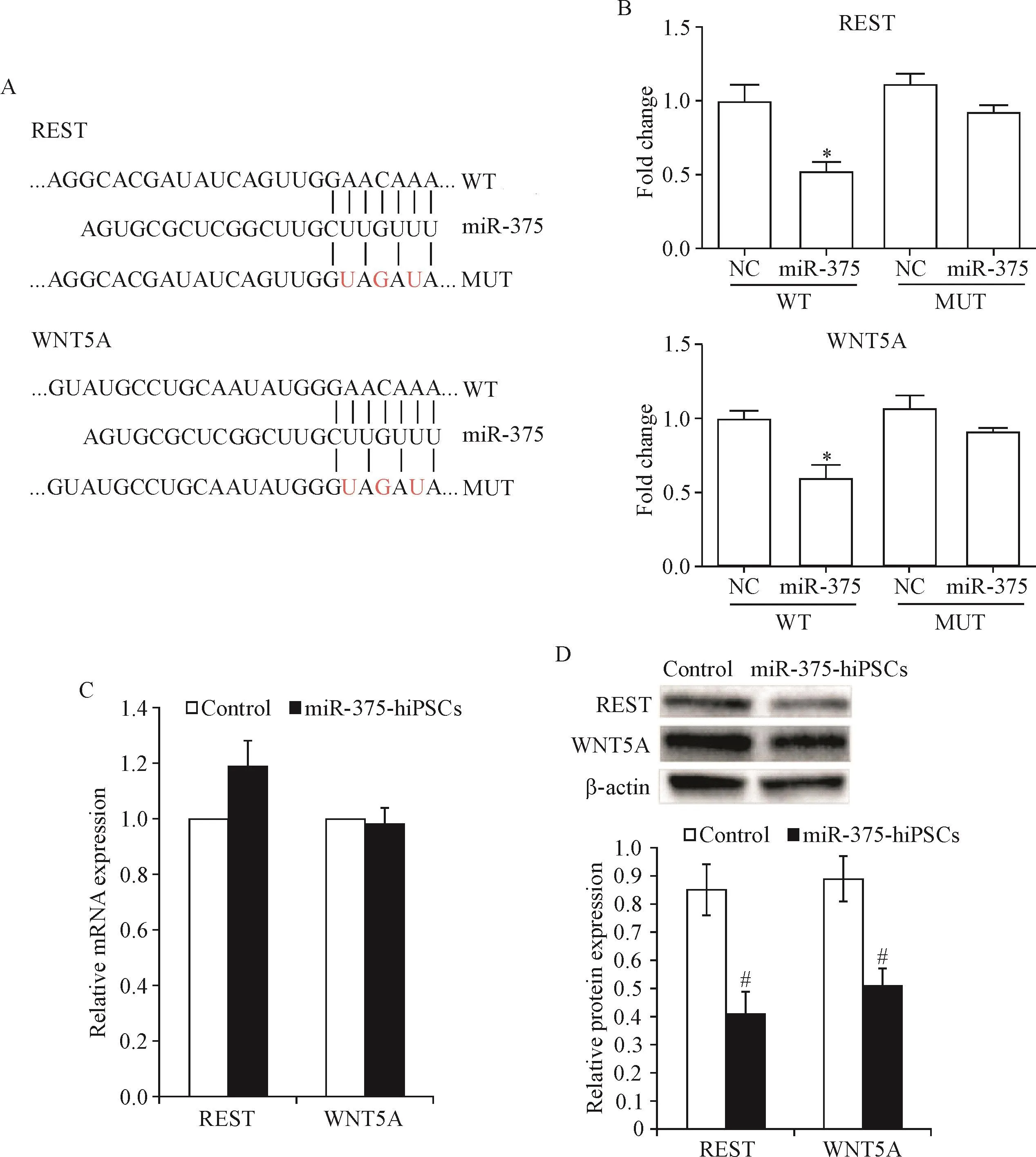
Figure 4.Prediction and validation of miR-375 target genes.A:the predicted binding sites of miR-375 with RESTand WNT5A(the red labeled nucleotides were the mutation sites designed in luciferase reporter assay);B:the relative luciferase activity of wild-type and mutant 3′UTR in 293T cells(NC:negative control);C:real-time PCR results of REST and WNT5A;D:Western blot for determining the protein levels of REST and WNT5A(β-actin as internal control).Mean±SD.n=5.*P<0.05 vs NCgroup;#P<0.05 vs control group.图4 miR-375靶基因预测与验证的结果
讨 论
miRNA在胰腺发育、β细胞分化、胰岛素分泌及葡萄糖代谢等方面都发挥着重要的作用[4]。miR-375特异性地表达于胰岛细胞中,调控胰岛胚胎发育过程及成熟胰岛β细胞的功能,影响胰岛素的合成与分泌,敲除miR-375的小鼠将发生胰岛发育障碍[6]。胰腺发育过程中的两个重要的转录因子Pdx1和NeuroD1共同作用于miR-375的启动子及增强子来调节miR-375的表达[7]。研究证实在不添加各种细胞因子和小分子化合物的情况下,仅采取过表达miR-375的方式经过21 d体外培养就可以分别将iPSCs或胚胎干细胞定向分化为IPCs,但分化效率和成熟度仍欠佳[8-9];在脂肪干细胞中过表达miR-375后进行诱导也能获得更多表达胰岛素和Pdx1的IPCs[10]。在前期工作中,课题组参考北京大学邓宏魁教授建立的诱导方案[5],通过添加各种细胞因子和小分子化合物建立了hiPSCs定向分化为胰岛β细胞的方法,分化效率约22.3%。在此基础上,本项目通过构建慢病毒载体转染miR-375至hiPSCs,过表达miR-375的hiPSCs结合经典四步法向IPCs诱导分化的过程中,将有利于胰岛β细胞标志性转录因子HNF4α、glucagon、Glut-2、Nkx6.1、Pdx1、Pax6、NeuroD和Isl-1的表达,明显提高了分化效率及增强了成熟度上,但与正常成人胰岛细胞功能仍存在一定差距。
生物信息学结合萤光素酶报告基因实验验证REST和WNT5A为miR-375的靶基因,进一步检测显示miR-375对REST和WNT5A的影响发生在蛋白质翻译水平,而非mRNA转录水平,符合miRNA对其靶基因抑制作用的特点。研究表明,REST蛋白参与调控胚胎干细胞的自我更新和全能性的维持,及干细胞的定向分化等多个生理过程[11]。一些对胰岛素分泌起着重要调控作用的分子如突触小体相关蛋白25(synaptosomal-associated protein 25,SNAP25)、突触结合蛋白4(synaptotagmin 4,SYT4)和连接蛋白36(connexin 36)等,都已证实可以被REST负调控,因而REST的表达不存在于正常胰岛β细胞中,胰岛β细胞表达REST将减少胰岛素的分泌[12-13]。Li等[14]的研究通过沉默REST基因将羊水中获得的干细胞成功诱导为胰岛素分泌细胞;另有研究通过体外操控基因表达,即抑制REST和Shh基因,同时过表达Pdx1基因将鼠骨髓MSC分化为可感应葡萄糖变化的IPCs,在他们的研究中抑制REST基因表达是必要的[15]。另一方面,WNT信号通路在胰腺发育的多个方面都至关重要,其不同层面的信号分子在胰腺组织中均有不同程度的表达[16]。研究提示在诱导hiPSCs向β细胞分化的过程中,添加WNT抑制剂获得的细胞整体蛋白质组学显示出更类似于成人胰岛的蛋白质组学特征[17];WNT5A可诱导大鼠胰岛细胞瘤细胞中钙调蛋白依赖性蛋白激酶II的活化,从而降低细胞稳定性连环蛋白及其核转位,最终降低细胞周期蛋白D1表达,成为抑制β细胞增殖的重要调控基因[18]。因此我们推测,miR-375有可能通过对REST和WNT5A的抑制,开启SNAP25、SYT4和connexin 36等与胰岛素分泌相关的特异性基因,调控hiPSCs向IPCs分化。
然而,在个体发育过程中,细胞分化是一个受到复杂、精确体系调控的有序规律过程。从分子水平看,这一结果取决于细胞在基因表达上的时空差异,是一个多基因通路综合变化的复杂网络。无论是miR-375或其涉及的可能靶基因,在胰岛β细胞的发育过程中都不是一成不变的,而是一个动态变化的过程。研究提示miR-375在胚胎胰腺发育过程呈先高后低的表达规律,其表达水平在胚胎干细胞定向分化过程第5天达到高峰,然后开始下降,直到分化结束[19];同时,miR-375过度表达将抑制小鼠胰岛β细胞中高糖诱发的胰岛素分泌,内源性miR-375的功能被抑制后可促进胰岛素分泌[20-21];也有研究报道miR-375上调可能增加胰岛β细胞凋亡[22]。另一方面,WNT5A在胰腺细胞的迁移和框架的构建中也发挥着积极的作用。尽管有研究提示WNT5A过表达会干扰胰岛正常发育[23],却也有研究显示在小鼠及斑马鱼等动物胚胎模型中,WNT5A在胰岛中广泛表达,WNT5A-/-的小鼠中胰岛素阳性细胞的迁移会受到阻碍[24];给予外源性WNT5A或过表达WNT5A均能抑制胰岛星状细胞生长从而利于胰岛素分泌[25]。这种看似矛盾的结果可能正好反映了基因调控网络的复杂性和精确性。因此,本研究采用过表达miR-375的hiPSCs结合经典四步法向IPCs诱导分化的过程中,虽然在一定程度上能够提高分化效率和成熟度,但未能完全实现分化过程中基因表达的精准动态调控,是形成局限的主要原因。
回顾过去的研究,干细胞用于糖尿病治疗取得了令人鼓舞的成果,但是仍有许多问题需要解决,如(1)干细胞转分化过程中,除干细胞发育的微环境等因素外,控制干细胞高效定向分化为β细胞的关键调控因子仍不清楚;(2)干细胞体外诱导分化和体内移植的安全性问题;(3)如何大规模用干细胞产生胰岛素分泌细胞。随着研究的进一步深入以及技术的提高和进步,相信不久的将来,这些问题都会被逐一解决,使干细胞临床治疗糖尿病成为可能。

