姜黄素通过激活肝细胞自噬减轻脂多糖/D-氨基半乳糖诱导的大鼠急性肝损伤*
谢一潋, 杨乃彬, 王丽萍, 宣艳艳, 邬怡怡, 钱国清, 石洁君, 史光侠, 李国祥
(宁波市第一医院感染科,浙江宁波315000)
由缺血、药物、外源性毒物及其代谢产物和感染等各种病因引起的急性肝损伤(acute hepatic injury,AHI)临床上十分常见,其病情发展迅速、凶险,如果未得到及时的控制和治疗,将会发展为急性肝衰竭,成为危及人类生命的重要疾病之一。脂多糖(lipopolysaccharide,LPS)/D-氨基半乳糖(D-galactosamine,DGalN)联合注射更能模仿人类的急性爆发性肝衰竭的发生,因此LPS/D-GalN诱导的动物模型是研究急性肝损伤最常用的模型[1]。
姜黄素(curcumin,CUR)是从香料姜黄的根茎中提取的一种酚类化合物,其药理作用广泛,具有抗氧化、抗炎、抗纤维化、抗肿瘤、抗菌以及调节免疫的功能,对于各类肝损伤有不同的预防或治疗效果[2]。多项研究发现,姜黄素可通过调节自噬发挥作用。Guo等[3]报道,姜黄素能激活自噬保护细胞免受过氧化氢诱导的损伤和减缓细胞凋亡。Yao等[4]认为,姜黄素可通过增强自噬、减轻凋亡,从而改善糖尿病相关心肌病变。张豪杰等[5]研究发现,姜黄素减轻小鼠肾脏再灌注损伤的作用可能与其促进再灌注后细胞自噬相关。目前国内外关于姜黄素对LPS/D-GalN诱导的急性肝损伤影响的研究较少,我们既往的研究显示姜黄素对LPS/D-GalN诱导的大鼠急性肝损伤有一定治疗作用[6],基于此,本实验拟从细胞自噬的角度,探讨姜黄素减轻LPS/D-GalN诱导的大鼠急性肝损伤的机制。
材料和方法
1 动物
SPF级雄性SD大鼠,购入时6周龄,实验时体重为180 g左右,购自上海斯莱克公司,购入后在SPF级动物房适应性饲养1周。
2 主要试剂
LPS、D-GalN、3-甲基腺嘌呤(3-methyladenine,3-MA)和姜黄素均购自Sigma;兔抗小鼠微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)和beclin 1抗体购自Cell Signaling Technology;ELISA检测试剂盒购自eBioscience。
3 主要方法
3.1 急性肝损伤动物模型的建立及实验分组 采用腹腔注射800μL的LPS(8μg/kg)及D-GalN(800 mg/kg)制造急性肝损伤动物模型,剂量根据我们既往的研究得出[6]。实验动物采用随机数字表法随机分为5组,分别为对照(control)组、AHI组、CUR组、3-MA组和3-MA+CUR组,每组6只。对照组给予等体积生理盐水腹腔注射,其余各组均建立急性肝损伤模型;姜黄素组每天给予姜黄素溶液120 mg/kg(溶于0.5%CMC-Na),5 mL/kg灌饲大鼠1次,连续5 d后建立急性肝损伤模型,对照组、AHI组和3-MA组每天给予等体积0.5%CMC-Na灌胃5 d。3-MA组在建立急性肝损伤模型前2 h腹腔注射2.5 mg/kg 3-MA[7]。3-MA+CUR组于肝损前5天给予120 mg/kg姜黄素溶液灌饲,然后在建立急性肝损伤模型前2 h腹腔注射2.5 mg/kg 3-MA。在肝损模型建立12 h后处死大鼠并收取血及肝组织;血清存放于-80℃冰箱,病理组织样本浸泡于4%甲醛,肝组织经液氮瞬时冷冻后转移至-80℃冰箱备用。
3.2 血液生化指标检测 将获得的血清采用全生化分析仪检测大鼠血清谷丙氨酸氨基转移酶(alanine aminotransferase,ALT)和天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)水平。
3.3 肝组织切片病理变化的观察 肝组织标本于4%甲醛溶液固定后,进行脱水、浸蜡、包埋、切片和HE染色,于正置显微镜下观察肝脏组织的病理学形态变化。
3.4 透射电镜观察自噬体 肝组织标本于2.5%戊二醛磷酸缓冲液中固定后,进行冲洗、后固定、染色、冲洗、脱水、包埋、切片,采用4%醋酸铀-枸橼酸铅染色,最后将染色后的超薄切片放到单孔铜网上,于透射电镜下观察。
3.5 Western blot检测自噬相关蛋白的表达 取0.1 mg肝脏组织,加入裂解液充分匀浆,离心后取上清液。先用双喹啉-4-羧酸二钠盐蛋白分析试剂盒测定样本内蛋白浓度,再用聚丙烯酰胺凝胶电泳分离蛋白质,并转膜。室温下封闭1 h,摇床上洗涤5 min,移入含有I抗(抗LC3和beclin 1抗体)的孵育盒中,4℃孵育过夜。再在摇床上洗涤3次,移到含II抗(goat anti-rabbit IgG和goat anti-mouse IgG,1∶5 000稀释)的抗体孵育盒中,于室温摇床上孵育2 h。洗涤3次后加入底物并曝光显影。应用生物电泳图像分析系统测定条带灰度值,以目的蛋白条带灰度值与GAPDH条带灰度值的比值反映目的蛋白的表达水平。
3.6 肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)的ELISA检测 取保存的血清,按照ELISA试剂盒说明书操作检测细胞因子TNF-α的含量。
4 统计学处理
应用SPSS 21.0统计软件进行分析。数据均采用均数±标准差(mean±SD)表示,多组样本均数之间比较采用单因素方差分析,若各组总体方差齐同,则采用SNK-q检验,若方差不齐,则采用Tamhane检验,以P<0.05为差异有统计学意义。
结 果
1 各组大鼠血清ALT和AST水平
与对照组比较,AHI组ALT和AST水平显著升高(P<0.05);与AHI组比较,姜黄素组的ALT和AST水平显著下降(P<0.05);与姜黄素组比较,3-MA组及3-MA+CUR组的ALT和AST水平均显著升高(P<0.05),但与肝损伤组比较差异均无统计学显著性(P>0.05),见图1。
2 肝组织切片病理学的变化
正常对照组肝细胞轻度水肿,未见明显病变。肝损伤组可见约50%的肝细胞坏死,坏死的肝细胞核碎裂、胞浆深染,坏死区可见较多炎细胞浸润。姜黄素组的坏死细胞较肝损伤组显著减少,炎细胞浸润相对较轻。而3-MA组及3-MA+姜黄素组较肝损伤组无明显变化,见图2。
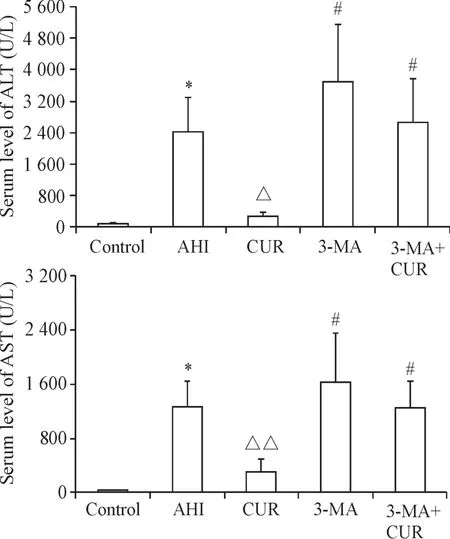
Figure 1.The serum levels of ALT and AST in various groups.Mean±SD.n=6.*P<0.05 vs control group;△P<0.05,△△P<0.01 vs AHI group;#P<0.05 vs CUR group.图1 大鼠血清ALT和AST水平的变化
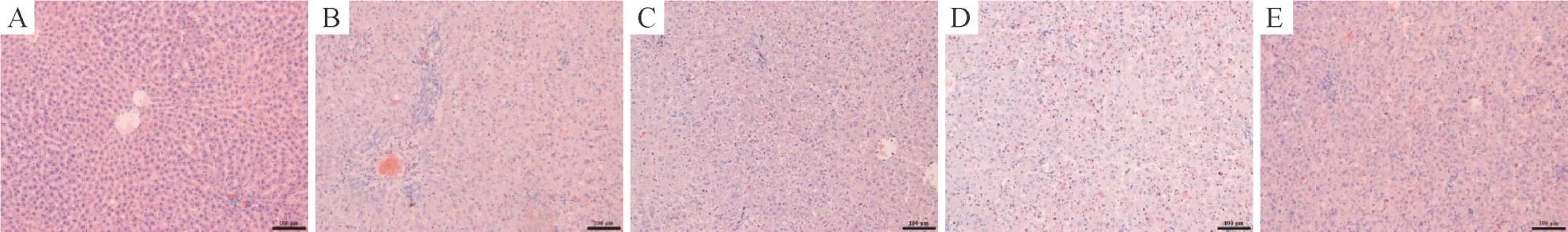
Figure 2.Pathological changes of rat liver tissues in various groups(HEstaining,×100).A:control group;B:AHIgroup;C:CUR group;D:3-MA group;E:3-MA+CURgroup.图2 各组大鼠肝组织的病理变化
3 电镜下观察自噬体的情况
正常对照组无明显自噬体形成,线粒体嵴和膜形态正常。AHI组可见较多自噬小体形成,线粒体膜、核膜和细胞膜不完整、线粒体嵴间隙加大、消失。姜黄素组可见大量自噬小体形成。3-MA组及3-MA+CUR组自噬体较姜黄素组明显减少,见图3。
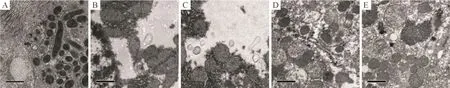
Figure 3.Autophagic bodies of the liver tissue were observed by transmission electron microscopy(×10 000).A:control group;B:AHIgroup;C:CURgroup;D:3-MA group;E:3-MA+CURgroup.图3 各组大鼠肝组织的透射电镜下自噬体的观察
4 各组大鼠肝组织内自噬相关蛋白LC3及beclin 1的表达情况
与对照组比较,AHI组大鼠的LC3-Ⅱ及beclin 1蛋白表达量均上调(P<0.01);与AHI组比较,姜黄素组的LC3-II及beclin 1蛋白表达量均上调(P<0.01);与姜黄素组比较,3-MA组及3-MA+CUR组的LC3-II及 beclin 1蛋白表达量均显著下降(P<0.01),见图4。
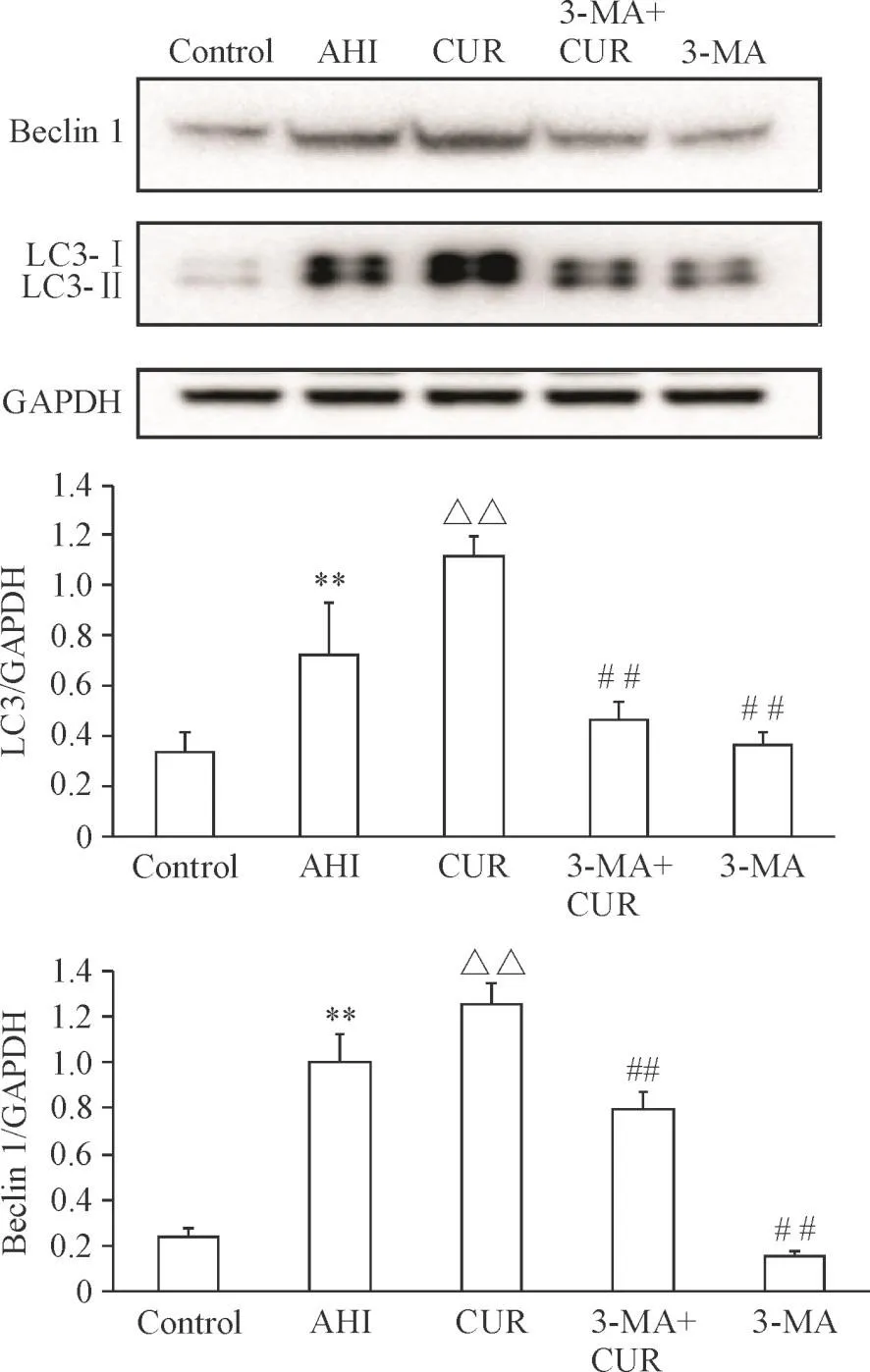
Figure 4.The protein levels of LC3 and beclin 1 in the liver tissues in variousgroupsdetected by Western blot.Mean±SD.n=3.**P<0.01 vs control group;△△P<0.01 vs AHI group;##P<0.01 vs CURgroup.图4 肝组织自噬蛋白LC3和beclin 1蛋白水平的变化
5 各组大鼠血清TNF-α表达情况
AHI组大鼠血清TNF-α含量较对照组显著升高(P<0.01);姜黄素组大鼠血清TNF-α含量较AHI组显著下降(P<0.01);3-MA组及3-MA+姜黄素组大鼠的血清TNF-α含量较姜黄素组明显增高(P<0.01),见图5。
讨 论
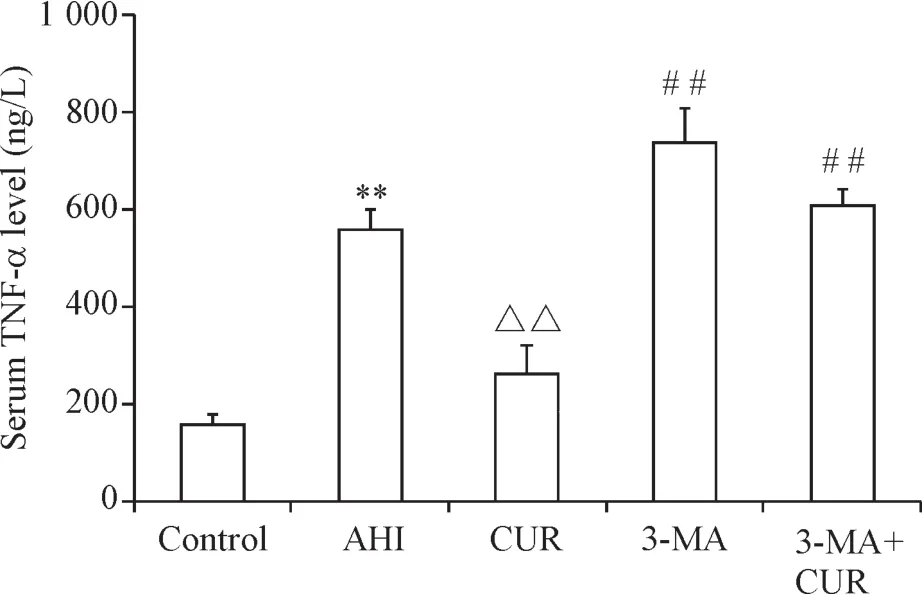
Figure5.The serum levels of TNF-αin various groups detected by ELISA.Mean±SD.n=6.**P<0.01 vs control group;△△P<0.01 vs AHIgroup;##P<0.01 vs CURgroup.图5 各组大鼠血清TNF-α含量的比较
自噬是真核生物细胞中一种高度保守的代谢途径,负责处理受损的细胞器和错误折叠的蛋白,并在恶劣条件下为机体提供充分的能量,因此,自噬对机体在应激状态下维持细胞内平衡、细胞生存和内环境稳定起关键作用。此外,自噬对炎症有着重要的调节作用,可影响炎症疾病的病理进程,其重要作用与肝脏、肌肉等代谢性器官密切相关[8]。
近年来许多研究表明,自噬在LPS/D-GalN诱导的急性肝损伤中发挥重要的调节作用。LPS/D-GalN作用于肝脏后,可诱导肝脏巨噬细胞大量释放促炎因子引起应激反应,过度表达的促炎因子如TNF-α、持续大量的活性氧簇(reaction oxidation species,ROS)等会造成线粒体或其它细胞器的损伤。如果受损的细胞器没有通过适应性反应得到处理,就会发生细胞死亡或者凋亡。而自噬就是一种适应性反应。Amir[9]等发现,在 LPS/D-GalN 诱导的急性肝损伤模型中,抑制肝脏特异性自噬会加重TNF-α诱导的肝损伤;Ilyas等[10]在巨噬细胞特异性敲除Atg5模型中,用LPS/D-GalN注射,刺激急性肝损伤小鼠中发现敲除组小鼠肝损伤较对照组加重,依赖炎性小体产生的血清白介素1β(interleukin-1β,IL-1β)显著增加,提示敲除组小鼠炎症小体活性增加,故加重了急性肝损伤。魏琳琳等[11]也发现,在LPS/D-GalN诱导的小鼠急性肝衰竭的早中期,肝细胞自噬逐渐增强,可能起保护性作用。以上研究均提示自噬参与LPS/D-GalN诱导的急性肝损伤的调控,并在其中发挥保护作用。
目前观察自噬现象最直接、最经典的方法是通过透射电子显微镜发现自噬体,这是自噬检测的“金标准”。而LC3和beclin 1是反映自噬水平的最常用的蛋白。LC3是重要细胞骨架辅助成分,分为LC3-I和LC3-Ⅱ,自噬发生时LC3-I经泛素样加工,与自噬膜表面的脂酰乙醇胺结合形成LC3-Ⅱ,LC3-Ⅱ被募集并定位于自噬体膜上,直至自噬体和溶酶体相融合[5]。大量研究表明,beclin 1参与自噬体的形成,它能介导其他自噬蛋白定位于自噬前体,在自噬中起重要作用。beclin还可调节液泡分选蛋白34(valuolar protein sorting 34,Vps-34),诱导 beclin-Vps34-Vps15核心复合体形成,从而促进自噬[12]。LC3和beclin 1表达水平的增高常提示自噬活性的增高,因此本研究选择观察这两种蛋白来评估自噬水平。
我们的研究结果显示,LPS/D-GalN可引起大鼠急性肝损伤,表现为ALT和AST的升高,病理损伤程度的加重,电镜显示自噬体有所增多,Western blot显示自噬相关蛋白LC3和beclin 1的表达增强,自噬的增强可能与肝细胞的自我保护反应有关;应用姜黄素后,肝脏功能得到明显改善,组织病理损伤程度减轻,提示姜黄素对肝脏起保护作用,同时发现自噬体进一步增多,细胞自噬相关蛋白表达进一步增强,提示肝组织中存在活跃的自噬;3-MA作为I型磷脂酰肌醇3激酶通路抑制剂,可抑制自噬的起始阶段以及自噬小体的形成,应用自噬抑制剂3-MA后,姜黄素的促进自噬作用被其阻滞,其对肝脏的保护作用也随之消失。这些结果表明,姜黄素可能通过激活自噬减轻LPS/D-GalN诱导的急性肝损伤。
Zhao等[13]研究发现,在脓毒症诱导的急性肺损伤中,自噬可降低促炎因子TNF-α、IL-6和IL-8的表达;而Liu等[14]发现,抑制自噬会使炎症介质IL-1β、TNF-α、IL-6等增加,减弱抗炎效应;孙健等[15]的研究也提到,上调细胞自噬会抑制NF-κB蛋白的水平,增加其对炎症细胞因子的抑制作用;而抑制自噬则导致NF-κB蛋白水平增加,并减弱其对炎症细胞因子生成的抑制作用。以上研究均提示,自噬可能参与了对炎症因子水平的调控过程。本研究中,姜黄素组自噬蛋白较AHE组增加,促炎因子TNF-α的表达水平显著低于AHI组,而加入自噬抑制剂3-MA后则逆转了姜黄素的作用,与文献报道一致。
综上所述,姜黄素对LPS/D-GalN诱导的大鼠急性肝损伤肝脏的保护作用可能与其促进自噬减轻炎症反应相关,但仍需进一步深入的研究。

