钙蛋白酶2及自噬相关蛋白5对内质网应激诱导的肝细胞凋亡的影响*
陈雨丝,韩 冰,郑 璐,蔡 爽,汤 雷,杨 毅,郭怡歆,梁 猜, 赵金有, 杨 婷, 杨 勤, 谢汝佳
(贵州医科大学贵州省常见慢性疾病发病机制及药物研究重点实验室,基础医学院病理生理学教研室,贵州贵阳550025)
细胞凋亡(apoptosis)属于程序性细胞死亡的方式之一,是通过激活特定的信号通路、受到严格控制的细胞主动死亡的过程。细胞凋亡在维持机体稳态和保证组织器官正常生理功能中具有重要意义,但是如果细胞凋亡过度也会导致疾病的发生[1]。且内质网作为真核细胞重要的膜性细胞器,对细胞的调控起着非常重要的作用,一旦如饥饿、Ca2+平衡紊乱、氧化应激等有害因素侵袭时,内质网的稳态被打破,大量的未折叠蛋白和错误折叠蛋白累积在内质网腔内,从而导致内质网应激(endoplasmic reticulum stress,ERS)发生,而ERS一旦持续或加重,就会诱导细胞发生凋亡[2]。因此,ERS时,细胞为了对抗一系列有害因素的侵袭会启动其它的蛋白质降解途径来对其内质网腔内堆积的未折叠蛋白和错误折叠蛋白进行降解,从而恢复内质网的稳态[3]。近年来的研究证明,自噬(autophagy)作为真核生物细胞内除泛素-蛋白酶体降解系统的另一种蛋白质降解系统,参与了对未折叠蛋白和错误折叠蛋白的降解过程,而自噬相关蛋白5(autophgy-related protein 5,Atg5)可与Atg12结合,形成Atg5-Atg12泛素样连接系统,再和外膜结合以促进自噬体膜的延伸,最后形成自噬体,因此Atg5在自噬形成初期起着重要重要作用[4]。
钙蛋白酶(calpain)是钙依赖性的半胱氨酸蛋白酶,广泛分布于绝大多数哺乳动物组织中。calpain-2是calpain超家族的主要成员之一。有研究表明,calpain-2可能通过水解Atg5,从而在转录后水平上对Atg5的表达进行调控[5]。然而在肝细胞中calpain-2与Atg5之间的相互关系以及对肝细胞凋亡的影响却未见有报道。本研究采用二硫苏糖醇(dithiothreitol,DTT)处理体外培养的大鼠正常肝细胞BRL-3A,诱导细胞发生ERS,观察calpain-2及Atg5对肝细胞凋亡的影响。
材料和方法
1 材料
大鼠正常肝细胞BRL-3A(中国科学院典型细胞培养物保藏中心上海细胞库);DMEM培养基和胎牛血清(Gibco);胰酶、彩虹Marker、BCA蛋白定量试剂盒和DTT(北京索莱宝科技有限公司);细胞裂解液、蛋白酶抑制剂、Annexin V-FITC/PI细胞凋亡检测试剂盒和细胞周期检测试剂盒(江苏凯基生物技术有限公司);逆转录试剂盒(Thermo);兔抗β-actin抗体、兔抗Atg5抗体、兔抗Atg7抗体和兔抗微管相关蛋白1轻链 3(microtubule-associated protein 1 light chain 3,LC3)抗体(Abcam);兔抗calpain-2抗体(Thermo);Protein G琼脂糖微珠(Cell Signaling Technology)。
2 方法
2.1 细胞培养 用含10%胎牛血清、1%青-链霉素的DMEM培养基培养BRL-3A细胞,置于37℃、5%CO2的培养箱中培养,2~3 d换液1次,细胞密度达85~90%时以1∶3传代备用。
2.2 多功能实时无标记细胞分析仪(real-time cell analysis,RTCA)检测不同浓度的DTT对BRL-3A细胞增殖的影响 RTCA DP系统可通过E-plate底部的电极检测贴壁细胞的电阻抗,来反应细胞的数量、形态、活力以及贴壁的情况,将细胞指数(cell index,CI)作为检测指标。取处于对数生长期的细胞,用含EDTA胰酶消化后制成细胞悬液再进行细胞计数,以每孔7×103个细胞接种于E-plate,等细胞贴壁后再分别加入终浓度为0 mmol/L、0.5 mmol/L、1.0 mmol/L、2.0 mmol/L、4.0 mmol/L和6.0 mmol/L的DTT处理BRL-3A细胞,每个浓度设置3个复孔,连续动态检测60 h,观察不同浓度的DTT对BRL-3A细胞增殖的影响,每10 min记录1次,最后采用RTCA软件来分析获得CI值并筛选出后续实验的最佳药物浓度。
2.3 ERS细胞模型的建立 根据RTCA实验结果,使用终浓度为2.0 mmol/L的DTT诱导BRL-3A细胞发生ERS,处理时间分别为0 h、6 h、12 h和24 h,收集细胞样本用于real-time PCR、Western blot、免疫共沉淀(co-immunoprecipitation,Co-IP)及流式细胞术检测。
2.4 流式细胞术检测细胞凋亡 细胞处理方法同2.3。用不含EDTA的胰酶消化各组细胞,收集各组细胞至离心管中,2 000 r/min离心5 min后弃上清,然后用预冷的PBS洗涤,2 000 r/min离心5 min各2次。加入500μL的binding buffer悬浮细胞,每一组细胞中加入5μL的annexin V-FITC混匀,再加入5μL的PI混匀,室温下避光反应10~15 min,上流式细胞仪检测。
2.5 流式细胞术检测细胞周期 细胞处理方法同2.3。用不含EDTA的胰蛋白酶消化各组细胞,收集各组细胞至离心管中,2 000 r/min离心5 min,弃上清,再以预冷的PBS洗涤,2 000 r/min离心5 min,弃上清后各组加入500μL无水乙醇固定4℃过夜,次日1 000 r/min离心3~5 min,弃掉无水乙醇,再以PBS洗涤后1 000 r/min离心3~5 min,弃上清。配制PI/RNase A染色工作液,各组分别加入工作液500μL,混匀后避光反应30~60 min,上流式细胞仪检测。
2.6 real-time PCR法检测calpain-2和Atg5的mRNA表达水平 将每组细胞用PBS洗涤2次,再加入1.0 mL的TRIzol裂解液置于冰上裂解10 min,收集细胞裂解液提取RNA,用核酸蛋白仪测定RNA浓度,并根据A260/A280的比值确定所提取的RNA的纯度,且所有样本的A260/A280的比值均在1.8~2.0范围内则符合实验要求。按照Thermo K1622逆转录试剂盒说明书配制逆转录反应体系:5×reaction buffer 4μL,dNTP Mix 2μL,Oligo dT 1μL,RNase inhibitor 1μL,transcriptase 1μL,RNA样品为含1μg RNA的体积,RNase-free H2O补足反应体系。反应条件为:25℃10 min,48℃ 60 min,95℃ 5 min。逆转录后合成的cDNA保存在-4℃短期内使用。然后按照说明书配制实时荧光定量PCR反应体系:2×SYBR Green PCR Master Mix 12.5 μL,上、下游引物各 1 μL,cDNA模板2μL,RNase-free H2O 8.5μL,总体积25 μL。反应条件为:95℃ 30 s;95℃ 5 s,60 ℃ 30 s,共40个循环。mRNA相对表达量用2-ΔΔCt表示。实验所用的引物序列见表1。
2.7 Western blot法检测calpain-2、Atg5、Atg7、Atg12和LC3的蛋白水平变化 收集各组细胞,分别加入120μL细胞裂解液,置于冰上裂解10 min,收集细胞悬液于4℃、12 000 r/min离心30 min,取上清。BCA工作法进行蛋白定量,以40μg总蛋白上样然后进行SDS-PAGE,电泳完成后将蛋白转移至PVDF膜上,以含5%脱脂奶粉的TBST封闭90 min。将兔抗calpain-2、Atg5、Atg7、Atg12和LC3抗体用I抗稀释液按照说明书上的比例稀释后与PVDF膜置于4℃摇床孵育过夜,次日用TBST洗膜3遍后再与II抗(1∶4 000)室温孵育60 min,TBST洗膜3遍,ECL发光成像,βactin作为内参照,用Image Lab图像分析软件对样本每一个条带的灰度值进行半定量分析。

表1 Real-time PCR的引物序列Table 1.The sequences of the primers for real-time PCR
2.8 Co-IP法检测calpain-2与Atg5之间的相互作用关系 将细胞随机分为对照组和DTT组,DTT组采用终浓度为2.0 mmol/L DTT处理24 h,对照组则加入等体积PBS处理24 h。弃培养基,PBS洗涤1次,每皿加入500μL裂解液,冰上裂解10 min。用细胞刮分别收集至1.5 mL的EP管中,4℃、12 000 r/min离心10 min,取上清至新的EP管中,BCA工作法定量,将抗体按免疫共沉淀所需1∶50比列添加至200 μL浓度为1 g/L的裂解物中,4℃旋转孵育过夜。次日,加入Protein G琼脂糖微珠各20μL,4℃旋转孵育3 h后,4℃、10 000 r/min离心1 min,弃上清,800μL洗涤液洗涤沉淀5次,然后分别加入2×上样缓冲液20 μL,涡旋震荡后14 000×g瞬时离心30 s,样品加热至 95~100℃,5 min后14 000×g离心 1 min,进行Western blot。
3 统计学处理
采用GraphPad Prism 5统计软件进行数据分析。数据均采用均数±标准差(mean±SD)表示。多组之间比较则采用单因素方差分析(one-way ANOVA),以P<0.05为差异有统计学意义。
结 果
1 RTCA动态监测不同浓度的DTT对BRL-3A细胞增殖的影响
与0 mmol/L DTT组相比,0.5 mmol/L DTT和1.0 mmol DTT对BRL-3A细胞增殖并没有明显的抑制作用,而2.0 mmol/L DTT对细胞增殖有明显的抑制作用(P<0.05),且随着浓度的增加,DTT对细胞增殖的抑制作用更明显,见图1。
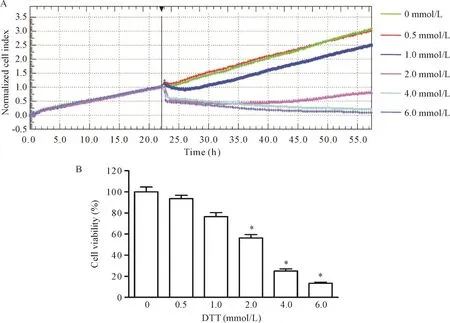
Figure 1.Dynamic monitoring of the normalize cell index of the BRL-3A cells treated with DTTat different concentrations by xCELLigence RTCA system(A),and the viability of BRL-3A cells exposed to DTTat different concentrations for 24 h(B).Mean±SD.n=3.*P<0.05 vs0 mmol/L group.图1 xCELLigence RTCA系统动态监测不同浓度DTT处理的BRL-3A细胞的标准化细胞指数
2 流式细胞术检测BRL-3A细胞凋亡情况
流式细胞术检测发现,2.0 mmol/L DTT处理BRL-3A细胞0 h、6 h、12 h和24 h后,0 h组细胞凋亡率为(4.41±3.41)%,6 h组细胞凋亡率为(2.70±6.76)%,DTT作用时间延长后,12 h组细胞凋亡率为(12.13±7.19)%,24 h组的细胞凋亡率为(22.71±19.25)%,细胞凋亡率随着DTT作用时间延长进一步增加(P<0.05),见图2。
3 流式细胞术检测BRL-3A细胞的细胞周期分布
流式细胞术检测细胞周期发现,DTT 6 h、12 h和24 h组的细胞周期分布与0 h组相比均发生明显变化,细胞周期均被阻滞在G1期,且S期及G2/M期细胞比例明显下降,见图3及表2。
4 Real-time PCR检测calpain-2和Atg5的mRNA表达变化
Real-time PCR结果显示,与0 h组比较,DTT处理BRL-3A细胞6 h后,calpain-2和Atg5的mRNA水平表达增加,且DTT处理BRL-3A细胞12 h后mRNA表达水平达到最高;DTT处理BRL-3A细胞24 h后,calpain2和Atg5的mRNA表达水平虽较12 h有所下降,但仍然明显高于 0 h组和 6 h组(P<0.05),见图4。
5 DTT 处理 BRL-3A 细胞后 calpain-2、Atg5、Atg7、Atg12及LC3的蛋白表达变化
Western blot检测结果显示,与0 h组相比,DTT处理细胞6 h、12 h和24 h后Atg12、Atg7及calpain-2蛋白表达水平逐渐升高(P<0.05),LC3的蛋白表达较0 h组明显增加,且LC3-II/LC3-I的比值也较0 h组显著增大(P<0.05),而Atg5的蛋白表达水平逐渐降低(P<0.05),见图5。
6 Co-IP检测calpain-2和Atg5的相互作用
2.0 mmol/L DTT处理BRL-3A细胞24 h后,用抗Atg5的抗体不仅能够在细胞裂解物中检测到Atg5的存在,并且也能检测到calpain-2的存在,而对照组仅能检测到Atg5的存在;用抗calpain-2抗体进行反向Co-IP发现,在DTT处理24 h的细胞裂解物中不仅能检测到calpain-2的存在,同时也能检测到Atg5的存在,而对照组仅能检测到calpain-2的存在,见图6。由此可以说明,在DTT诱导肝细胞发生ERS的过程中,calpain-2和Atg5存在相互作用关系。
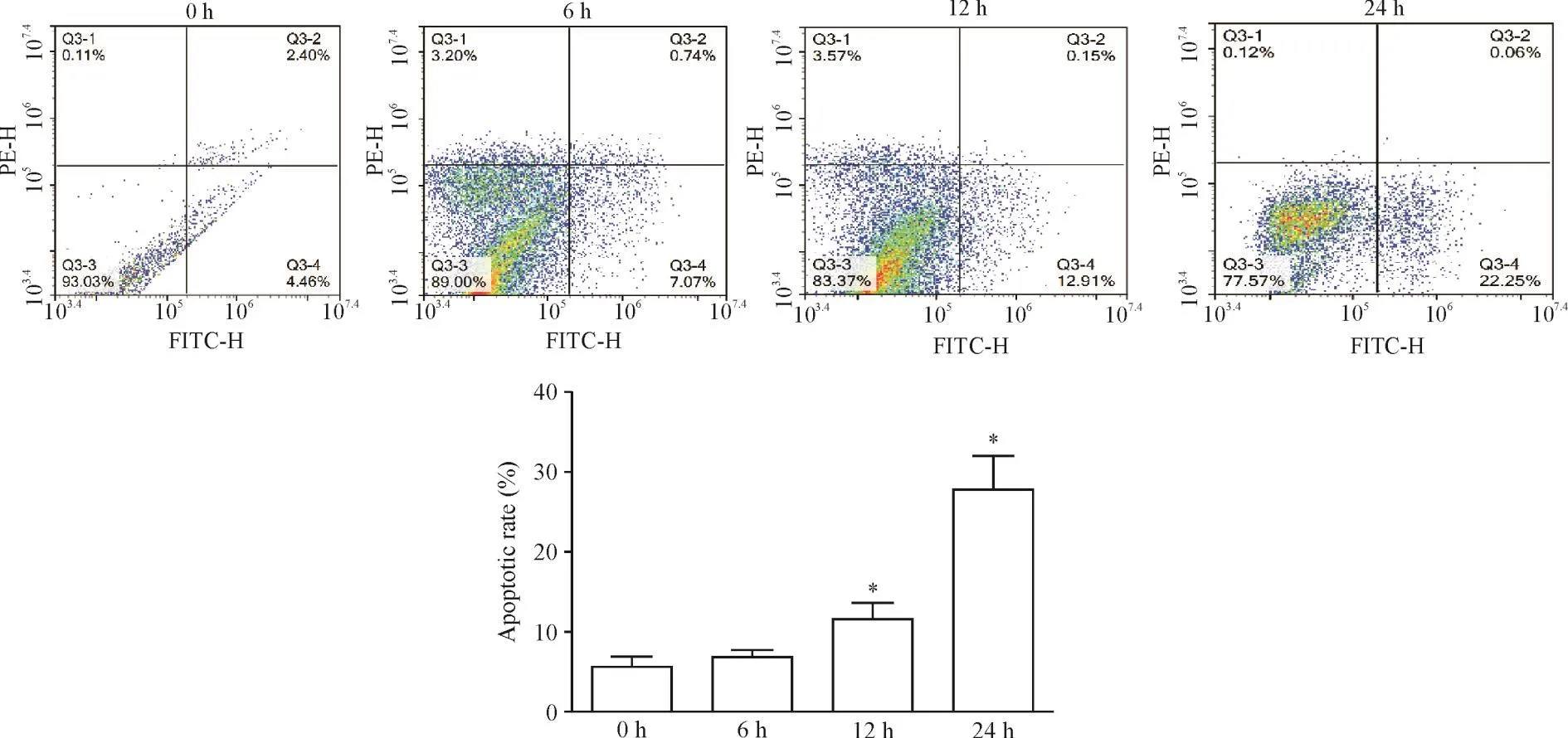
Figure 2.The effect of DTTtreatment on the apoptosis of BRL-3A.Mean±SD.n=3.*P<0.05 vs0 h group.图2 DTT处理后对BRL-3A细胞凋亡的影响
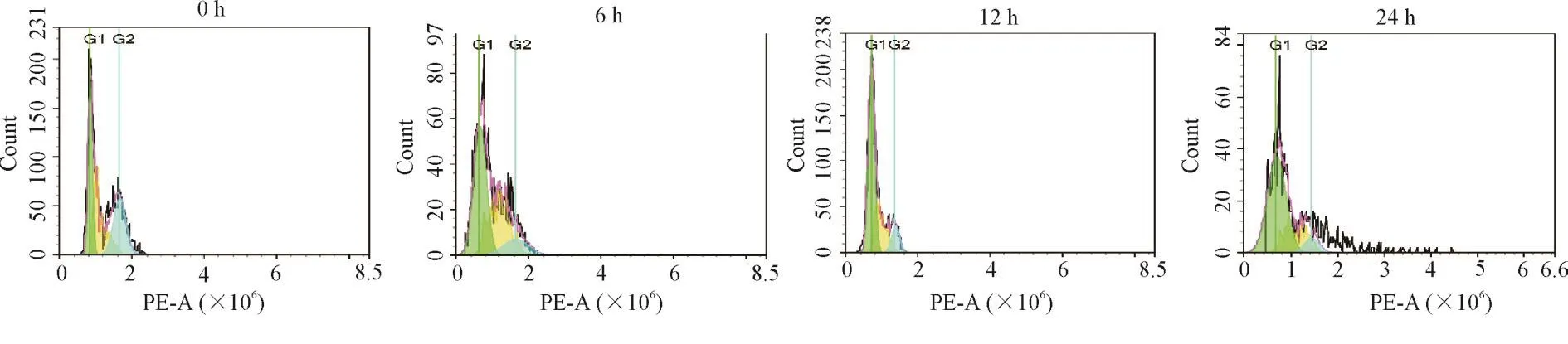
Figure 3.The effect of DTTtreatment on the cell cycle of BRL-3A cells.图3 DTT处理BRL-3A细胞后对细胞周期的影响
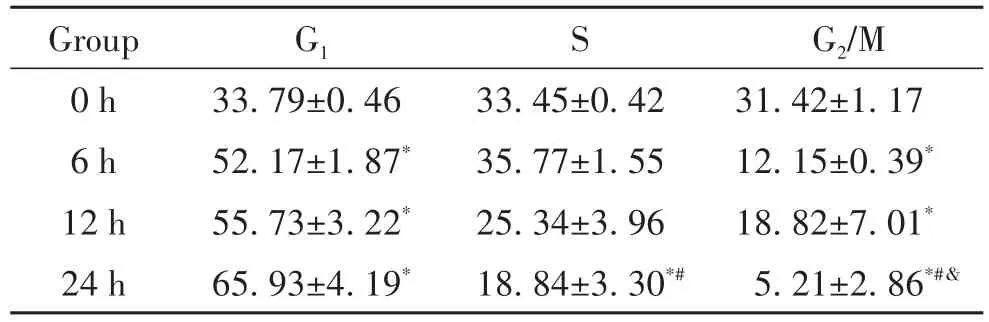
表2 DTT对BRL-3A细胞周期分布的影响Table 2.Effect of DTTtreatment on the cell cycle distribution of BRL-3A cells(%.Mean±SD.n=3)
讨 论
肝细胞凋亡是调节肝组织正常细胞更新、增殖及再生的重要机制,同时也是造成肝脏损伤以及肝脏疾病的关键环节。肝细胞凋亡过度会导致各种肝脏疾病的发生,例如肝功能衰竭、肝纤维化等。因此,深入研究肝细胞凋亡的机制对临床肝脏疾病的防治具有重要意义[8-10]。

Figure 4.The mRNA expression of calpain-2 and Atg5 after DTT stimulation.Mean±SD.n=3.*P<0.05 vs 0 h group.图4 Real-time PCR检测DTT处理细胞后calpain-2和Atg5的mRNA表达
ERS信号通路是继死亡受体通路和线粒体通路后新发现的一条细胞凋亡信号通路。ERS时,细胞通过激活未折叠蛋白反应(unfolded protein response,UPR),一方面使细胞周期停滞在G1/S期,另一方面可抑制蛋白质的合成以减轻蛋白质在内质网中的聚集;此外,还可通过激活内质网相关蛋白降解系统对内质网中聚集的蛋白质进行清除。通过上述一系列信号转导途径可以减轻或终止ERS,从而恢复细胞内环境稳态。但是ERS如果持续存在或加重,超过细胞自身代偿能力时也可诱发细胞凋亡[2,9]。

Figure 5.The protein levels of Atg5,calpain-2,Atg12,Atg7 and LC3 in the BRL-3A cells exposed to 2.0 mmol/L DTT at different time points.Mean±SD.n=3.*P<0.05 vs0 h group.图5 2.0 mmol/L DTT处理BRL-3A细胞不同时间对Atg5、calpain-2、Atg12、Atg7和LC3蛋白水平的影响

Figure 6.Co-IPdetection of the interaction between Atg5 and calpain-2 in the BRL-3A cells treated with DTT.图6 Co-IP检测DTT处理BRL-3A细胞后Atg5与calpain-2之间的相互作用
课题组前期研究发现,采用2.0 mmol/L DTT处理体外培养的肝细胞6、12和24 h后,ERS信号通路中相关信号分子GRP78、p-PERK、ATF4和CHOP的表达水平显著上调,说明2.0 mmol/L DTT处理细胞能够诱导ERS的发生[9],因此在本次实验中仍然采用2.0 mmol/L DTT处理细胞。流式细胞术检测发现,DTT处理细胞6、12和24 h后,G1期细胞较对照组(0 h组)显著增加,说明DTT处理细胞后细胞周期被阻滞在G1期。此外,Western blot检测发现,DTT处理细胞不同时间后,自噬相关指标Atg12、Atg7和LC3蛋白表达水平均较0 h组显著上调,且LC3-II/LC3-I的比值也较0 h组明显增大。由于LC3有LC3-I和LC3-II两种形式,随着自噬的发生,LC3-I与自噬泡膜表面的磷脂酰乙醇胺结合而转变为LC3-II;当自噬泡膜闭合时,只有LC3-II定位于自噬泡膜上,因此LC3-I向LC3-II的转化可作为自噬发生的标志。自噬作为真核生物细胞内除泛素-蛋白酶体降解系统外的另一种蛋白质降解系统,广泛参与了ERS时对内质网腔中聚集的蛋白质的降解过程[4]。因此,ERS时自噬水平增高可能是细胞的一种重要代偿保护机制,可在一定程度上减轻ERS,从而发挥保护肝细胞的作用[7]。上述研究结果提示,DTT诱导肝细胞发生ERS时,细胞通过启动UPR,一方面阻止细胞进入细胞周期,另一方面通过增强细胞内蛋白质降解系统(上调细胞自噬水平)对聚集在内质网中的蛋白质进行清除,以求恢复细胞稳态。但是本研究也发现,DTT处理细胞不同时间后,细胞凋亡较对照组(0 h组)显著增多,呈明显的时间依赖性,提示可能还有其他信号通路参与了对ERS的调控。
在本次研究中还观察到一个有趣的现象,当DTT诱导肝细胞发生ERS后,与Atg12、Atg7和LC3的蛋白表达变化不同,Atg5的蛋白表达水平较对照组(0 h组)显著降低。Atg5是在自噬体形成过程中发挥关键作用的蛋白质,它可与Atg12结合,形成Atg5-Atg12泛素样连接系统,再和外膜结合以促进自噬体膜的延伸,最后形成自噬体[10-14]。由此可见,Atg5在自噬过程中发挥了重要作用。为了进一步明确Atg5蛋白水平的下调是发生在转录水平还是转录后水平,我们进一步对Atg5的mRNA表达进行了检测。结果发现DTT处理细胞后,Atg5的mRNA水平较对照组(0 h组)显著升高,提示Atg5蛋白水平降低可能发生在转录后水平。
近年来有研究发现,calpain家族成员calpain-2可能参与了对Atg5转录后水平的调控[15-16]。calpain-2是细胞内的一种蛋白水解酶,可通过水解多种底物蛋白参与疾病的发生发展过程,这其中可能也包括对Atg5的水解。例如Yousefi在研究中发现,calpain-2可能通过水解Atg5,从而在转录后水平上对Atg5的表达进行调控[15]。为了证实在肝细胞中是否也存在这一调控过程,本研究进一步检测了细胞中calpain-2的mRNA及蛋白表达含量,结果发现,DTT处理细胞后,calpain-2的mRNA及蛋白表达水平均显著上调。这提示当肝细胞发生ERS时,Atg5蛋白水平的降低可能与calpain-2的表达增多有关。为证实这一猜测,我们采用Co-IP的方法对Atg5与calpain-2的相互作用关系进行了研究。结果证实,DTT处理细胞24 h后,利用calpain-2抗体能够将calpain-2蛋白及与其发生相互作用的Atg5蛋白共同沉淀下来;反之,利用Atg5抗体也能够将Atg5蛋白及与其发生相互作用的calpain-2蛋白共同沉淀下来,而在对照组则未检测到这一现象。上述研究结果提示,肝细胞发生ERS时,calpain-2蛋白与Atg5蛋白之间的确发生了相互作用,而Atg5蛋白水平的降低可能与calpain-2、Atg5之间的相互作用并对Atg5进行水解有关。由于Atg5是自噬体形成过程中的关键蛋白,其表达减少将影响自噬体的形成,导致细胞自身代偿机制不充分,从而使肝细胞走向凋亡。在后续实验中我们将进一步采用calpain-2和Atg5的免疫荧光共定位以及calpain-2抑制剂等方法来进一步验证两者之间的相互关系。

