1-磷酸鞘氨醇抑制TGF-β诱导的人脐静脉内皮细胞间充质转化*
汤石林, 彭良善, 赵正亮, 谭一清, 颜 波, 王桥生
(南华大学附属第一医院重症医学科,湖南衡阳421001)
心肌纤维化(myocardial fibrosis,MF)是各种心肌损害发展至终末阶段的共同病理特征,可诱发心律失常,心肌炎和心力衰竭,是导致心源性猝死的潜在危险因素。因此,改善或逆转MF是治疗心血管疾病的重要策略[1]。MF是肌成纤维细胞过度增殖,胶原过度沉积及异常分布所引起的病理过程。以往研究认为,肌成纤维细胞主要来源于局部组织中的成纤维细胞、上皮细胞等。新近研究表明,血管内皮细胞也是肌成纤维细胞的重要来源之一[2-3]。相关研究表明,内皮细胞可在多种因素刺激作用下逐渐失去其形态和功能,并获得间充质或肌成纤维细胞表型及其生物学特性,即发生内皮-间充质转化(endothelial-to-mesenchymal transition,End-MT)[4]。因此,深入探究内皮细胞的转化过程可为MF的治疗提供参考依据。
1-磷酸鞘氨醇(sphingosine 1-phosphate,S1P)属于鞘磷脂代谢产物,能够通过S1P受体1~5(S1Preceptor 1~5,S1PR1~5)激活下游信号通路,调节细胞生存、分化、增殖、迁移等生物学功能,或以胞内第二信使的方式发挥其调节作用。相关研究证实,S1P可通过S1PR1、S1PR3等参与调节内皮细胞增殖、迁移、分化等过程[5-6]。此外,S1P能够显著增加间充质干细胞的抗纤维化能力[7],说明S1P可能在抑制心肌纤维化过程中发挥重要的调节作用。但是,S1P抑制心肌纤维化的作用是否依赖S1PR以及End-MT是否在其中发挥功能,有待进一步探讨。
Smads家族蛋白作为转化生长因子β(transforming growth factor-β,TGF-β)受体下游重要的信号转导因子,在TGF-β诱导的End-MT经典模型中发挥重要的调节作用[8]。研究表明,在调节CD4+T细胞分化过程中,S1PR1能够抑制Smad3信号通路,进而拮抗TGF-β功能[9]。然而,S1P介导的S1PR1信号途径是否可通过调节Smad3信号通路影响TGF-β诱导的End-MT尚不明确。本研究拟通过人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)观察S1P及其受体在TGF-β诱导的End-MT中的作用,并对其机制进行初步探讨,以期为抑制心肌纤维化及其诱发的心功能不全提供参考资料。
材料和方法
1 材料与试剂
HUVECs购自ATCC。DMEM高糖培养液、胎牛血清、青霉素和链霉素购自Gibco;小鼠抗人CD31单克隆抗体、小鼠抗人VE-cadherin单克隆抗体和重组人S1P蛋白购自Abcam;小鼠抗人α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)单克隆抗体和兔抗人成纤维细胞特异性蛋白1(fibroblast-specific protein 1,FSP1)多克隆抗体购自 Sigma;兔抗人Smad3单克隆抗体和兔抗人p-Smad3抗体购自Thermo Fisher;小鼠抗人GAPDH单克隆抗体和辣根过氧化物酶标记的羊抗小鼠Ⅱ抗购自武汉博士德公司;其它试剂均为进口或国产分析纯。
2 方法
2.1 细胞培养 HUVECs用含10%胎牛血清、1×105U/L青霉素和100 mg/L链霉素的DMEM培养液,在37℃、5%CO2培养箱中静置培养。倒置显微镜观察细胞状态,当细胞融合度超过80%时,采用0.25%胰蛋白酶消化细胞、传代培养。根据实验要求,分为TGF-β(10 μg/L[10])组、TGF-β+S1P(200 nmol/L[11])组和 TGF-β+S1P+VPC23019(10 μmol/L[12];S1PR1抑制剂)组。
2.2 Western blot实验 收集细胞裂解液,并用BCA蛋白定量试剂盒进行蛋白质定量;SDS-PAGE上样缓冲液(5×)矫正蛋白浓度,煮沸 5~8 min,冷却,-20℃保存备用。采用SDS-PAGE(80 V,30 min;120 V,90 min)分离蛋白;转膜(200 mA,2 h);TBST封闭液(含5%脱脂奶粉)封闭2 h;按比例稀释CD31、VE-cadherin、α -SMA、FSP1、GAPDH 和 p-Smad3抗体,4℃孵育过夜;TBST洗3次,每次10 min;辣根过氧化物酶标记的Ⅱ抗室温孵育2 h,TBST洗3次,每次10 min;经ECL显影剂处理后,采用自动化学发光系统拍照分析。
2.3 免疫荧光染色 24孔板培养细胞,加入处理因素后,PBS浸洗3次,每次3 min;4%的多聚甲醛固定细胞30 min,PBS浸洗3次,每次3 min;0.5%Triton X-100室温通透30 min;PBS浸洗3次,每次3 min;正常山羊血清工作液室温封闭30 min;弃封闭液,I抗工作液4℃孵育过夜;PBS浸洗3次,每次3 min;荧光Ⅱ抗37℃避光孵育1 h,PBS浸洗3次,每次3 min;倒置荧光相差显微镜拍照观察。
3 统计学处理
以GraphPad Prism 6.0软件进行统计分析。所有实验数据均采用均数±标准差(mean±SD)表示,组间比较采用方差分析或t检验,以P<0.05认为差异有统计学意义。
结 果
1 S1P抑制TGF-β诱导的End-MT
Western blot检测End-MT相关标志物的表达,结果显示,与TGF-β组相比,S1P+TGF-β组内皮细胞标志物CD31和VE-cadherin表达水平显著增加(P<0.05),间充质细胞标志物α-SMA和FSP1表达水平则显著降低(P<0.05),见图1。
2 S1P通过S1PR1降低TGF-β诱导的End-MT
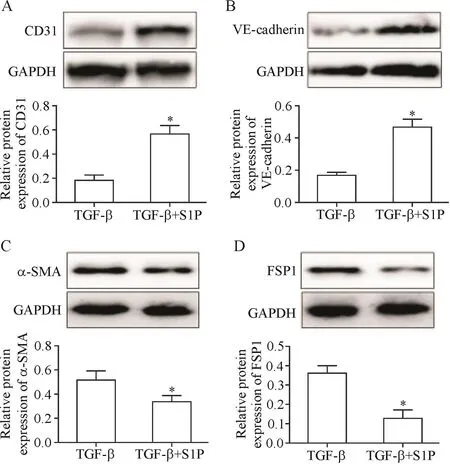
Figure 1.S1Pinhibited TGF-β-induced End-MT.The expression of CD31(A),VE-cadherin(B),α-SMA(C)and FSP1(D)was determined by Western bolt.Mean±SD.n=3.*P<0.05 vs TGF-β group.图1 S1P抑制TGF-β诱导的End-MT
为了进一步证实S1PR1在S1P抑制TGF-β诱导的End-MT中的作用,我们采用S1PR1抑制剂VPC23019处理HUVECs。结果显示,与S1P+TGF-β组相比,S1P+TGF-β+VPC23019组内皮细胞标志物CD31和VE-cadherin的表达显著降低(P<0.05),而间充质细胞标志物α-SMA和FSP1的表达显著增加(P<0.05),见图2。
3 S1PR1抑制剂VPC23019下调S1P作用下HUVECs中Smad3活性
与TGF-β处理组相比,S1P显著降低了HUVECs中Smad3的磷酸化水平,并抑制其核转位(P<0.05);而添加S1PR1抑制剂VPC23019处理后,S1P降低Smad3磷酸化及核转位的作用被逆转(P<0.05),见图3。
讨 论
End-MT能够进一步增加间充质或肌成纤维细胞,寻找调控End-MT的策略对有效控制和减轻心肌纤维化及其诱发的各类心血管疾病具有重要意义[13-14]。S1P作为细胞鞘脂类物质的代谢活性物质,其相关信号通路在调节心肌纤维化进程、内皮细胞生存及功能过程中发挥重要作用。鉴于S1P在心肌及内皮细胞中的功能,我们推测S1P可能通过介导内皮细胞表型转化参与心肌功能的调节。本实验数据表明,S1P具有抑制TGF-β诱导的HUVECs的End-MT功能,说明S1P抑制心肌纤维化的功能可能部分依赖于其对End-MT进程的抑制作用。
S1P作为胞内第二信使,可直接特异性结合组蛋白脱乙酰酶 1/2(histone deacetylases 1/2,HDAC1/HDAC2),抑制其活性,进而增强组蛋白H3乙酰化程度,促进相关基因的转录[15]。HDAC1被证实在上皮-间 充 质 转 化(epithelial-to-mesenchymal transition,EMT)过程中发挥重要调节作用[16],而 End-MT 是EMT的一种特殊类型,提示S1P介导胞内HDAC1的变化可能参与了其对End-MT的调节。S1PR1作为S1P在内皮细胞中的受体之一,是介导S1P发挥功能的关键蛋白[17]。相关研究表明,S1P受体激动剂FTY720能够通过抗炎和抗凋亡途径降低异位心脏移植后心肌纤维化水平[18]。本研究也表明,S1PR1抑制剂VPC23019能够显著逆转S1P对TGF-β诱导的End-MT的作用,说明S1P抑制TGF-β诱导的End-MT依赖S1PR1。
另外,我们利用Western blot及免疫荧光染色证实,S1P可能通过S1PR1途径降低Smad3的磷酸化水平和核转位,进而影响TGF-β诱导的End-MT进程。然而,在本研究中,我们仅观察了S1P-S1PR1轴对Smad3信号的影响,而S1P对TGF-β介导的End-MT的具体调节机制是否依赖于Smad途径,以及是否存在非Smad依赖信号途径尚不清楚。
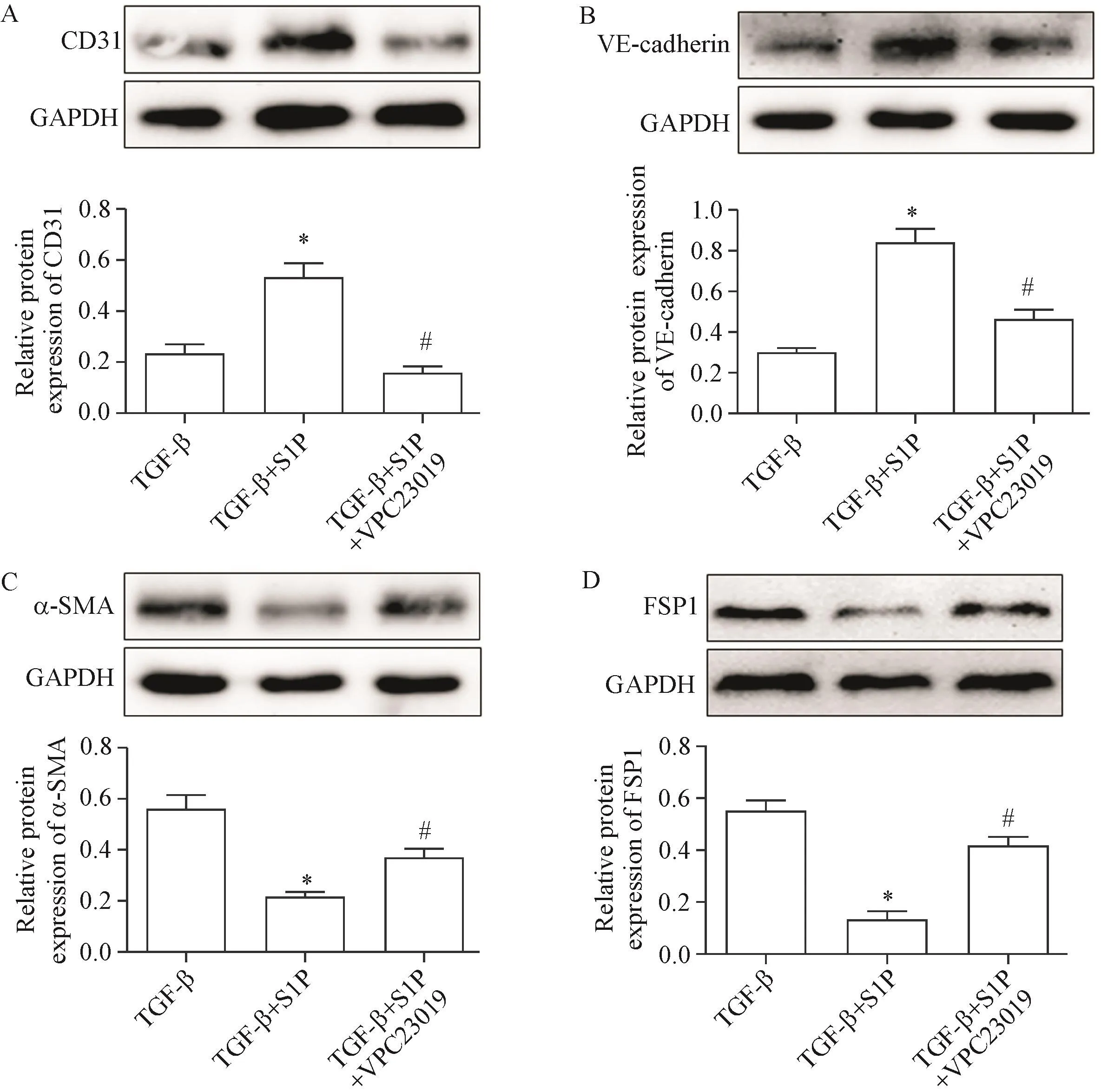
Figure 2.S1Pinhibited TGF-β-induced End-MTthrough S1PR1.The expression of CD31(A),VE-cadherin(B),α-SMA(C)and FSP1(D)was detected by Western bolt.Mean±SD.n=3.*P<0.05 vs TGF-β group;#P<0.05 vs TGF-β+S1Pgroup.图2 S1P经S1PR1途径抑制TGF-β诱导的End-MT
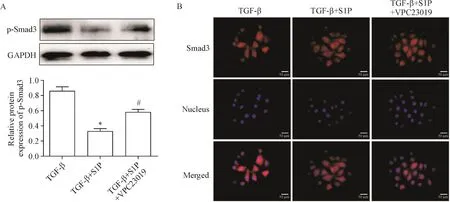
Figure 3.The effect of S1Pand S1PR1 on Smad3 signaling under the action of TGF-β.A:the phosphorylation level of Smad3 was detected by Western blot;B:the nuclear translocation of Smad3 was detected by immunofluorescence staining.Mean±SD.n=3.*P<0.05 vs TGF-β group;#P<0.05 vs TGF-β+S1Pgroup.图3 S1P及S1PR1对TGF-β作用下Smad3信号的影响
综上所述,本研究在体外证实S1P-S1PR1可抑制TGF-β诱导的HUVECs的End-MT,其机制可能与Smad3磷酸化及核转位有关。

