肝移植术后新发急性胰腺炎的诊治1 例
于婷,饶伟,潘新亭,孔心涓 (.青岛大学附属医院消化内科,山东 青岛 6600; .青岛大学附属医院器官移植中心,青岛大学移植医学研究所,山东 青岛 6600; . 青岛大学附属医院急诊ICU,山东 青岛 6600;.青岛大学附属医院消化内科, 山东 青岛 6600)
急性胰腺炎(acute pancreatitis,AP)是肝移植(liver transplantation, LT)术后较为少见的并发症之一,据报道,其发病率约为1.2% ~ 8.0%[1-5],但因肝移植受者免疫力低下,并发AP 后极易并发重度感染,病情进展迅速,增加治疗难度,且病死率可高达5.8% ~ 63.6%[1-5],因此,提高医务工作者对肝移植术后新发AP 的早期预防和积极治疗意识,对改善此类患者的预后至关重要。笔者曾成功救治肝移植术后新发AP 患者1 例,现分享其诊疗经验如下
1 临床资料
患者,男性,47 岁,因酒精性肝硬化(失代偿期)在2014 年9 月30 日在本院接受全麻下同种异体原位肝移植术,术后肝肾功能恢复顺利,痊愈出院,术后规律复查,移植物功能维持正常水平。
2018 年1 月11 日,患者因“LT 术后4 年余饮酒后持续性左上腹痛5 d”入院,追问病史,入院 前患者曾大量饮酒并进食较多高脂食物。院前化验显示:尿淀粉酶为485 U/L,血清天冬氨酸转氨酶为175 U/L,丙氨酸转氨酶为111 U/L,尿素氮为14.11 mmol/L,肌酐为290.7 μmol/L。腹部CT 提示:急性胰腺炎。收住本院后完善相关检验及检查, 提示:血淀粉酶为58 U/L,天冬氨酸转氨酶为 61.00 U/L,白蛋白为24.00 g/L,肌酐为314.80 μmol/L, 估算的肾小球滤过率为23.5 ml/min,尿素氮为16.90 mmol/L,降钙素原为2.710 ng/ml。血常规: 白细胞计数为2.58×109/L,中性粒细胞计数为1.52×109/L,血红蛋白为103 g/L,血小板水平为55×109/L。血脂:高密度脂蛋白为0.76 mmol/L,低密度脂蛋白为1.87 mmol/L。血钙为1.17 mmol/L。他克莫司血药浓度为4.5 ng/ml。上腹部CT:符合急性胰腺炎CT 表现,肝移植术后。下腹部CT:腹水。入院前服药方案:他克莫司1 mg Bid,别嘌醇片200 mg Tid,结合既往病史、临床表现及相关辅助检查结果,考虑其诊断为[6-8]:重症急性胰腺炎、急性肾衰竭、肝移植术后、腹腔积液。

监测时间 血肌酐(μmol/L) 丙氨酸转氨酶(U/L) 总胆红素(μmol/L) 他克莫司血药浓度(ng/ml)2018 年1 月12 日22837514.5 2018 年1 月18 日4520191.9 2018 年2 月5 日56791.5
入院后诊疗方案:① 抗AP 治疗,禁饮食,胃肠减压及奥曲肽(0.025 mg/h,连续静脉泵入)抑制胰液分泌,密切监测血尿淀粉酶变化;② 免疫抑制治疗:为降低患者继发感染的风险,入院后予以减低他克莫司剂量,调整为0.5 mg Bid,并密切监测肝功能及血药浓度变化(如表1);③ 抗感染治疗:入院后查血常规示三系减少,考虑骨髓抑制,且患者为肝移植术后,存在脾亢,亦不除外继发感染所致,给予美罗培南0.5g Q 8 h 抗感染及输注成分血等对症治疗,但入院第7 天,患者仍出现发热伴血象升高,根据血培养和药敏结果,将抗菌药物调整为利奈唑胺联合奥硝唑抗感染,2 周后,患者临床症状及复查血常规、炎症指标好转,故停用利奈唑胺,降级使用美洛西林钠舒巴坦钠联合奥硝唑继续抗感染维持1 周,后停用; ④ 肾功能维持治疗:考虑患者入院后存在急性肾功能衰竭,立即予以积极补液及连续性肾脏替代治疗(continuous renal replacement therapy,CRRT)清除炎症介质,后患者肾功能逐渐恢复正常水平;⑤ 营养支持治疗:静脉输注营养液,胰腺炎一期方煎服,抑酸,保肝,输血及人血白蛋白等保守治疗;⑥ 一般支持治疗:吸氧,心电监护监测生命体征,灌肠导泻,腹腔穿刺引流腹水等,密切监测肝、肾功能、电解质、 血气分析和血常规等化验变化。
经积极治疗后,患者病情逐渐缓解,无腹痛、腹胀、发热等症状,生命体征平稳,肝肾功能恢复正常,于2018 年2 月12 日痊愈出院。
2019 年1 月17 日患者再次因“进食大蒜、 山楂后出现上腹胀痛3 d”入院,复查上腹部增强CT:胰腺及周围改变,胰腺炎可能性大,肝移植术后所见,肝脏密度弥漫性减低,脾大,腹腔积液,考虑为急性胰腺炎再次发作,给予禁饮食、抗感染、抑制胰液分泌及静脉营养支持治疗后,患者未出现继发性感染,恢复顺利,并于5 d 后痊愈出院。
随访至今,患者未再饮酒,并注意清淡饮食,未再出现AP 表现,且移植物功能维持正常水平。
2 讨 论
近半个多世纪以来,随着肝移植技术的推广,术后长期存活的患者数量日益增多,其术后远期并发症也逐渐受到临床医生的关注,关于肝移植术后并发AP 时有报道,根据国内外大宗病例的回顾性分析(见表1),其中,美国匹兹堡移植研究所外科学院于1995 年报道了1 832 例LT 患 者[2],其术后AP 的发病率为3%,病死率为63.6%。 另外,在国内,天津市第一中心医院器官移植中心于2003 年报道了1 370 例LT 患者[5],其术后AP的发病率为1.2%,病死率为5.8%。由于AP 是肝移植术后一种并不罕见但又容易危及生命的并发症,但国内报道较为少见,因此,早期识别AP 和提高其预防意识对降低肝移植术后受者病死率是非常重要的。本例AP 发病急,病情危重,经积极治疗后痊愈,为肝移植术后新发AP 的诊治提供了一定的参考。
发病诱因及临床表现:结合国内外相关文献报道[9-11],目前肝移植后AP 发生诱因主要有以下几个方面:① 手术、解剖因素:胰腺和胰周的术中操作、低血压期间组织和胰腺缺血等;② 感染:乙型肝炎病毒感染、水痘-疱疹病毒感染、巨细胞病毒感染等;③ 移植后并发症:胆漏和狭窄等胆道并发症及ERCP 术后胰腺炎等;④ 药物:地塞米松、泼尼松、阿德福韦、酒精等。AP 患者典型的临床表现通常为[12]:急性的持久、激烈和难以忍受的上腹痛,常常伴有恶心、呕吐、腹胀、便秘、尿黄,严重情况下可出现呼吸困难、神经质、心悸、烦躁不安、四肢冰冷、少尿或无尿、胡言乱语、嗜睡、胃肠道出血等表现。不过本例患者的临床表现主要为腹痛,伴肾功能不全,未出现恶心、呕吐、尿黄等症。
本例患者既往因“酒精性肝硬化(失代偿期)”接受肝移植手术,术后恢复比较顺利,术后已健康存活近5 年,至此次入院前也没有出现任何严重并发症,使得其自我警惕性下降,依从性欠佳,未能坚持有效的自我饮食管理,故于1 年内连续两次因饮酒及进食高脂和辛辣等刺激性食物后出现AP,其诱因及发病病史较为明确,且具有典型的临床表现,再结合其入院前的辅助检查结果,均支持AP 的诊断。据既往报道,Marot 等[13]对11 项相关研究进行了Meta 分析,估算出因“酒精性肝硬化”接受肝移植的患者,术后再次酗酒的概率约为22%。此例受者就是1 例较为典型肝移植术后新发AP 的临床病例,笔者认为,任何1 例肝移植受者,尤其是因“酒精相关性肝脏疾病”接受肝移植者,其术前都应接受积极的AP 预防教育,强调术前戒酒及术后规律、清淡饮食的必要性和重要性,以免术后再次酗酒和/或并发AP,如术前无法戒酒且酗酒程度较重者,应慎重考虑接受肝移植。
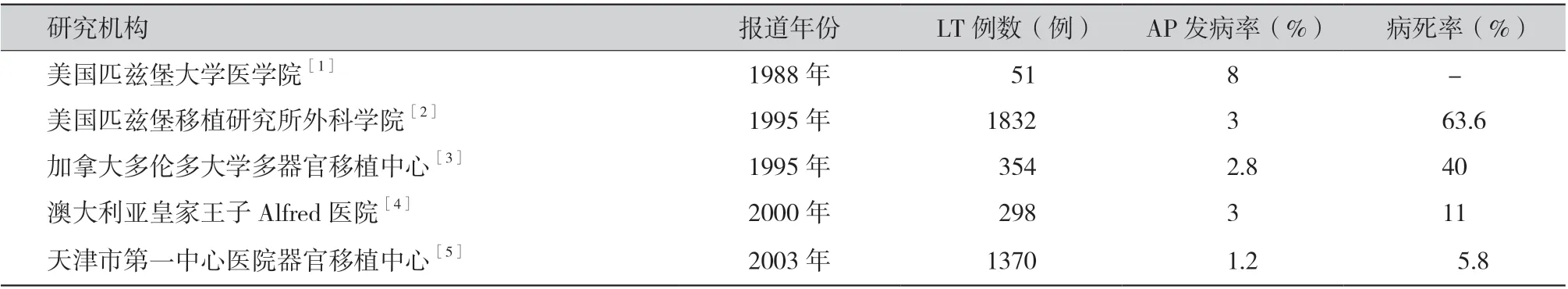
表1 国内外LT 术后并发AP 的大宗病例分析
肝移植术后AP 的治疗原则:① 抗菌药物的使用:许多免疫抑制类药物已被认为是AP 的潜在诱发因素,然而,它们是否会诱发肝移植后AP, 尚具有争议性[10]。不过,考虑到肝移植术后受者长期服用免疫抑制剂,其出现AP 时极易并发重症感染,因此,本例患者于入院后就立即接受了积极的抗感染治疗,但尽管如此,该患者仍出现了继发性感染,后经调整抗菌药物方案后,患者症状好转,同时,适当延长了抗菌药物的使用疗程,最终该患者得以痊愈且没有发生如肠道菌群失调或肝肾毒性等严重的抗菌药物相关性不良反应,由此可见, 积极有效的抗感染治疗,对肝移植术后AP 预后的良性转归是具有积极作用的,因此,在明确AP 诊断之后,临床医生应积极予以抗感染治疗,并积极进行相关培养(血液、胆汁、腹腔积液及留置导管等)行药敏试验,根据结果回报调整抗菌药物种类,并密切监测有无菌群失调或肝肾毒性等抗菌药物不良反应,必要时还需预防真菌和病毒感染。② 免疫抑制剂的调整:由于肝移植术后受者需要长期服用免疫抑制剂以预防移植物排斥反应,导致其术后机体免疫力下降,一旦出现AP,则极易导致继发性感染,但完全停用免疫抑制剂又存在诱发急性排斥反应的风险,因此,如何精确评估并监测肝移植受者的感染及免疫水平是十分重要的,但也是比较困难的。本例患者入院后出现骨髓抑制,且血培养示溶血性葡萄球菌阳性,还存在明显的肾功能损害,故在予以积极抗感染及CRRT 治疗的同时,也将他克莫司剂量减为入院前的一半,并密切监测其肝肾功能变化趋势,经积极治疗后,患者感染得以控制,且肝肾功能恢复正常水平,未出现移植物急性排斥反应,获得了较为理想的治疗效果。③ 其他积极治疗:对于肝移植术后AP 而言,除了积极抗感染及调整免疫抑制治疗方案之外,禁食水、生长抑素的使用、抑酸、维持内环境稳定及积极的营养支持等治疗手段也非常重要,考虑到患者入院时已出现急性肾功能衰竭,故予以了CRRT 等积极对症治疗,都对其预后的改善起到了一定的作用。
3 总 结
肝移植术后并发AP,其病情进展迅速,且易合 并感染、肝肾功能不全、骨髓抑制及内环境紊乱等多种并发症,较为凶险,易导致较高的病死率, 因此,肝移植临床医师应予以关注并积极防治, 同时,也希望本例肝移植术后AP 的成功救治,为大家提供一定的诊疗经验和参考。

