艾叶提取物对禽源大肠杆菌耐药性消除作用的研究
刘超怡,徐海瑛,李小妞,张人杰,关强强,陈志坚,袁浩麟
(1. 黄河科技学院,河南 郑州 450063;2. 郑州博莱特生物科技有限公司,河南 郑州 450016;3. 郑州大学第二附属医院,河南 郑州 450000)
大肠杆菌(Escherichiacoli)广泛分布于自然界,血清型有上万种之多,既是肠道的主要栖息菌又是常见的肠道病原菌。禽大肠杆菌病是指由禽致病性大肠杆菌引起的不同类型疾病的总称,主要症状包括禽类急性败血症、气囊炎、肝周炎、心包炎、关节炎、卵黄性腹膜炎等,是集约化养禽场常发的细菌性传染病,也是引起仔禽死亡的重要原因之一,对养禽产业造成较大经济损失[1]。抗生素被广泛应用于动物性疾病的治疗,长期的不合理应用使细菌的耐药性问题日趋严重。大肠杆菌是由质粒介导产生耐药性的细菌之一,可携带含有多种耐药表型的耐药质粒,并通过接合、转化、转导等方式在不同菌株之间传递,使得耐药性在细菌间快速播散,呈现出多重耐药、耐药率高、耐药范围广的特点[2]。其耐药形势越来越严峻,给疾病防治带来困难。
艾叶性温味苦、具有平喘止咳,去瘀散寒、抗毒消炎等功效。艾叶化学成分较为复杂,其主要成分为挥发油,油中含有桉油素、β-石竹烯、一萜品烯醇、芳樟醇等,此外含有黄酮类、鞣质类、多糖类等物质,研究表明,艾叶具有良好的抑菌杀菌作用[3]。本试验用艾叶的水提物和醇提物,作用于多重耐药的鸡源大肠杆菌,研究其抑菌效果,比较不同提取物对逆转大肠杆菌的作用,为中药防控禽源多重耐药菌的感染与流行奠定基础。
1 材料与方法
1.1 药物与主要试剂
艾叶,由河南省张仲景大药房股份有限公司提供;M-H(B)培养基(即水解酪蛋白肉汤培养基)、M-H(A) 培养基(即水解酪蛋白琼脂培养基)、LB琼脂,均购自北京奥博星生物技术有限责任公司;0.9% NaCl注射液,山东齐都药业有限公司;2,3,5-三苯基氯化四氮唑,国药集团化学试剂有限公司;药敏纸片由杭州微生物有限公司提供;60/90 mm平板,泰兴市万通医疗器械厂。
1.2 供试菌种
禽源大肠杆菌菌株来源于规模养禽场临床分离,已完成耐药性检测,编号DRE1、DRE2、DRE3,质控菌株大肠杆菌ATCC25922,购自中国医学菌种保藏管理中心。
1.3 供试品的制备
1.3.1 菌液制备
冷冻保存的大肠杆菌质控菌株、3株大肠杆菌分离株(DRE1、DRE2、DRE3)分别接种至平板上,37 ℃温箱培育18 h进行活化。无菌条件下取1环活化菌接种至M-H(B)肉汤,37 ℃震荡培养24 h,校正浓度至1.5×108CFU/mL,用生理盐水稀释至1.5×106CFU/mL备用。
1.3.2 药液制备
艾叶水提物的制备:称取100 g艾叶,浸泡于800 mL水中过夜,武火煎煮,待其沸腾后文火煮30 min,8层纱布滤渣,药渣加200 mL蒸馏水煮30 min,合并2次滤液浓缩至100 mL,抽滤,1 000 r/min离心10 min,取上清液[4]。110 ℃、20 min高压灭菌,置于4 ℃冰箱中备用。
艾叶醇提物的制备:按文献[5]的方法制备醇提物,合并滤液后置于蒸发皿内,加热挥发酒精至析出结晶,收集烘干,于4 ℃冰箱中备用。
1.3.3 含药平板的制备
艾叶水提物以生理盐水在试管中进行2倍梯度稀释,质量浓度依次为500、250、125、62.5、31.25 mg/mL,分别取水提物10 mL与M-H(A) 培养基10 mL混匀后倒入90 mm平板,平板中药物浓度依次为250、125、62.5、31.25、15.625 mg/mL,同时做不含药物的M-H(A)平板为空白对照。
艾叶醇提物以二甲基亚砜(DMSO)为溶剂进行梯度稀释,质量浓度依次为312.5、156.25、78.125、39.062 5、19.531 25 mg/mL,取配制好的各浓度醇提物原药液0.8 mL分别加入含9.2 mL M-H(A)培养基的试管中,混匀后倒入60 mm的平板,使药物的终浓度为25、12.5、6.25、3.125、1.562 5 mg/mL,同时做不含药物的空白对照和只含有等剂量DMSO的对照平板。
1.4 最小抑菌浓度(MIC)的测定
以琼脂稀释法进行MIC的测定,在无菌操作台中,取已制备好的4种菌液各2 μL,分别点种至含不同浓度水提物或醇提物的平板上,培养16~18 h后取出,在平板上各点种细菌处加0.5% TTC 10 μL,置于37 ℃温箱培育0.5~2 h后观察结果。点种处出现红色代谢产物表示细菌生长;细菌未生长平板中最小的药物浓度即为该药物对该种细菌的MIC。
1.5 中药耐药消除试验
以耐药株的亚抑菌浓度(即1/2 MIC)艾叶水提物及醇提物进行耐药消除试验。在无菌试管中用LB肉汤把药液浓度稀释至1/2 MIC,同时设立不加药物的空白对照组;将新鲜培养的3株临床耐药株及标准菌株稀释至106CFU/mL,取菌液100 μL分别接种至各试管内,37 ℃震荡培养,间隔12 h传代接种;传代4次后,分别取24、48、72 h各组菌液培养物20 μL,在无菌管中稀释至10-6倍,取各组菌液1 mL于90 mm的平板上,与50 ℃的LB营养琼脂混匀,待其冷却凝固后,37 ℃温箱倒置培养18 h,取出备用。
采用影印培养法,以无菌牙签挑取单个菌落分别对应点种于 LB 琼脂平板(庆大霉素100 μg/mL) 和不加抗生素的 LB 平板。耐药消除的细菌在庆大霉素LB培养基上不能生长,选取在含庆大霉素的LB平板上不生长而在无抗生素的LB平板上生长的菌落,即为消除子。对大肠杆菌耐药性消除率进行计算,消除率=耐药性消除菌落数/检测菌落总数×100%。
1.6 药物敏感试验
挑取1.5试验中的24 h培养物的消除子和未处理的原始菌株分别进行药敏试验,方法是采用美国临床实验室标准协会(CLSI)推荐的纸片扩散法。抗生素共10种,分别是庆大霉素(GEN)、环丙沙星(CIP)、阿米卡星(AMK)、氨曲南(AZN)、头孢他啶(CAZ)、头孢噻肟(CTX)、头孢吡肟(FEP)、美罗培南(MEM)、头孢西丁(FOX)、阿莫西林/克拉维酸(AMC),游标卡尺测量抑菌圈直径,每次试验重复3次取平均值,结果参照CLSI标准判读,试验均用大肠杆菌标准株ATCC25922质控。
1.7 数据统计与分析
试验数据用SPSS 18.0软件进行方差分析,检验水准α= 0.05。
2 结果与分析
2.1 艾叶提取物对大肠杆菌的MIC值
经测定,艾叶水提物对大肠杆菌ATCC25922的MIC值为31.25 mg/mL,对耐药株DRE1、DRE3的MIC值为62.50 mg/mL,耐药株DRE2的MIC值为31.25 mg/mL。艾叶醇提物对大肠杆菌ATCC25922的MIC值为6.25 mg/mL,对耐药株DRE1、DRE2、DRE3的MIC值均为12.50 mg/mL。
2.2 艾叶提取物对大肠杆菌耐药性的消除
艾叶提取物对大肠杆菌的消除率及与处理时间关系见图1。空白对照组的自然消除率<3%,艾叶醇提剂组和水提剂组消除率均高于该数值,3株耐药菌株消除率结果有较大差异,消除率最高可达28.50%,最低为4.65%;且消除率随着菌株处理时间增长而增高,但72 h培养物的消除率增幅相对平缓。

A.DRE1;B.DRE2;C.DRE3
图1 艾叶提取物对3株耐药菌的消除率与处理时间的关系
2.3 艾叶提取物作用后消除子药物敏感性试验
原始菌株和艾叶提取物作用于耐药菌DRE1、DRE2、DRE3后形成的消除子对10种抗菌药物的药敏试验结果见表1。
艾叶水提剂作用于DRE1后,消除子对AZN、FEP、MEM、FOX的抑菌圈直径平均值较原始菌株有不同程度的增大,但药物敏感程度没有改变;消除子对GEN、CIP、AMK、CAZ、CTX、AMC的药敏试验结果无变化。艾叶醇提剂作用DRE1后,消除子对MEM的抑菌圈结果增加,药敏程度由耐药恢复至敏感;消除子对GEN、AMK、AZN、FEP、FOX 的抑菌圈结果均增加,但药物敏感程度无变化;消除子对CIP、CAZ、CTX、AMC的抑菌圈结果无变化。
艾叶水提剂和醇提剂作用于DRE2后,消除子对10种抗菌药物的抑菌圈结果较原始菌株均有增加,其中对6种抗生素的药敏程度发生变化。艾叶水提剂作用DRE2后,消除子对CAZ、CTX、AMC的药敏程度由耐药恢复到中介,对GEN、AZN和FEP由耐药恢复到敏感。艾叶醇提剂作用DRE2后,消除子对AMC的药敏程度由耐药恢复到中介,对GEN、AZN、CAZ、CTX、FEP 5种抗菌药物恢复了敏感性,其中以CAZ、CTX和FEP的抑菌圈增幅最为明显。
艾叶水提剂作用于耐药大肠杆菌DRE3,消除子对CIP和AMK的抑菌圈结果较原始菌株无变化;对GEN、AZN、CAZ、CTX、FEP、ROX的抑菌圈结果均有不同程度的增大,但药物敏感程度没有改变;消除子对MEM、AMC的抑菌圈结果均有增加,且恢复了敏感性。艾叶醇提剂作用于耐药大肠杆菌DRE3后,消除子对GEN、CIP、AMK的抑菌圈结果较原始菌株无变化;消除子对其与抗菌药物的抑菌圈结果均有增加,对MEM、AMC的增幅最大,消除子对两者的药敏程度恢复至敏感。
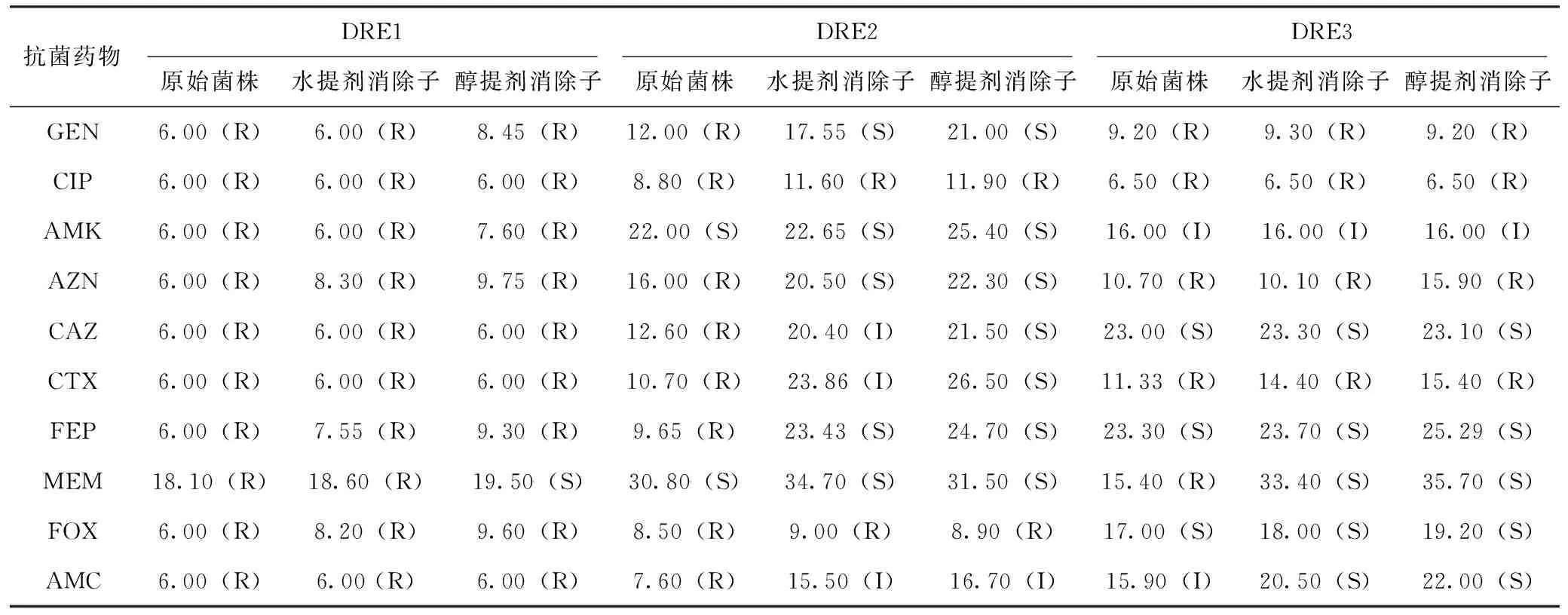
表1 原始菌株和艾叶提取物作用后的消除子对10种抗生素的药敏试验结果 mm
注:敏感(S);耐药(R);中度敏感(I)。
3 讨论
细菌耐药主要有获得性耐药和固有性耐药2个遗传途径,其中以获得性耐药为主,且危害最大[6]。获得性耐药主要通过遗传因子的转移和传播,遗传因子主要包括耐药质粒、转座子、整合子和噬菌体,它们可以通过融合、转导和转化等方式在不同致病性大肠埃希菌的遗传物质之间转移或集聚重排,引起多重耐药菌发生率大幅上升[7]。因此找到合适的消除剂,用于消除细菌耐药遗传因子,使细菌恢复对抗菌药物的敏感性,是治疗多重耐药菌的新方法。
基于清热类中药的消炎杀菌作用,将其应用于畜牧生产且部分替代抗生素,以降低细菌的耐药程度和兽药在动物体内的残留,取得了很好的效果。在此过程中发现清热类中药对细菌耐药性有一定的消除作用[8]。韦嫔等[9]通过黄连、金银花、艾叶、五倍子4种中药对猪源大肠埃希菌庆大霉素耐药性的消除试验,亚抑菌浓度下黄连、金银花、艾叶、五倍子作用24 h后对致病性大肠埃希菌庆大霉素耐药性的消除率分别7.3%、3.5%、10.9%、13.7%。张文波等[10]用艾叶水煮液可使鸡源致病性大肠杆菌耐药质粒消除率达60%,消除耐药质粒的细菌恢复了对环丙沙星、青霉素、氧氟沙星、氟哌酸、林可霉素和复方新诺明的敏感性。
在本研究中,亚抑菌浓度下艾叶水提剂作用72 h对3株大肠杆菌耐药菌株的消除率分别是4.65%、24.34%、7.58%;艾叶醇提剂作用72 h对3株大肠杆菌耐药菌株的消除率分别是5.17%、28.50%、11.83%,艾叶醇提剂的消除效果优于艾叶水提剂,这可能与不同提取方法提取物中的有效成分不同有关。艾叶提取物中挥发油是活性成分之一,主要为萜类及其含氧衍生物及少量的醛、醇、酮及芳香类化合物,目前已发现的成分接近100种,与水不相混溶,可随水蒸气蒸馏挥发[11]。艾叶提取物中的黄酮类化合物具有抗氧化、抗炎、抑菌等药效,但大部分难溶或不溶于水,而易溶于甲醇、乙醇、乙醚等有机溶剂[12]。由于提取物溶解性差异及活性成分的损耗程度不同,2种方法的提取产物在消除耐药性方面存在差异。
根据已报道过的研究中可以发现中药的消除率并不稳定,不同研究者报道的结果往往有很大的差异,可能与所用药材的采集地、制备方法或者菌株分离地、菌种等不同有关[13]。这其中尤其与菌株本身有较大关系。本研究的3株耐药菌株在前期做了超广谱β内酰胺酶群(ESBLs酶)、AmpC β内酰胺酶(AmpC酶)、碳青霉烯酶、美罗培南(MEM)外排泵等4种耐药酶的检测(尚未发表):DRE1产生 ESBLs酶、金属碳青霉烯酶、MEM 外排泵,艾叶提取物作用后,DRE1消除率最低,消除子抑菌圈增幅较小,没有对任何药物恢复敏感性;DRE2的检测结果是4种耐药酶均为阴性,艾叶提取物作用后,其消除率最高,其消除子在艾叶醇提物作用下,药物敏感性有大幅增高,对10种抗菌药物中的5种恢复了敏感性;DRE3的检测结果是ESBLs酶阳性,消除子在艾叶醇提物作用下对美罗培南、阿莫西林/棒酸恢复了敏感性。
一定程度消除耐药性的菌株,恢复了对部分抗生素的敏感性,对防控细菌感染性疾病及阻断耐药菌群的传播具有重要意义。但是菌体耐药机制复杂,药物作用与耐药谱型发生了哪些改变有待深入研究;耐药酶与菌株毒力、致病力的关系有待进一步研究;导致细菌耐药性消除的药物具体成分有待纯化研究,以此为兽医临床消除细菌耐药性、防控感染性疾病提供理论支撑。

