1株致禽霍乱多杀性巴氏杆菌的病原学与分子生物学鉴定
李伟杰,祁鑫,田野,岂晓鑫,蒋桃珍*
(1. 中国兽医药品监察所,北京 100081;2. 北京市兽药监察所,北京 102629)
禽霍乱(fowl cholera)是由多杀性巴氏杆菌(Pasteurellamultocida)引起的多种禽类的出血性败血症,是危害我国养禽业的重要细菌性传染病之一,鸡、鸭和鹅等都有易感性[1]。病禽、康复禽或健康带菌禽是本病的主要传染源,禽霍乱造成鸡的死亡损失通常发生于产蛋鸡群。本文采用细菌分离培养、16S rDNA、Biolog、荚膜分型多重PCR、脂多糖多重PCR、动物试验等方法对湖南某鸡场病死鸡体内分离的1株菌株G-2进行了病原学和分子生物学系统鉴定。
1 材料与方法
1.1 材料
1.1.1 病料
无菌采集湖南某鸡场病死鸡的肝、脾和心血等,置4 ℃冰箱待检。
1.1.2 菌种
试验参考菌株多杀性巴氏杆菌CVCC 390,荚膜A型,由中国兽医微生物菌种保藏管理中心提供。
1.1.3 培养基和试剂
胰蛋白胨大豆琼脂(TSA)购自OXOID公司,马丁肉汤购自北京中海生物科技有限公司,BUG培养基购自美国Biolog公司,马血清购自Gibco公司,革兰染色液试剂盒购自Solarbio公司,PCR相关试剂、琼脂糖购自宝生物工程(大连)有限公司。
1.1.4 实验动物
78和114日龄SPF鸡购自北京维通利华实验动物技术有限公司。
1.2 方法
1.2.1 菌株的分离及纯化
按照农业行业标准NY/T 541-2016[2],无菌采集死亡鸡的肝、脾和心血,将病料少许接种于TSB中,37 ℃培养16~24 h,用一次性接种环挑取培养物划线接种含5%鸡血清的TSA培养基,37 ℃培养16~24 h,挑取单个菌落进行纯化培养。
1.2.2 菌株的培养及观察
菌株划线接种含5%鸡血清的TSA培养基,37 ℃培养24 h,进行菌落形态及培养特性观察,用一次性接种环蘸取少量培养物进行革兰染色,观察染色特性及菌体形态。
1.2.3 菌株DNA的提取
采用热裂解法提取菌株DNA,用枪头挑取菌株TSA培养物加入到含100 μL无菌去离子水的离心管中,反复吹打,沸水浴10 min后立即放入-20 ℃冰箱冷冻5 min,然后放入高速离心机12 000 r/min 离心1 min,上清液即为PCR扩增用DNA模板。
1.2.4 菌株16S rDNA鉴定
PCR扩增用引物27F:5′-AGAGTTTGATCCTGGCTCAG-3′,1492R:5′-ACGGCTACCTTGTTACGACTT-3′。PCR反应体系(50 μL):10×Ex Buffer 5 μL,dNTP(2.5 μmol/L)4 μL,引物27F(10 μmol/L)1 μL,引物1492R(10 μmol/L)1 μL,ExTaq酶(5 U/μL)0.25 μL,DNA模板2 μL,补加无菌去离子水至50 μL。PCR扩增条件:94 ℃预变性5 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸90 s,共30个循环;最后72 ℃延伸10 min。PCR产物用1.0%琼脂糖凝胶电泳检测。PCR产物送交中美泰和生物技术(北京)有限公司进行序列测定。将序列提交到http://www.ezbiocloud.net/identify进行序列比对,用Mega 7.0软件分析序列的同源性,并构建系统发育树。
1.2.5 菌株Biolog鉴定
挑取活化的菌株TSA平板上的单菌落划线接种BUG培养基(含5%脱纤绵羊血)过夜培养,用无菌棉拭子蘸取单菌落加入到接种液A中,调整浊度至96%,用移液器将菌悬液加入Gen Ⅲ鉴定板中,每孔100 μL,放入湿盒中,置于36 ℃过夜培养后,用Biolog微生物鉴定仪读取结果。
1.2.6 菌株荚膜多重PCR分型
荚膜分型引物合成参考文献[3],多杀性巴氏杆菌A、B、D、E、F血清型特异性基因片段hyaD-hyaC、bcbD、dcbF、ecbJ、fcbD引物序列见表1。取菌株DNA 模板2 μL加入到如下50 μL反应体系中:10×ExBuffer 5 μL,dNTP(2.5 μmol/L)4 μL,上游引物(10 μmol/L)各2 μL,下游引物(10 μmol/L)各2 μL,ExTaq酶(5 U/μL)0.5 μL,补加无菌去离子水至50 μL,置于PCR仪中依照下述参数扩增:94 ℃预变性5 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸60 s,共30个循环;最后72 ℃延伸7 min,扩增PCR产物用1.5%琼脂糖凝胶电泳检测[4]。
表1 多杀性巴氏杆菌荚膜分型引物
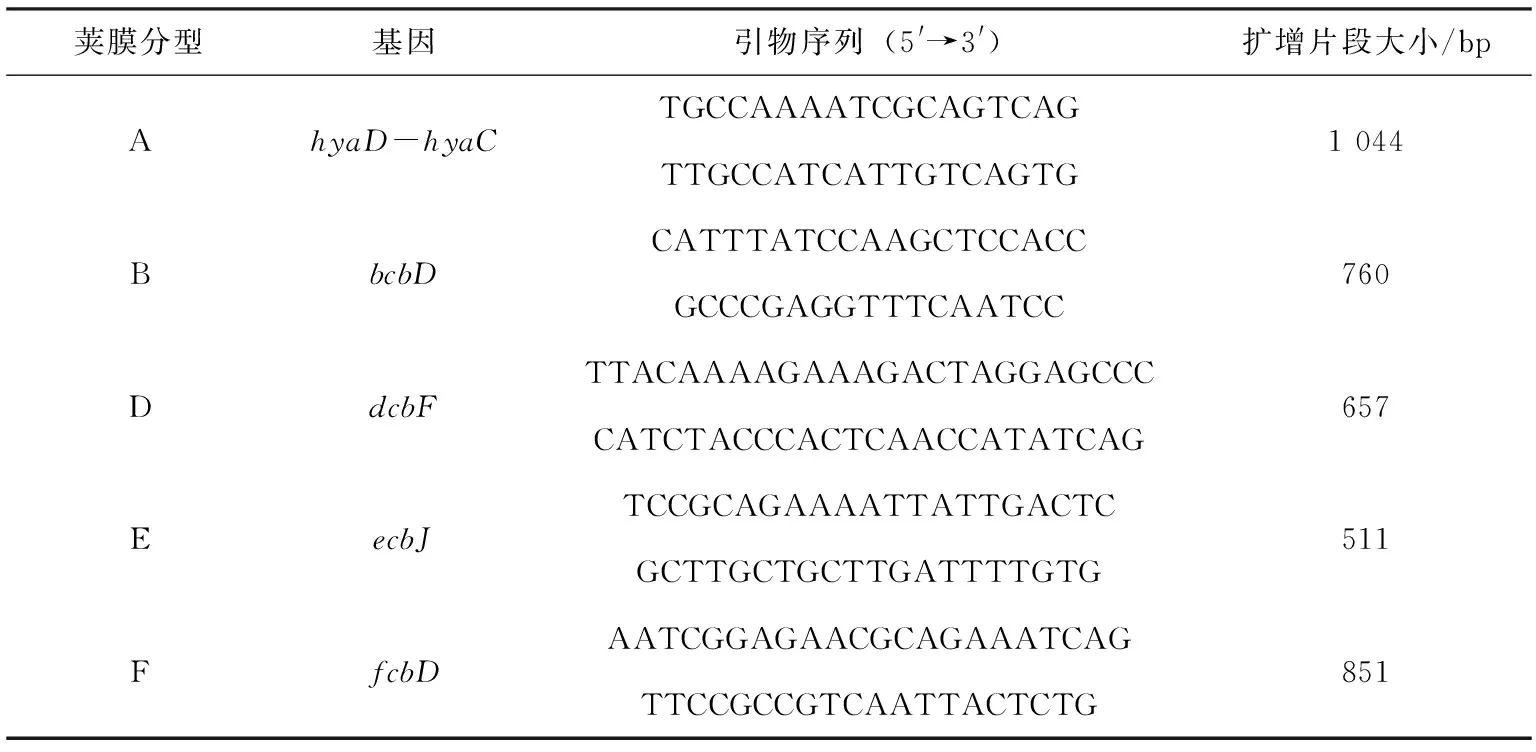
荚膜分型基因引物序列(5'→3')扩增片段大小/bpAhyaD-hyaCTGCCAAAATCGCAGTCAGTTGCCATCATTGTCAGTG1 044BbcbDCATTTATCCAAGCTCCACCGCCCGAGGTTTCAATCC760DdcbFTTACAAAAGAAAGACTAGGAGCCCCATCTACCCACTCAACCATATCAG657EecbJTCCGCAGAAAATTATTGACTCGCTTGCTGCTTGATTTTGTG511FfcbDAATCGGAGAACGCAGAAATCAGTTCCGCCGTCAATTACTCTG851
1.2.7 菌株脂多糖多重PCR分型
引物合成参考文献[5],多杀性巴氏杆菌脂多糖外核编码基因簇引物序列见表2。取菌株DNA模板2 μL加入到如下50 μL反应体系中:10×Ex Buffer 5 μL,dNTP(2.5 μmol/L)4 μL,上游引物(10 μmol/L)各2 μL,下游引物(10 μmol/L)各2 μL,ExTaq酶(5 U/μL)0.5 μL,补加无菌去离子水至50 μL。置于PCR仪中依照下述参数扩增:94 ℃预变性5 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸60 s,共30个循环;最后72 ℃延伸7 min。PCR产物用1.5%琼脂糖凝胶电泳检测。
表2 多杀性巴氏杆菌脂多糖分型引物

基因型基因引物序列(5'→3')扩增片段大小/bpL1pcgDACATTCCAGATAATACACCCGpcgBATTGGAGCACCTAGTAACCC1 307L2nctACTTAAAGTAACACTCGCTATTGCnctATTTGATTTCCCTTGGGATAGC810L3gatGTCCTTATCTGACATTGAAATCGgatGCTAGACATCTGGTGGTTGCG415L4latBTTTCCATAGATTAGCAATGCCGlatBCTTTATTTGGTCTTTATATATACC550L5rmlAAGATTGCATGGCGAAATGGCrmlCCAATCCTCGTAAGACCCCC1 175L6nctBTCTTTATAATTATACTCTCCCAAGGnctBAATGAAGGTTTAAAAGAGATAGCTGGAG668L7ppgBCCTATATTTATATCTCCTCCCCppgBCTAATATATAAACCATCCAACGC931L8natGGAGAGTTACAAAAATGATCGGCnatGTCCTGGTTCATATATAGGTAGG255
1.2.8 多位点序列分型
根据文献[6]建立的禽源多杀性巴氏杆菌RIRDC MLST 分型方法,对分离株的7个看家基因:腺苷酸环化酶基因(adk)、酯酶基因(est)、6-磷酸-甘露糖异构酶基因(pmi)、葡萄糖-6磷酸脱氢酶基因(zwf)、苹果酸脱氢酶基因(mdh)、谷氨酸脱氢酶基因(gdh)、磷酸葡萄糖异构酶基因(pgi)进行扩增及测序,引物序列见表3。所获序列经MEGA 7.0软件编辑后,提交到RIRDC MLST在线数据库进行比对(https://pubmlst.org/pmultocida/),获得菌株的序列型。
1.2.9 动物回归试验
取菌株马丁肉汤过夜培养物稀释制备菌悬液,肌肉注射78和114日龄SPF鸡,连续观察2 d,记录发病和死亡情况,并对死鸡进行细菌分离,按1.2.1~1.2.8进行鉴定。
表3 多杀性巴氏杆菌MLST的引物

基因引物序列(5'-3')扩增片段大小/bpadkTTTTTCGTCCCGTCTAAG CGGGGAAAGGGACACAAGC570estGGGGAAAGGGACACAAGCCCAAATTCTTGGTTGGTTGG641pmiTGCCTTGAGACAGGGTAAGCGCCTTAACAAGTCCCATTCG739zwf-1AATCGGTCGTTTGACTGAGCTGCTTCACCTTCAACTGTGC808mdhATTTCGGGATCAGGGTTAGCGGAAAACCGGTAATGGAAGG620gdhATCGACTTCTTCCGCAGACCGCGGGTGATATTGGTGTAGG702pgiACCACGCTATTTTTGGTTGCATGGCACAACCTCTTTCACC784
2 结果与分析
2.1 临床症状和剖检变化
发病鸡场病死率约为30%,患病鸡羽毛粗乱、精神沉郁、食欲减退、呼吸困难、腹泻、体温升高,临死前部分鸡出现发绀。随机对20只患病鸡进行剖检,20/20可见心包积有淡黄色液体并混有纤维素;19/20肺脏淤血水肿,可见散在分布的针尖状灰白色坏死点,表面有大量白色渗出物,呈肺炎症状;16/20肝脏肿大,呈棕红色,表面分布针尖大小灰白色、边缘整齐、大小一致的坏死点;20/20十二指肠出血。
2.2 菌落形态及培养特性
按照农业行业标准NY/T 541-2016,从患病鸡体内分离获得1株纯培养物,命名为G-2株。菌株G-2在TSA培养基上形成边缘圆润整齐,表面光滑,乳白色半透明菌落。革兰染色为阴性球杆菌。
2.3 16S rDNA鉴定
菌株16S rDNA PCR扩增产物经电泳检测,大小约为1 500 bp(图1)。将16S rDNA序列提交到http://www.ezbiocloud.net/identify进行比对,结果与多杀性巴氏杆菌杀禽亚种模式菌株NCTC10204的相似性最高,为100.00%;与多杀性巴氏杆菌多杀亚种模式菌株ATCC 43137的相似性为99.93;与多杀性巴氏杆菌败血亚种模式菌株NCTC 11995的相似性为98.56%。选取相似性大于97%的菌株16S rDNA序列,用Mega 7.0构建系统发育树(NJ法),以猫嗜血杆菌ATCC 49733为外源,菌株G-2与多杀性巴氏杆菌杀禽亚种NCTC 10204在同一分支(图2)。
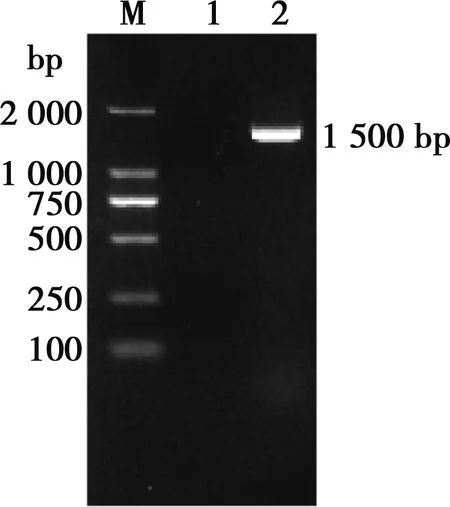
M.DL2000 DNA Maker;1. 阴性对照;2. 菌株G-2
图1 菌株G-2 16S rDNA PCR产物电泳结果
2.4 Biolog鉴定
菌株培养18 h后,通过Biolog鉴定仪读取结果,菌株G-2与多杀性巴氏杆菌杀禽亚种具有良好的匹配性,可能性为0.899,相似性为0.722,位距为3.451,鉴定结果为多杀性巴氏杆菌杀禽亚种。
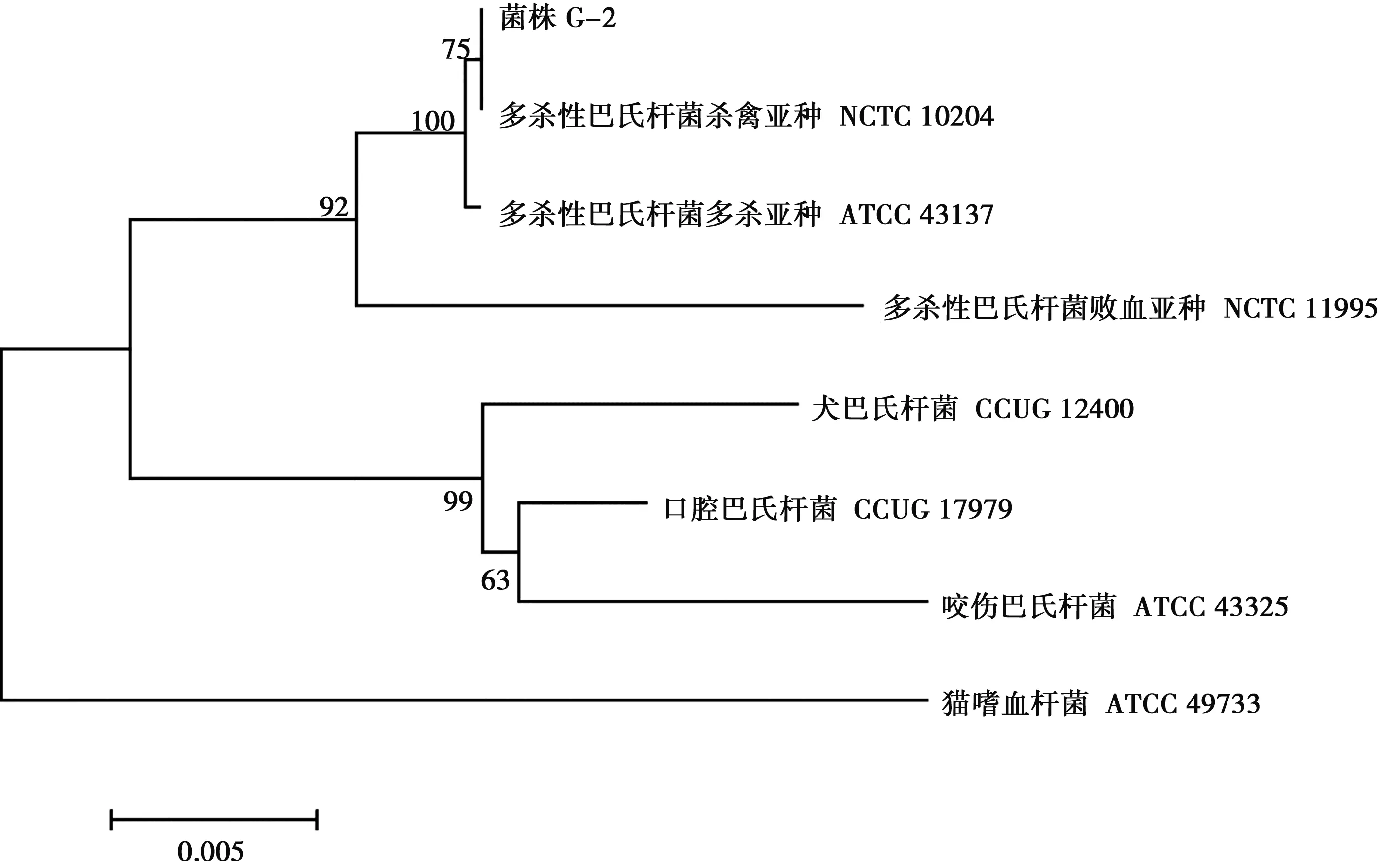
图2 菌株G-2 16S rDNA系统发育树
2.5 荚膜分型
菌株G-2扩增出了与阳性对照CVCC 390大小一致的片段,约为1 044 bp(图3),为多杀性巴氏杆菌荚膜A型特异性片段,判定菌株G-2为荚膜A型。
2.6 脂多糖多重PCR
菌株G-2扩增出1 307 bp左右的片段(图4),为脂多糖L1型特异性片段,判定菌株为脂多糖L1型。
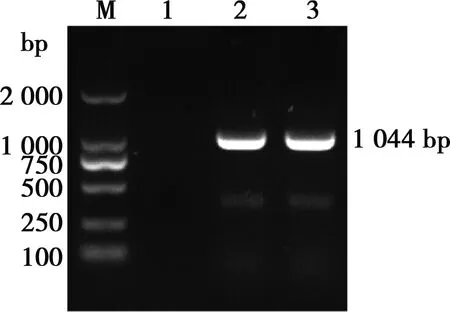
M. DL2000 Maker;1. 阴性对照;2. 阳性对照CVCC 390;3. G-2
图3 菌株G-2荚膜分型PCR产物电泳结果
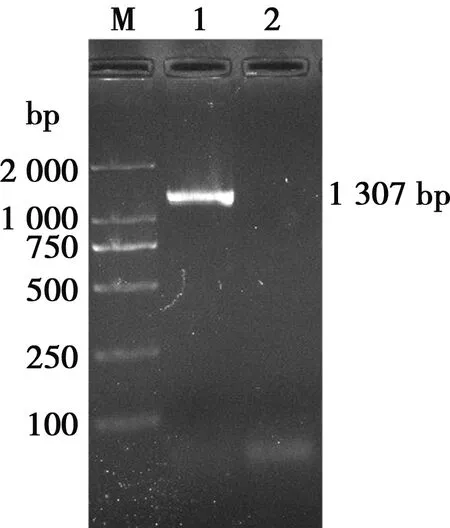
M. DL2000 Maker;1. G-2; 2. 阴性对照
图4 菌株G-2脂多糖多重PCR产物电泳结果
2.7 MLST分型
对多杀性巴氏杆菌G-2株分别进行adk、est、pmi、zwf、mdh、gdh和pgi7个看家基因的扩增和测序,将序列在线提交到RIRDC MLST数据库进行比对,得到各个基因的等位基因编号,所有等位基因的编号组成菌株的序列型,结果显示G-2株为ST129型。
2.8 动物回归试验
将菌株TSB过夜培养物稀释成不同的浓度,肌肉注射78日龄和114日龄SPF鸡,每个稀释度注射2只,连续观察2 d。动物回归试验结果表明:78日龄SPF鸡注射7、10、13、17和20个CFU在1 d内引起全部鸡死亡,114日龄SPF鸡注射10、13和17个CFU在2 d内引起全部鸡死亡;临床症状表现为羽毛粗乱、精神沉郁、厌食、呼吸困难、腹泻、发热,临死前部分鸡出现发绀。剖检死亡鸡发现心包积液、肺肿病变、肝脏坏死点、十二指肠出血,采集死亡鸡只的肝脏和心血进行分离,获得菌落形态一致的菌株,经鉴定为多杀性巴氏杆菌杀禽亚种。
3 讨论
禽霍乱是由多杀性巴氏杆菌引起的鸡和火鸡等禽类的一种接触性传染病,多为散发,3~4月龄育成鸡、成年鸡易发。禽霍乱造成成鸡的死亡通常发生于产蛋鸡群,其发病率和死亡率高,给养禽业的发展和公共卫生造成严重威胁[7]。为避免经济损失,疫苗预防接种是比较经济安全的方式。同时养禽场应建立必要的饲养管理和卫生防疫制度,特别是在引种时要严格检疫,防止疫病的传入。一旦发生疫情,应及时采取隔离、消毒等防治措施。
本研究对从湖南禽霍乱鸡体内分离到的1株病原菌,通过菌落形态、染色特性、16S rDNA 和Biolog鉴定,确认该菌株为多杀性巴氏杆菌杀禽亚种。采用荚膜多重PCR分型、脂多糖多重PCR分型和多位点序列分型对其基因型进行了鉴定,该菌株为荚膜A型、脂多糖L1型、ST129型。这与文献报道的结果一致[8-10]。目前我国禽源多杀性巴氏杆菌的荚膜型以A型为主,多位点序列分型以ST129型为主。动物回归试验证实该菌株能引起SPF鸡典型的禽霍乱症状,肌肉注射7 CFU活菌可致死78日龄SPF鸡,10 CFU活菌可致死114日龄SPF鸡。结合临床症状和剖检变化,可以确诊为禽霍乱。该疫病的准确和快速确诊,可以为后续预防提供技术依据,同时为养殖场制定免疫程序提供参考。

