猪SIRT5基因外显子区多态性研究
张雄,史开志*,陈大军,张勇,杨红,王天松
(1. 贵州省农业科学院畜牧兽医研究所,贵州 贵阳 550005;2. 赫章九龙农业旅游开发有限公司,贵州 赫章 553200;3. 贵州大学动物科学学院,贵州 贵阳 550025;4. 毕节市畜禽遗传资源管理站,贵州 毕节 551700)
沉默信息调节因子(sirtuins)是一类动态调节细胞生理的进化保守酶。哺乳动物有7种SIRT(SIRT 1~7),它们位于不同的细胞间且具有不同的功能[1-3]。SIRT5属于一种位于多个亚细胞位点的Sirtuin异构体,具有多种酶活性,包括依赖NAD的组蛋白去乙酰化酶、赖氨酸脱钙酶等,这些酶活性表明SIRT5在糖酵解、三羧酸循环和脂肪酸氧化等多种细胞代谢过程中起着重要作用[4-6]。
王利红等[7]研究发现SIRT5基因在苏姜猪各组织中广泛表达,且在胃、肠等物质能量代谢旺盛的组织表达量较高。Rardin等[8]指出SIRT5在小鼠近端肾小管上皮细胞中调节线粒体与过氧化物酶体脂肪酸氧化的平衡。桂林生[9]对秦川牛SIRT5基因进行SNP检测,在第7内含子区域发现4个SNP位点,其中G22010A 和G22052A位点基因型与秦川牛背膘厚和眼肌面积显著关联,优势基因型分别为GG和GA。
鉴于SIRT5基因在动物脂质代谢途径中调节作用,且在国内地方猪分子多态性研究中鲜有报道。本试验以4个猪资源群体作为为试验对象,利用DNA混池结合PCR产物直接测序法,系统分析SIRT5基因外显子区域多态位点,为今后挖掘与性状表型值关联的特征标记奠定基础。
1 材料与方法
1.1 试验样品采集
从江香猪育肥猪66份血样采自贵阳市绿生源香猪生态福利养殖场;黔北黑猪♀×巴克夏♂F1代杂交猪60份血样采自贵州自然之园生态农业高坡养殖基地;夜郎黄金猪(可乐猪♀×野猪♂)34份血样采自赫章九龙农业旅游有限公司养殖基地;大约克猪47份血样采自贵阳市台农种猪养殖基地。以上猪血样均采用上海生工生物工程(上海)股份有限公司生产的Ezup柱式基因组DNA抽提试剂盒(血液)提取其基因组DNA,于-20 ℃保存备用。
1.2 主要试剂
琼脂糖、2×TaqMaster Mixture、核酸染料、DL 2000-Marker均购自生工生物工程(上海)股份有限公司。
1.3 引物设计与合成
参考猪SIRT5基因全序列(登录号:NC_010449.5),采用Primer Premier 5.0设计SIRT5基因外显子区扩增引物,送生工生物工程(上海)股份有限公司合成,引物详见表1。
表1 引物序列信息
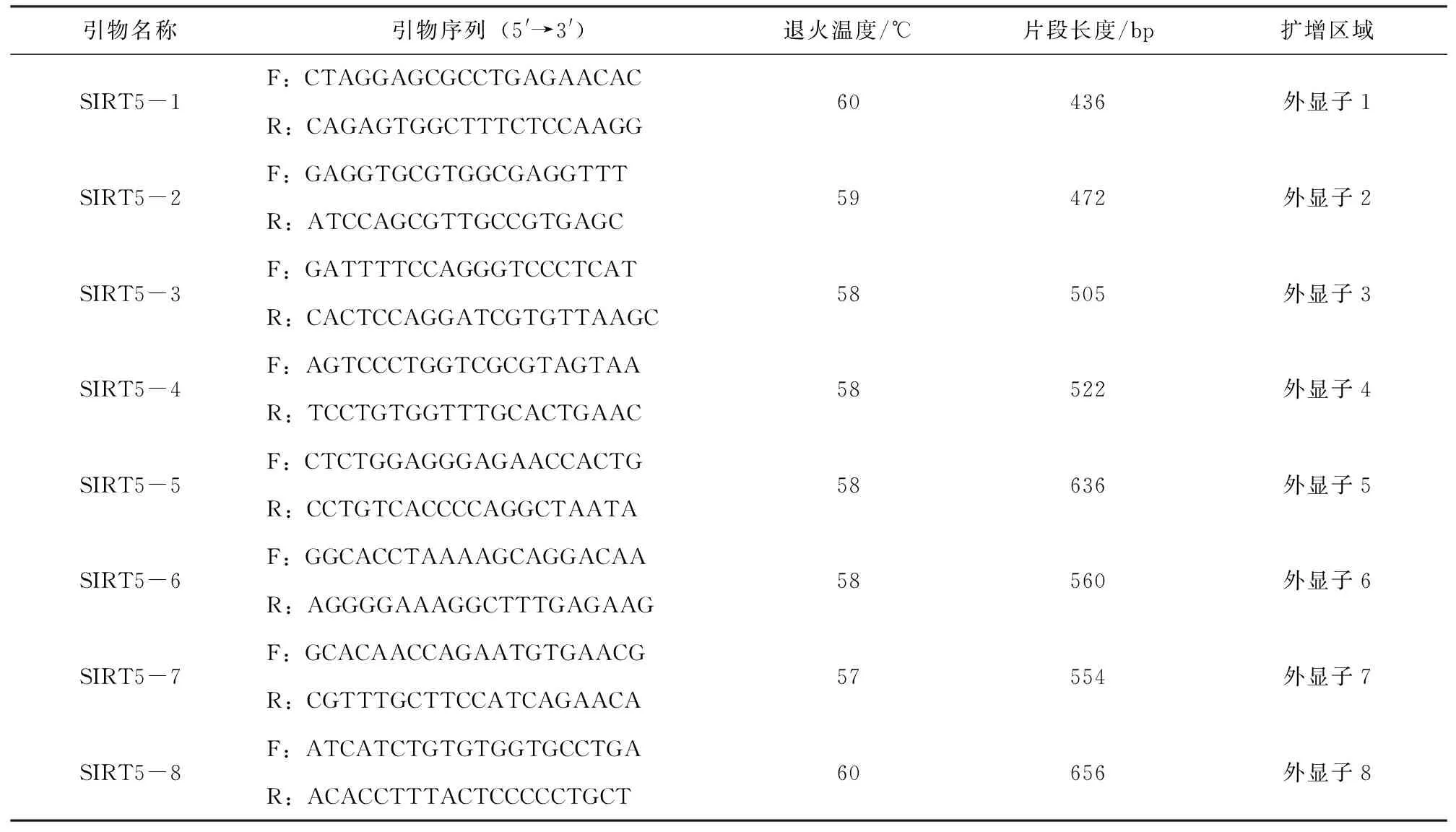
引物名称引物序列(5'→3')退火温度/℃片段长度/bp扩增区域SIRT5-1F:CTAGGAGCGCCTGAGAACACR:CAGAGTGGCTTTCTCCAAGG60436外显子1SIRT5-2F:GAGGTGCGTGGCGAGGTTTR:ATCCAGCGTTGCCGTGAGC59472外显子2SIRT5-3F:GATTTTCCAGGGTCCCTCATR:CACTCCAGGATCGTGTTAAGC58505外显子3SIRT5-4F:AGTCCCTGGTCGCGTAGTAAR:TCCTGTGGTTTGCACTGAAC58522外显子4SIRT5-5F:CTCTGGAGGGAGAACCACTGR:CCTGTCACCCCAGGCTAATA58636外显子5SIRT5-6F:GGCACCTAAAAGCAGGACAAR:AGGGGAAAGGCTTTGAGAAG58560外显子6SIRT5-7F:GCACAACCAGAATGTGAACGR:CGTTTGCTTCCATCAGAACA57554外显子7SIRT5-8F:ATCATCTGTGTGGTGCCTGAR:ACACCTTTACTCCCCCTGCT60656外显子8
1.4 PCR扩增反应
PCR扩增采用25 μL反应体系,反应体系如下:2×EsTaqMasterMix 12.5 μL,ddH2O 8.5 μL,上下游引物各1 μL(10 μmol/L),模板DNA 2 μL(20 ng/μL)。反应条件为:94 ℃预变性2 min;94 ℃变性30 s,退火30 s(温度见表1),72 ℃延伸30 s,35个循环;72 ℃终延伸2 min。PCR扩增产物4 ℃保存,经1.2%琼脂糖凝胶电泳检测,挑选特异性好的PCR产物送生工生物工程(上海)股份有限公司测序。
1.5 变异位点筛选及等位基因频率估算
猪SIRT5基因原序列与测序峰图运用Megalign和Seqman软件进行序列比对分析,确定SNPs位点。使用MWsnap 3.0软件测量各SNPs等位基因的相应高度,等位基因频率计算公式如下:Fi=Hi/(H1+H2)(i=1,2)。式中:Fi表示 SNP位点等位基因频率,H1、H2表示等位基因在测序峰图上的高度。
1.6 mRNA二级结构分析
采用在线生物信息学分析软件RNAfold WebServer对猪SIRT5基因突变前后的mRNA二级结构进行预测分析。
2 结果与分析
2.1 DNA提取与PCR扩增
用1.2%琼脂糖凝胶电泳检测SIRT5基因第1~8外显子PCR扩增产物,结果见图1。由图可知,PCR扩增产物与目的片段大小一致,特异性良好,达到测序标准。
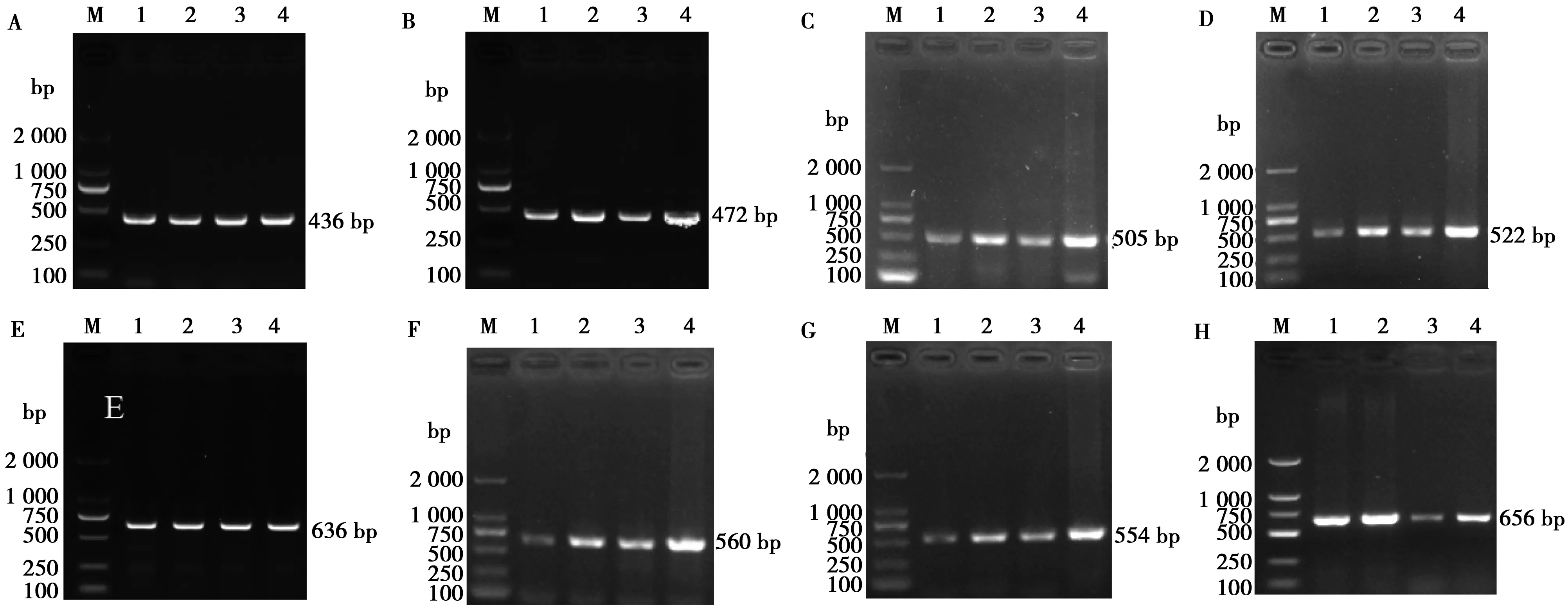
A.第1外显子;B. 第2外显子;C. 第3外显子;D. 第4外显子;E. 第5外显子;F. 第6外显子;G. 第7外显子;H. 第8外显子
M.DL2000 Marker;1.从江香猪;2.黔北黑猪♀×巴克夏♂F1代杂交猪;3.夜郎黄金猪;4.大约克猪
图1 猪SIRT5基因外显子区PCR扩增产物电泳检测
2.2 序列比对与SNP位点挖掘
将PCR扩增产物进行测序,应用DNAStar软件中Seqman程序将测序结果与NCBI中公布杜洛克猪SIRT5基因进行序列比对,在猪SIRT5基因外显子区挖掘得到3个SNPs位点(见图2)。参照猪SIRT5基因mRNA完整序列,以第1个转录起始位点+1,分别将3个变异位点命名为:G515A、C831T和A882G。其中,G515A位于第4外显子区,为错义突变位点,可导致第170位氨基酸发生改变,由甘氨酸改变为谷氨酸;C831T和A882G位点分别位于第7和第8外显子区,均为同义突变位点。
2.3 等位基因频率估算
通过MWsnap 3.0软件标尺对4个猪群体的3个SNPs位点峰高进行测量,并根据等位基因频率计算公式进行频率估算,结果见表2。从表中可见,G515A位点中,仅在黔北黑猪♀×巴克夏♂F1代杂交猪出现较高的多态性,G和A预测等位基因频率值相近,而在从江香猪、夜郎黄金猪和大约克猪种中均呈现出单峰,为偏态分布;C831T位点中,从江香猪和夜郎黄金猪中以C预测等位基因频率值较高,且在从江香猪群体中C和T频率值相近,多态含量丰富,在大约克猪和黔北黑猪♀×巴克夏♂F1代杂交猪以T预测等位基因频率值高;A882G位点中预测频率值分布呈现出从江香猪多态丰富,大约克猪偏态分布。
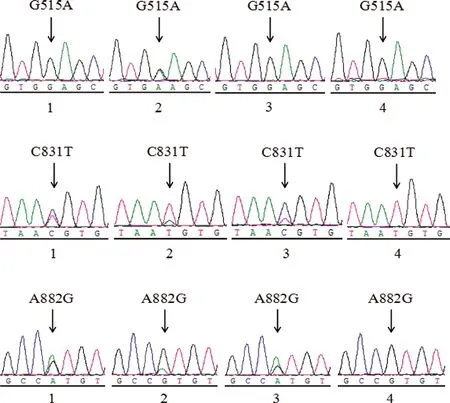
1.从江香猪;2.黔北黑猪♀×巴克夏♂F1代杂交猪;3.夜郎黄金猪;4.大约克猪
图2 不同品种猪SIRT5基因3个SNPs位点测序比对峰图
表2 等位基因频率估算结果

SNPs所处位置从江香猪黔北黑猪♀×巴克夏♂F1代杂交猪夜郎黄金猪大约克猪G515A第4外显子G(1)G(0.49)G(1)G(1)A(0)A(0.51)A(0)A(0)C831T第7外显子C(0.56)C(0.19)C(0.77)C(0)T(0.44)T(0.81)T(0.23)T(1)A882G第8外显子A(0.53)A(0.22)A(0.62)A(0)G(0.47)G(0.78)G(0.38)G(1)
2.4 mRNA二级结构预测
猪SIRT5基因突变前后mRNA二级结构预测结果发现,C831T和A882G位点突变前后均不导致mRNA二级结构发生改变,而G515A位点突变后,猪SIRT5基因mRNA最小自由能由-358.2 kcal/mol变为-359.0 kcal/mol,突变后,自由能值每摩尔降低了0.8 kcal,RNA稳定性提高。
3 讨论
本试验通过直接测序法在4个猪资源群体中共筛选到SIRT5基因的3个变异位点,分别为G515A、C831T和A882G,其中G515A属于错义突变,可导致甘氨酸(脂肪族类)改变为谷氨酸(酸性氨基酸类)。毛圆辉[10]分析基因mRNA二级结构稳定性在翻译过程中的功能,发现mRNA可通过二级结构稳定性的变化调节翻译过程,形式较为复杂,但最终表现为对蛋白质表达量显著正相关调控,且这种正相关不受mRNA结构、丰度等其它因素的影响。本研究中,G515A位点可降低猪SIRT5基因mRNA最小自由能值,提升mRNA二级结构稳定性,鉴于mRNA二级结构稳定性与蛋白质表达量正相关关系,进一步推测G515A位点突变后,可大幅提高SIRT5蛋白表达水平,加快猪体内脂质代谢进程,实现皮下脂肪快速沉积。同时,该变异位点仅在黔北黑猪♀×巴克夏♂F1代杂交猪群体中出现高频率的多态分布,而在从江香猪、夜郎黄金猪和大约克猪群体中均无多态性分布,推测猪SIRT5基因G515A位点具有极高偏向性与品种相关性,或许仅在巴克夏或贵州黔北黑猪群体中存在突变,可将其作为猪特有的分子标签加以开发利用。
本试验还发现,C831T和A882G 2个SNPs位点在从江香猪资源群体中多态信息含量丰富,变异丰度高,而在大约克猪中呈现偏态分布。出现该现象可能是由于猪种的不同、生存地理环境的差异,导致基因在配子中的随机分离和在合子里的随机重组出现一定偏差,引起基因频率的变化,最终导致等位基因频率差异化,形成不同的表型性状[11]。同时,根据研究发现的从江香猪群体中C831T和A882G位点变异程度大、多态含量丰富的特点,便于群体中有利基因型的定向选择,其在今后的分子选育工作中获得更大遗传进展及作为育种标记的潜力更大[12]。邓冠群[13]在秦川牛SIRT5基因3′UTR处挖掘出4个SNP,且突变位点的不同基因型对部分体尺和肌间脂肪指标影响显著。Shuai等[14]研究阐述了SIRT5对皮肤下白色脂肪组织中的棕色脂肪细胞分化具有调节作用,且是棕色脂肪基因体外激活所必须的。结合SIRT5基因定位以及在脂质代谢中的重要功能,后期课题组将开展猪SIRT5基因SNPs位点与胴体肉质性状的关联分析,验证G515A、C831T和A882G位点与地方猪背膘厚及瘦肉率指标间的相关性,发掘出可调节地方猪脂肪沉积的关键变异位点。
———从江加车村

