微流控电阻抗检测系统构建及其应用
张思祥, 竭 霞, 胡雪迎, 李 默, 张英杰, 周 围*
(河北工业大学, 天津 300130)
凝血时间是指血液离开血管,在体外发生凝固的时间。凝血时间检测是术前评估,肝或肾脏疾病检测,传染性疾病监测和接受抗凝治疗的患者需要进行的必要检测项目[1 - 3]。当代血凝仪采用的检测方法主要是光学法和磁珠法,这两种方法容易受到血液颜色变化和血液粘度变化的影响,例如黄疸、脂血、乳糜血或不同年龄段血液黏度的差异等都会使检测结果产生较大误差。随着微流控技术不断发展成熟,微流控芯片已成为一个集样品制备、反应、分离、检测等功能于一体的小型分析实验平台[4],利用微流控芯片进行的血液相关研究也越来越多[5],如血细胞监测分析[6]、血浆分离[7 - 9]、血液流变性质分析[10]、血液成分检测[11]等。Cakmak等提出一种基于MEMS的传感器阵列平台,可在一次性微流控盒中实现血浆的多次凝固时间测试,用于实时进行凝血时间(活化部分凝血活酶时间(APTT)和凝血酶原时间(PT))的测试[12]。Lim等提出了一种检测透射光强度的新型血液凝固检测方法,同时可以监测纤维蛋白的形成[13]。Loukas等提出使用四极阻抗法监测血浆中锂离子浓度变化,成功实现了锂离子浓度的快速稳定的监测[14]。
本研究在分析传统凝血时间检测原理与方法的基础上,针对目前凝血时间检测仪存在的问题,结合微流体技术的发展状况,提出微流控电阻抗检测系统进行凝血时间检测。对微流控芯片上的电极进行实时测量,记录血液凝固过程中溶液阻抗值的变化,建立凝血过程阻抗值变化与时间的关系曲线,计算出凝血时间,为实现检测系统的微型化和便携化提供新思路。
1 实验部分
1.1 仪器及试剂
保定兰格品牌双通道微注射泵,瑞士苏黎世HF2IS多频电阻抗分析仪,SVM340倒置显微镜,HF2TA跨阻放大器。医用真空采血管抽取的健康成人静脉血,轻摇抗凝后,经3 600 r/min离心10 min后获得的血浆,西门子凝血试剂活化部分凝血活酶Actin试剂,0.025 mol/L的CaCl2溶液。
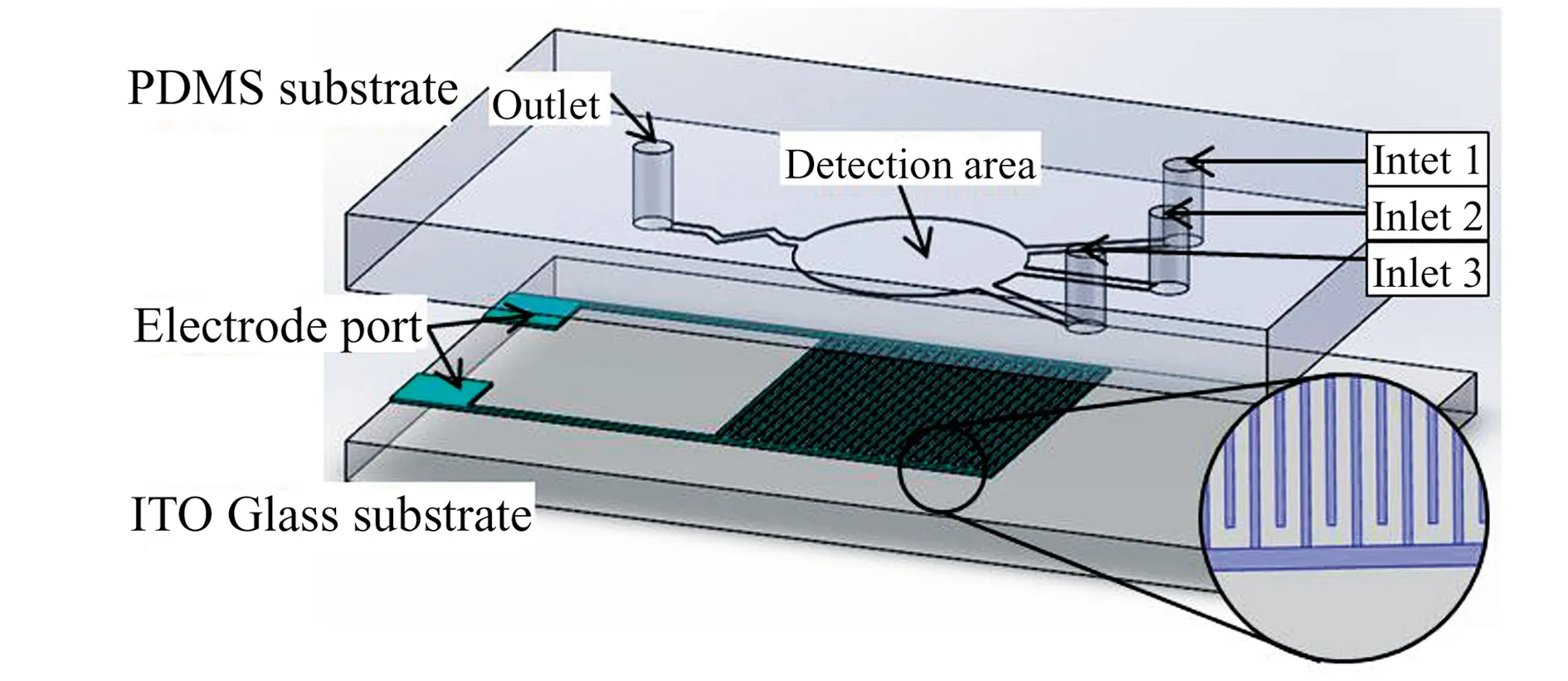
图1 用于凝血时间检测的微流控芯片示意图Fig.1 Schematic diagram of microfluidic chip for clotting time detectionInlet 1 is the inlet of Actin solution,inlet 2 is the plasma inlet,inlet 3 is the inlet of calcium chloride solution,and outlet is the outlet of waste liquid.
1.2 微流控芯片的设计制作
用于凝血时间检测的微流控芯片示意图如图1所示,由带有阵列叉指电极的下玻璃电极基板和带有微流体通道的PDMS上基板两部分组成。下玻璃电极基板采用ITO玻璃进行刻蚀,玻璃底片尺寸为25 mm×15 mm×1.1 mm,电极基板的反映区域设计为叉指电极结构,叉指电极指针长8 000 μm,叉指间距为200 μm,叉指宽度为100 μm,叉指对数为13对。
上基板为PDMS基板,主要包括待测样本入口和所需试剂入口以及检测区域,入口尺寸略小于微注射进样管尺寸,将进样管与芯片装配后,产生弹性压力,从而获得紧固的效果。检测区域高度为40 μm,近似容量为6 μL。PDMS基板应用软刻蚀制作工艺[15],以载玻片作为微流控芯片基底,按照清洗基底、压膜、曝光、显影、PDMS浇注固化、坚膜、键合等顺序加工制作PDMS基板后与玻璃基底进行等离子键合,得到实验所需微流控芯片。
2 结果与讨论
2.1 实验原理
血液凝固过程主要分为3个阶段:第一阶段凝血酶原激活物形成,用于激活血液中的凝血酶原;第二阶段凝血酶形成,凝血酶原在凝血酶原激活物的催化作用下,发生反应成为有活性的凝血酶;第三阶段纤维蛋白形成,血浆中的纤维蛋白原在凝血酶的作用下,转变成纤维蛋白。凝血过程完成后,不导电的纤维蛋白原转化为大量具有导电性能的纤维蛋白,会导致待测样品阻抗值发生变化。因此,根据上述血浆凝固电阻抗变化原理,本实验将阻抗检测与微流控芯片相结合,设计微流控电阻抗检测系统对血液凝固时间进行检测。
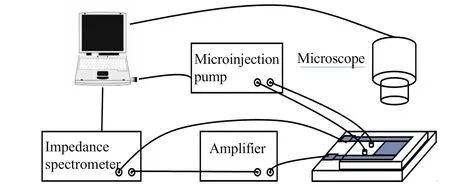
图2 微流控电阻抗检测系统连接示意图Fig.2 Microfluidic electrical impedance detection system connection diagram
微流控电阻抗检测系统主要包括以下五个模块:计算机、微流控电阻抗检测芯片、微流控芯片进样微注射泵、电阻抗分析仪、光学显微镜。五个模块的连接状态如图2所示。首先将实验所需试剂置入微注射泵内部的储液池中,对微注射泵设置一定的注射速度和注射流量,将储液池内的液体推入微流控芯片的通道内,使其在反映区域发生反应。通过计算机对电阻抗分析仪进行调试,产生一个或多个不同频率的正弦电压信号,施加在电阻抗芯片的电极上,敏感电极测量到的电流信号经过放大器转化为电压信号并对信号进行放大,放大后电压信号输入至阻抗分析仪,由电脑端进行接收并处理,实验过程可通过显微镜进行实时观测,通过计算机方便的观察血液凝固过程的状态。
2.2 活化部分凝血活酶时间检测
活化部分凝血活酶时间(APTT)主要用于内源性凝血途径异常的评价,也可用于测定因子Ⅱ、Ⅴ、Ⅹ或纤维蛋白原功能的缺陷。APTT还可用于肝素疗效的监测,是一个临床重要的筛查试验,广泛应用于诊断凝血性疾病、出血和血栓性疾病的治疗监测。
按照图2搭建完成微流控电阻抗检测系统后,开启测量仪器使其预热稳定。为保证检测的精度,进行微流控电阻抗检测前,用1 kΩ的标准电阻作为基准电阻,对阻抗仪进行精准矫正,确定阻抗检测系统正常工作后,再对血浆凝固过程进行检测。由于流体流速很小以及微流控芯片尺寸较小,微流控芯片中流体的雷诺数(Reynolds Number)较低,一般都处于层流状态,因此,本实验在Ramos和Huang等人对交流电渗微混合器的研究基础上,利用双电层理论,将交流电压作用于叉指电极两端,使微流控芯片内产生面内漩涡用以混合反应试剂。实验前将CaCl2溶液、配制完成的活化部分凝血活酶Actin试剂在37 ℃预温1 min,预温后将两种试剂分别移入相应的微注射泵储液池中。接通信号发生器与叉指电极,利用信号发生器产生幅值为10 V,频率为10 kHz的交流电压,然后根据质控血浆的手工检测方法说明按如下步骤进行凝固时间的测定:第一步利用微注射泵以60 μL/min的速度通过Actin溶液试剂进样口向芯片内注入2 μL的Actin溶液;第二步以同样的速度通过血浆进样口注入2 μL血浆溶液,37 ℃孵育的同时打开信号发生器开关,3 min后,向微流控芯片内注入预温CaCl2溶液2 μL,在叉指电极两端施加交流电压并打开阻抗分析仪开始检测,观察血浆凝固状态。图3展示了4次测量中某一次的APTT测量曲线。
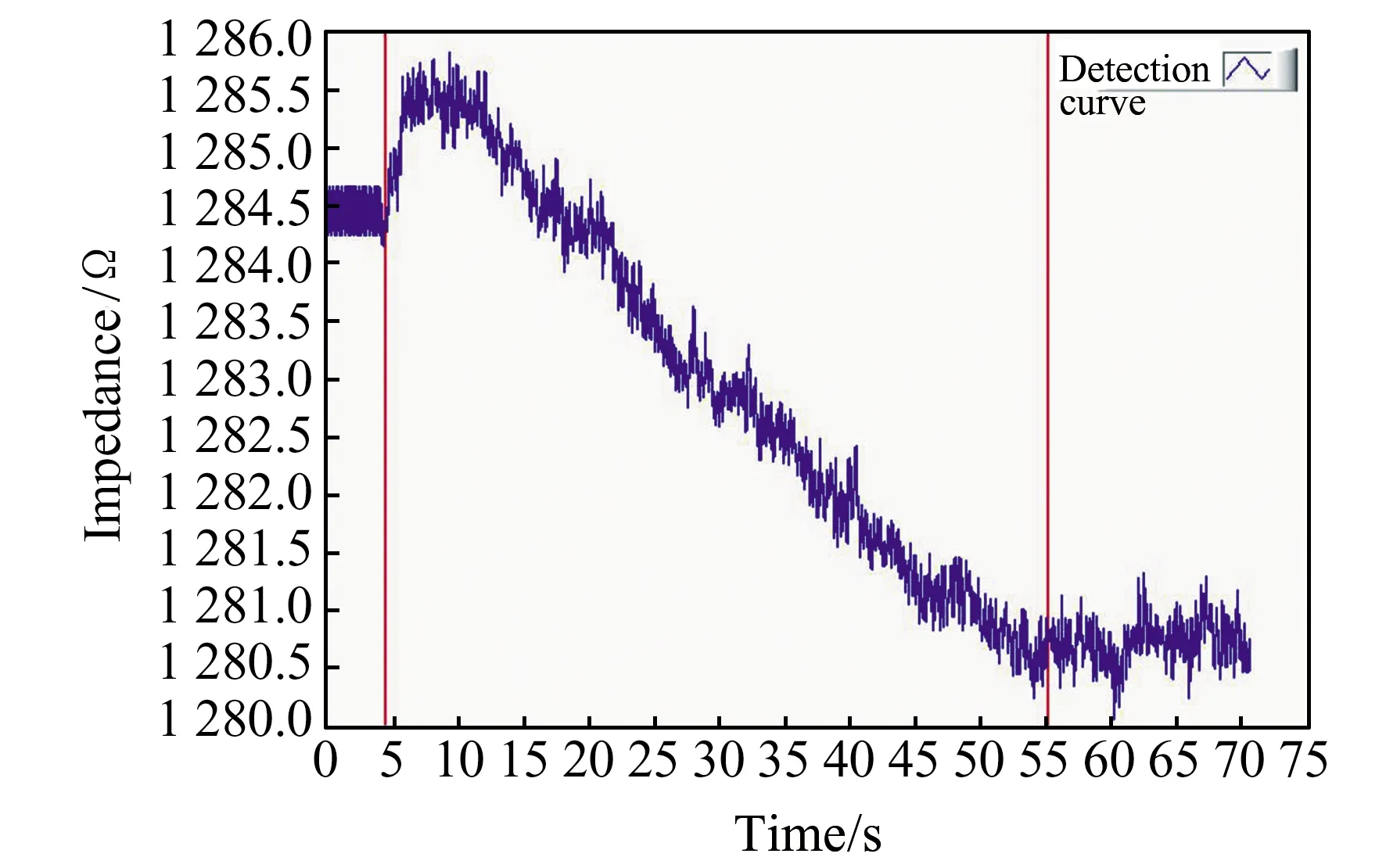
图3 APTT实验过程中电阻的变化Fig.3 Resistance change during APTT experiment
图3中测量曲线主要分为三部分:第一部分,血浆与激活剂孵育后期测量值变化,虽存在一定程度波动,但变化较小;第二部分,由于CaCl2溶液的加入,打破上一阶段的平衡期,由于尚未出现明显凝血,测量值有短暂的增加,随后,试剂相互混合发生反应,纤维蛋白原大量转化为纤维蛋白,阻抗值迅速降低;第三部分,混合试剂的反应到达一定程度,出现相对稳定期。在分析传统电流法确定凝血时间的基础上,引入微积分的概念,对检测曲线进行拟合,在拟合曲线上每一点做切线,而切线斜率最大的一点,也就是ΔA最大的一点确定为凝血点。
按照上述确定方法,首先利用公式(1)对曲线进行最小绝对残差法的广义多项式拟合,令多项式阶数为3。
y=a3·x3+a2·x2+a1·x+a0
(1)
通过程序控制调整,确定多项式系数为:
则曲线的拟合三阶多项式为:
y=3.96×10-12·x3-7.34×10-8·x2-5.6×10-5·x+1285.36
(2)
根据高阶求导公式(3),对多项式求导
y′=3a3·x2+2a2·x+a1
(3)
通过导数的变化确定曲线上每点切线斜率的变化情况,求得其变化最大的一点x,根据采集频率与x的关系,确定为活化部分凝血活酶时间t=27.4 s。
为了保证实验数据的准确性,重复上述实验步骤,使用同一检测系统,同一血浆进行4次实验,检测结果如表1所示。
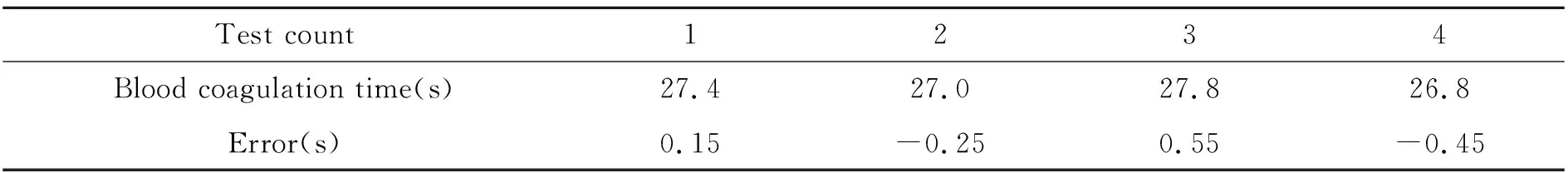
表1 APTT检测的实验数据
利用标准偏差计算公式(4)和极差计算公式(5)衡量检测系统的稳定性。
(4)
r=ymax-ymin
(5)
4次检测结果的算术平均值为27.25 s,极差为1 s,标准偏差为0.384。说明此检测系统在条件一定情况下稳定性良好,能够满足检测要求。系统出现误差主要是因为微流控芯片制作过程中,可能出现毛刺,芯片的质量是影响检测结果精度的主要因素,因此制作时要严格按照制作步骤,尽量减小误差。
3 结论
本文提出的一种基于叉指电极的微流控凝血时间检测芯片,采用变化灵敏的阻抗法对血液凝固时间进行检测。实验结果表明,与使用普通玻璃试管的传统检测方法相比,本研究将带电极的微流控芯片和具有智能信号采集处理功能的上位机相结合,整套系统操作简便,试剂样品用量少,不受血液颜色和粘度的影响,为后续微流控芯片在血液方面的相关研究提供良好的实践基础。

