一种高灵敏及高选择性荧光“关-开”分析测定谷胱甘肽的方法研究
覃小宁, 秦 蒙, 凌芊芊, 梁淑彩*, 鄢国平
(1.武汉大学药学院,湖北武汉 430072;2.武汉工程大学材料科学与工程学院,湖北武汉 430074)
谷胱甘肽(GSH)是一种重要的低分子量巯基化合物,它在细胞内发挥着不可替代的作用,如保持细胞免疫系统的正常功能,维持细胞内的氧化还原平衡和解毒等[1]。此外,GSH在延缓衰老、增强免疫力、抗肿瘤等功能性食品或药品中也较多应用[2,3]。因此,对于生物样品、食品、药品等样品中GSH的检测有重要意义。已有的巯基化合物测定方法有光谱分析法[4 - 6]、液相色谱分析法[7],高效毛细管电泳法[8],电化学分析法[9,10]等。其中荧光分析法具有简便、成本低、灵敏度高的优点而受到关注[4 - 6,11]。然而,尽管已有很多巯基荧光探针的报道,但它们大多数用于荧光分析测定样品中巯基的总量,在进行GSH测定时,易受到其结构类似物半胱氨酸(Cys)及高半胱氨酸(HCy)的干扰。近年来,对于具有GSH选择性的荧光探针研究开始受到关注[12,13],如已有基于GSH与金属离子的选择性相互作用而开发的GSH探针[14]。
萘酰亚胺类化合物是一类重要的荧光染料,已较多用于荧光探针的研究[15]。4-硝基-N-丁基-1,8-萘酰亚胺(BNNA)是一个简单的萘酰亚胺衍生物,广泛用于萘酰亚胺类化合物的合成[16,17]。由于具有受体-π-受体电子结构,其中的-NO2易发生亲核取代反应,有望用于巯基化合物的测定。本文研究了BNNA与GSH、Cys和HCy等巯基化合物以及其他非巯基氨基酸反应前后的荧光光谱,发现BNNA无荧光,GSH能使其荧光显著增强,而Cys、HCy和其他非巯基氨基酸对BNNA的荧光没有或仅有弱的影响。机理研究表明BNNA与GSH之间发生了巯基-硝基亲核取代反应,生成强荧光的硫醚化合物;进一步研究表明十六烷基三甲基溴化铵(CTAB)的存在能够显著地缩短反应时间和提高检测灵敏度,据此建立了一种以BNNA为荧光探针,胶束催化选择性测定GSH的新方法。
1 实验部分
1.1 仪器及试剂
Hitachi F4600型荧光分光光度计(Japan,Tokyo);AB Sciex API 4000 Qtrap三重四极杆质谱仪(Framingham,MA);Bruker ARX-400 MHz核磁共振仪(Germany,Karlsruhe)。
BNNA按文献方法[16]制备,BNNA用乙醇溶解配制成浓度为10.0 nmol/mL储备液,放置于4 ℃冰箱中保存,临用时用水稀释为1.0 mmol/mL的工作溶液。分别配制浓度为1.0 mmol/L的GSH、Cys、HCy及其它氨基酸的水溶液,于4 ℃下保存(每日新配),临用时用水稀释。其他试剂为市售分析纯,实验用水为去离子水。
1.2 GSH与BNNA反应产物(BNNASG)的制备
0.15 mmol BNNA溶于3.0 mL 95%乙醇,然后加入0.16 mmol GSH和6.0 mL磷酸盐缓冲溶液(PBS,pH=11.0),混合溶液在50 ℃反应,期间用薄层色谱(TLC)检测。反应完全后,旋转蒸发除去部分溶剂,剩余物冷却。将析出的产品过滤,用水洗涤三次,乙醇重结晶,得到产品。ESI-MS(m/z):[BNNASG+H]+,计算值: C26H31N4O8S 559.6,测得值:559.3;[BNNASG+Na]+,计算值:C26H30N4O8SNa 581.6,测得值:581.4。1H NMR(400 MHz,DMSO-D6),δ(ppm):8.97(1H,Ar-H),8.77(1H,Ar-H),8.52(2H,Ar-H),8.37(1H,Ar-H),7.87(2H,2CONH),4.62(1H,CH),4.03(2H,CH2),3.71(2H,CH2),3.67(1H,CH),2.33(2H,CH2),1.88(2H,NH2),1.60(2H,CH2),1.35(2H,CH2),1.21(2H,CH2),1.12(2H,CH2),0.93(3H,CH3)。
1.3 GSH的测定
于10.0 mL比色管中加入0.10 mL 1.0 mmol/L的BNNA工作溶液,3.0 mL 20.0 mmol/L PBS(pH=8.0),1.0 mL 10.0 mmol/L的CTAB溶液,GSH溶液适量,用水定容至10.0 mL,摇匀,50 ℃下反应30 min。以390 nm为激发波长,测定470 nm处的荧光强度F,同时做空白试验,测定荧光强度F0。计算相对荧光强度ΔF=F-F0。
1.4 样品处理
100.0 mg市售酵母样品加入到10.0 mL EDTANa2溶液(0.5 mmol/L)中,超声溶解30 min,然后于12 000 r/min离心3 min,上清液用于检测。为了获得适宜的分析浓度,速溶酵母粉上清液直接用于分析,而GSH营养酵母粉的上清液稀释200倍后用于分析。
2 结果与讨论
2.1 BNNA对GSH的选择性响应
BNNA自身几乎没有荧光。在pH=7.4及50 ℃下,BNNA与GSH、Cys和HCy反应2 h后,荧光没有变化。考虑到碱性环境有利于硝基的亲核取代反应,所以实验测试了pH=11.0及50 ℃下BNNA与GSH、Cys和HCy反应2 h后的荧光变化情况,如图1所示。结果表明,BNNA荧光依然很弱,但BNNA-GSH体系在500 nm处具有显著荧光(激发波长为390 nm),而BNNA-Cys和BNNA-HCy体系仅有很弱的荧光。在不同pH值下(pH=9.0~13.0),BNNA对GSH、Cys及HCys的荧光响应变化如图2所示。从图中可以看出,GSH、Cys和HCy对BNNA的荧光增强都是随着pH升高先增加后降低,最大值出现在pH=11.0左右。此外,BNNA对GSH的最大荧光响应远高于对Cys和HCy的响应(大约12倍)。因此,BNNA有望作为荧光探针用于GSH的选择性测定。
为了确认BNNA对GSH的响应机理,我们制备了BNNASG并用MS和1H NMR进行了表征。在质谱图中,主峰出现在m/z559.3,为BNNASG(计算值559.6[M+H]+),m/z581.4的峰应该来源于BNNASG+Na(计算值581.6[M+Na]+),这说明,BNNA的-NO2与GSH之间发生了亲核取代反应。从图3的1H NMR谱图上可以看出,BNNASG的芳香氢的质子信号与BNNA的有明显不同,与BNNA相比,BNNASG中在1.6~4.7 ppm出现了三肽中烷基上氢的信号,7.87 ppm处出现了三肽中酰胺基的质子信号,1.88 ppm处的双峰来源于-NH2,证明了是GSH上的巯基(而不是-NH2)取代了BNNA上的-NO2生成的芳香硫醚产物。
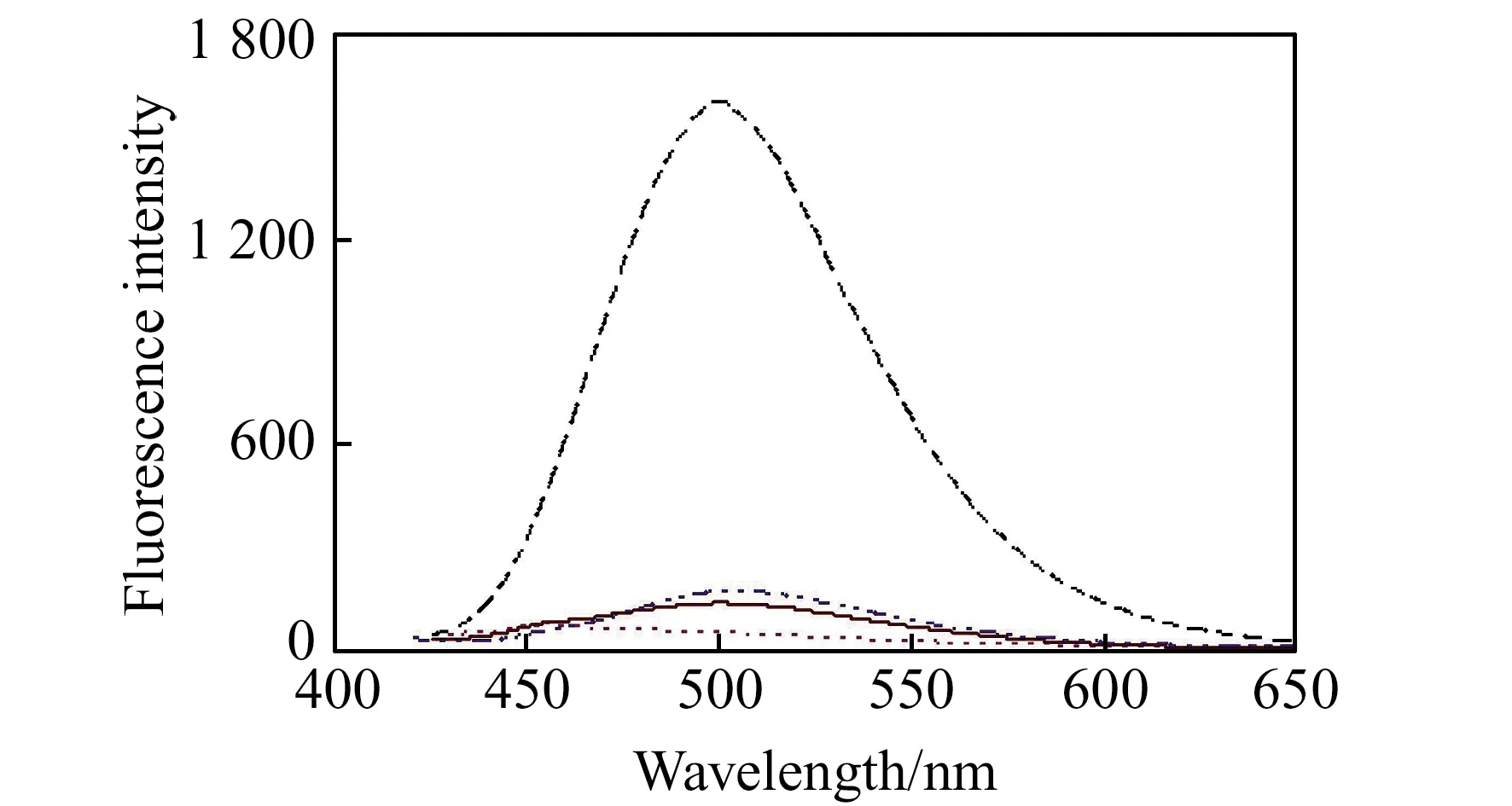
图1 有和无巯基化合物时BNNA的荧光发射光谱Fig.1 Fluorescence emission spectra of BNNA with and without thiolspH=11.0,T=50 ℃,t=120 min;λex=390 nm;………,blank;_ _ _ _,GSH;-·-·-·Cys;,HCy.
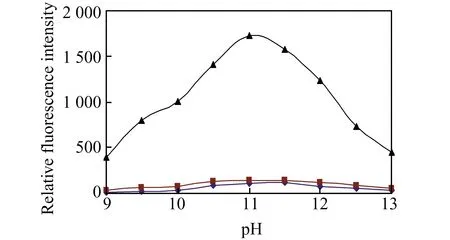
图2 不同pH下BNNA对不同巯基化合物响应的荧光变化Fig.2 The effect of pH values on the fluorescence of BNNA induced by GSH(),Cys() and HCy(),respectivelyT=50 ℃,t=120 min.λex=390 nm,λem=500 nm.
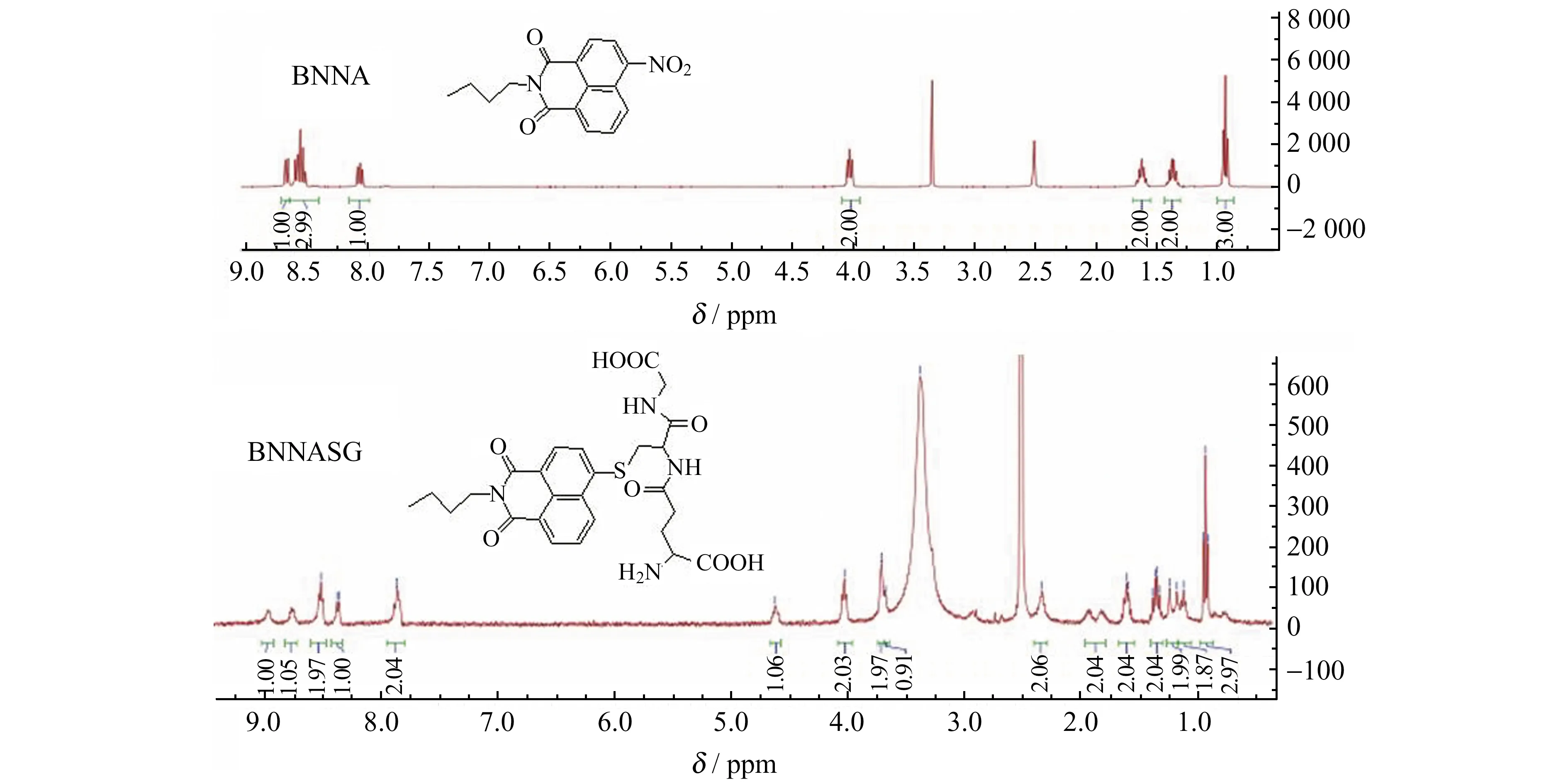
图3 BNNA和BNNASG在DMSO -D6中的 1H NMR谱图Fig.3 1H NMR spectra of BNNA and BNNASG in DMSO-D6
尽管BNNA可以用于选择性测定GSH,但在较强的碱性条件下巯基容易被氧化。此外,动力学研究表明,50 ℃和pH=11.0条件下,BNNA和GSH的反应也至少需要120 min才能达到平衡。因此,为了更好的实现以BNNA为荧光探针选择性测定GSH,需要降低测定的pH值及缩短测定时间。
2.2 胶束存在下BNNA对GSH的响应
CTAB是一种常见的表面活性剂,在溶液中易形成胶束,广泛用于荧光分析测定[18,19]。因此,我们考察了CTAB存在下BNNA与GSH的反应。结果表明,CTAB的存在对BNNA的荧光强度几乎没有影响,而BNNA-GSH-CTAB体系具有显著荧光。与BNNA-GSH体系相比,BNNA-GSH-CTAB体系激发波长未变,但发射波长由500 nm蓝移到470 nm,且荧光变化显著增强;此外,反应时间也大大缩短,在20 min即达到最大。
在CTAB存在下,pH对检测的影响如图4。在pH=7.0时,BNNA-GSH-CTAB体系就有显著增强,反应最优pH为8.0~10.0。因此选择在pH=8.0下检测GSH。分别在25、37、50 ℃下测定BNNA与GSH反应的相对荧光强度随时间的变化情况,结果如图5所示。探针在25 ℃下就可以与GSH反应,但反应较慢,120 min产物荧光强度基本稳定;升高温度到37 ℃反应速率增加,60 min产物荧光就基本稳定;在50 ℃反应只需20 min。为了缩短反应时间提高实验效率故选择在50 ℃下反应30 min进行检测。CTAB浓度对检测的影响研究表明,1.0 mmol/L的CTAB存在下检测效果最佳。稳定性研究表明,在反应达到平衡后荧光强度至少可以稳定6 h。
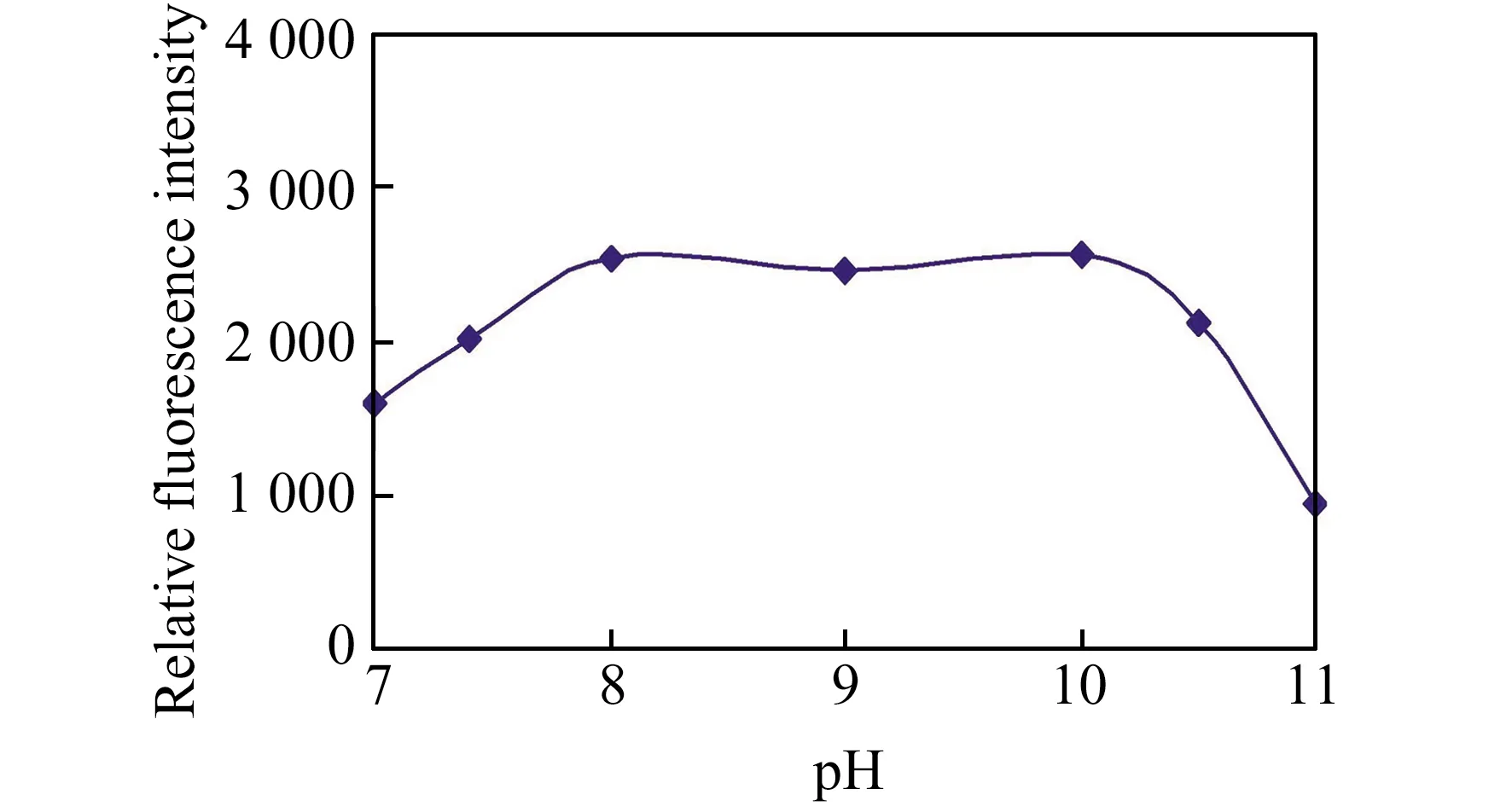
图4 胶束存在下BNNA对GSH的荧光响应随pH值的变化Fig.4 The effect of pH values on the fluorescence enhancement of BNNA induced by GSH with micelle catalysiscCTAB=1.0 mmol/L,T=50 ℃,t=30 min.
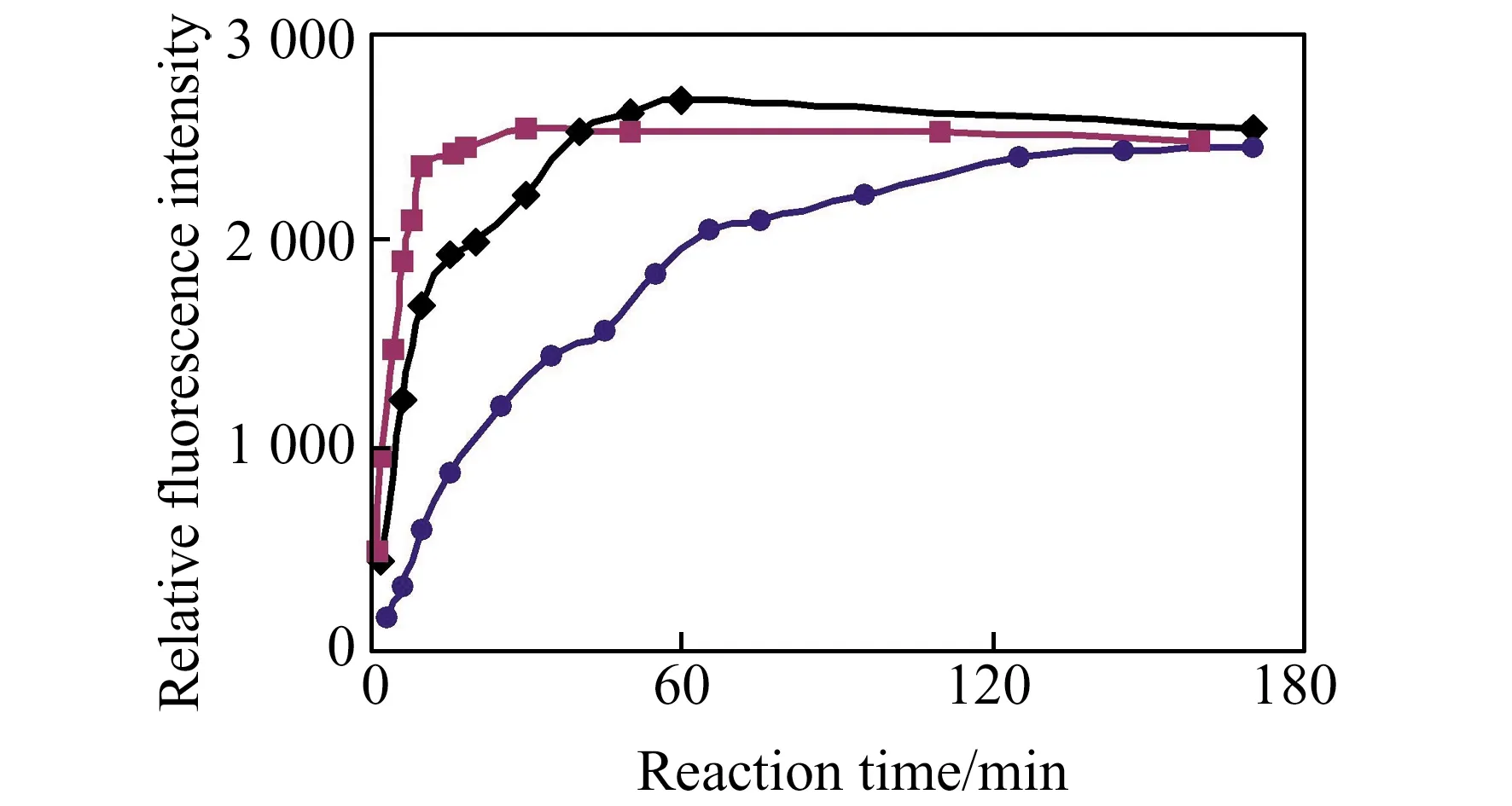
图5 胶束存在下BNNA对GSH的荧光响应随温度和时间的变化Fig.5 The effects of temperature and time on the reaction between BNNA and GSH in phosphate buffer (pH=8.0),with 1.0 mmol/L CTAB.(-25 ℃;-37 ℃;-50 ℃)
2.3 干扰试验
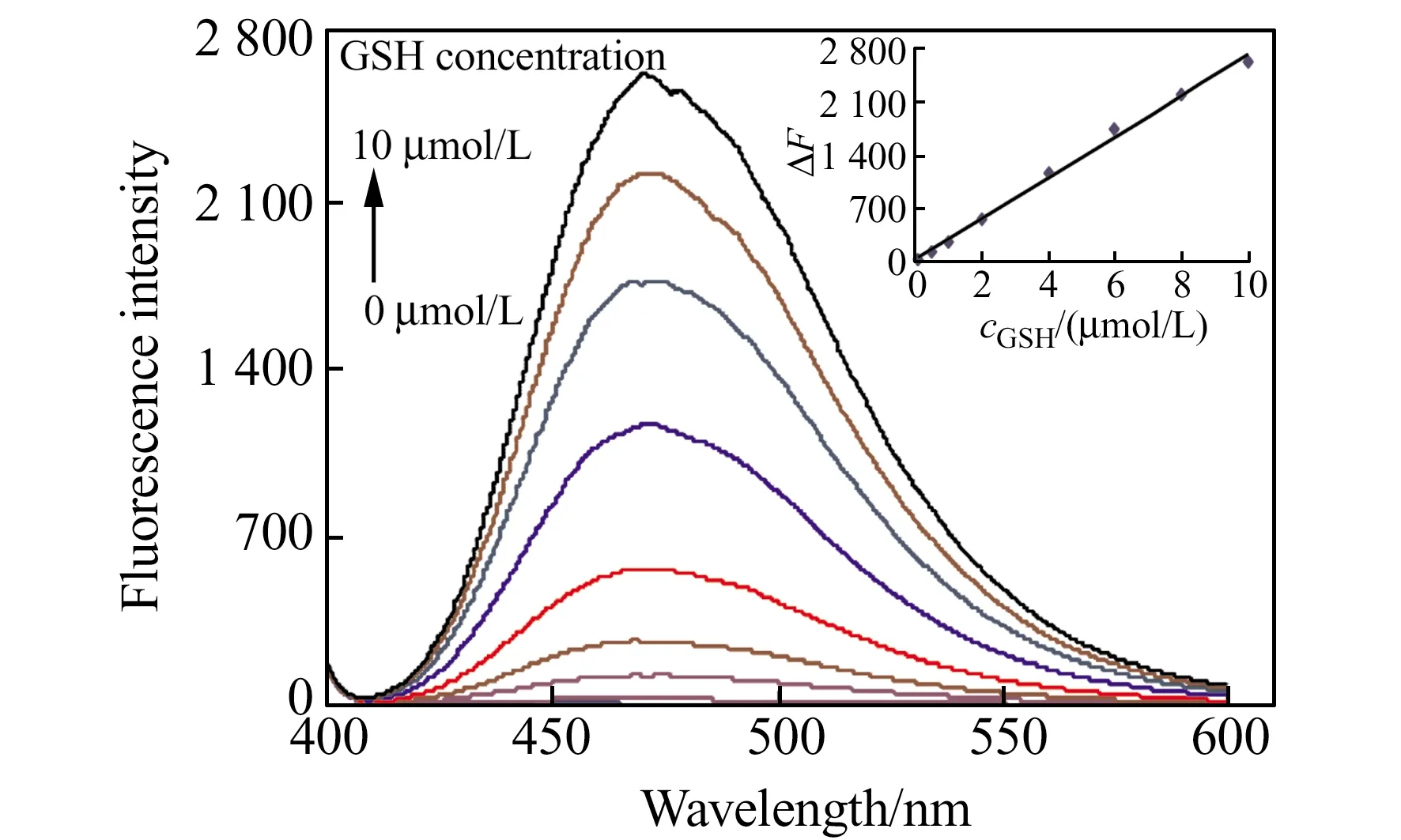
图6 BNNA-GSH-CTAB体系的荧光光谱随GSH浓度变化(插图为ΔF与GSH浓度之间的线性关系)Fig.6 Fluorescence spectra of BNNA-GSH-CTAB systems in the presence of different concentrations of GSH(0,0.1,0.5,1,2,4,6,8,and 10 μmol/L)(Inset:Relationship between fluorescence enhancement(ΔF) and GSH concentration)λex=390 nm,pH=8.0,T=50 ℃,t=30 min,cCTAB=1.0 mmol/L.
在优化的条件下,考察了BNNA与Arg、Tyr、Gly、IIe、Try、Phe、His、Ala、Glu、Cys、HCy和氧化型GSH(GSSG)对测定的影响。结果表明只有GSH与BNNA反应后荧光显著增强。当GSH浓度为5.0 μmol/L及测定结果允许的相对误差不超过±5.0%时,10.0 μmol/L的Cys、HCy,50.0 μmol/L的Ala、Val、His、Arg、Gly、Tyr、Glu、Leu、Lys、Phe、Ser和GSSG,50.0 μmol/L的Li+、Zn2+、Mg2+、Ni2+、Al3+、Cd2+、Mn2+和Ba2+,1.0 μmol/L的Pb2+、Ag+和Hg2+不干扰测定。
2.4 测定GSH的线性范围、检测限和精密度
胶束存在下,随着GSH的浓度增加,BNNA-GSH-CTAB体系在470 nm处的荧光逐渐增大(图6),荧光变化与GSH浓度(0.1~10.0 μmol/L)之间存在着良好的线性关系(R2=0.9958),检测限为1.35×10-9mol/L;对2.5 μmol/L和6.0 μmol/L的GSH进行测定的相对标准偏差(RSD)分别为3.72%和2.17%。
2.5 样品分析
该方法用于酵母样品中GSH的含量测定,加标回收结果如表1所示。对样品中GSH测定的加标回收率在94.4%~101.2%范围,RSD≤4.20%。结果表明,建立的方法能用于实际样品中GSH的测定。
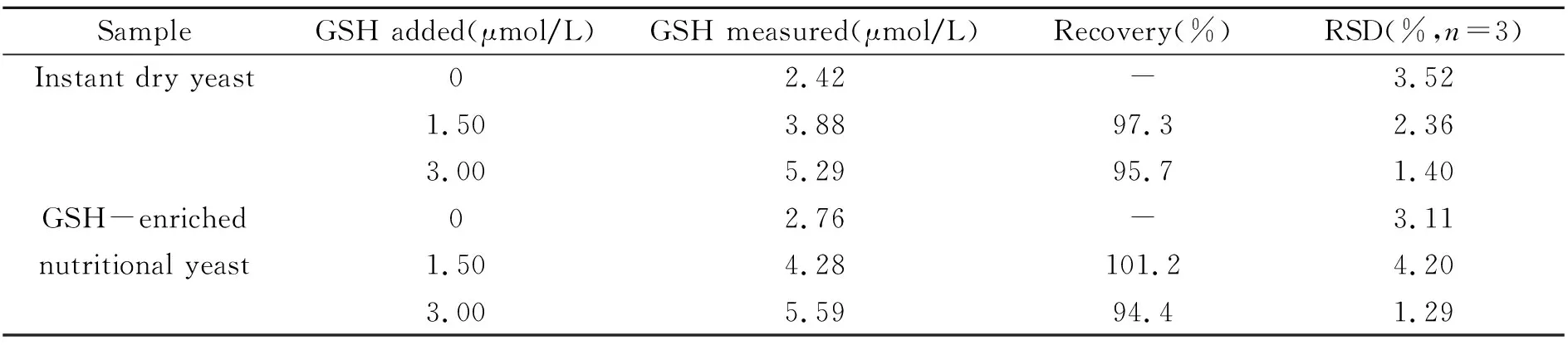
表1 样品分析结果
3 结论
本文以简单的萘酰亚胺衍生物BNNA为荧光探针,基于非荧光的BNNA在胶束催化下与GSH发生巯基-硝基亲核取代反应,生成荧光芳香硫醚衍生物的原理,建立了一种新的高灵敏及高选择性荧光“关-开”分析测定GSH的新方法。在优化的条件下,该方法测定GSH的线性范围为0.1~10.0 μmol/L,检测限为1.35×10-9mol/L,其它氨基酸,包括含巯基的Cys和HCy对其测定也没有明显干扰。该方法具有荧光探针便宜易得,Stockes位移大(80 nm),高的检测灵敏度及高选择性等特点,可用于实际样品中GSH的测定。

