生物法制造丁二酸研究进展
张耀,邱晓曼,陈程鹏,于卓然,洪厚胜,3
(1 南京工业大学生物与制药工程学院,江苏南京211816; 2 南京工业大学国家生化工程技术研究中心,江苏南京211816; 3 南京汇科生物工程设备有限公司,江苏南京210009)
引 言
丁二酸(succinic acid)又名琥珀酸,是TCA 循环的中间产物之一。丁二酸被美国能源部列入“十二种生物基平台化合物”名单,并被认为具备取代石化产品中间体成为新一代生物基化学品中间体的潜力[1-2]。近二十年来,通过研究已得到了多株不同菌种的高产丁二酸菌株。基于这些菌株及其配套工艺,国内外已有多家企业建成了生物基丁二酸工厂。这些工厂在生产菌株、发酵及分离工艺等多方面都存在着差异。本文将结合生物基丁二酸的产业现状,将生产菌株与发酵及分离工艺结合起来,综合分析发酵生产丁二酸经济可行的方案。
1 产业现状
近年来丁二酸的产量保持着稳步增长。全球丁二酸市场产量已从1999 年的1.5 万吨增加至2015 年的5.85 万吨,其市场规模也上升至1.52 亿美元[3-4]。根据产业预测,这一市场在2021年将可能达到7.5 亿美元[5]。市场上的丁二酸目前主要依赖于石化法合成,但近年来由于石油价格波动较大,预计石化法合成丁二酸产量将趋于稳定[6]。未来,作为价格稳定且经济可持续的丁二酸制造方法,生物法将主要承担着丁二酸市场的增量产能[7]。目前全球多家公司的丁二酸生物工厂已经投产,它们在市场上能否与石化法竞争,很大程度上将取决于未来丁二酸的市场需求和生物基丁二酸的制造成本。
1.1 化学法制造丁二酸生产工艺
由于石油化学工业成熟的生产工艺体系,化学法生产的丁二酸在经济性上目前仍优于生物法,市场上丁二酸仍主要来源于化学合成[8]。丁二酸的化学合成方法包括石蜡氧化法、催化加氢法、电解合成法。石蜡氧化法是生产丁二酸的传统方法,但丁二酸只是石蜡氧化的副产物,所以该方法生产的丁二酸总量有限[7]。电解合成法目前仍处于实验室研究阶段,研究人员[9-10]尝试通过使用合适的电极材料及催化剂以提高反应中电流效率并降低反应成本,但这些方法都未解决电极材料和设备损耗大以及副产物含量高的问题,所以此方法距离实际工业应用仍有一段距离[11]。目前市面上多数丁二酸仍通过催化加氢法合成。该方法以顺丁烯二酸酐为原料,顺丁烯二酸酐在加氢反应器中经Ni 或Pb 催化还原后,再经水化得到丁二酸。该反应虽然转化率和产量高,但存在工艺复杂、反应条件苛刻、催化剂价格昂贵等缺点。
1.2 生物基丁二酸工厂的生产工艺
近年来,随着包括石油化工巨头BASF 在内的多家公司建成了多条生物基丁二酸生产线,生物基丁二酸的产量也在稳步增长。如表1 所示,这些厂家所用的生产菌株不尽相同,依据菌株差异也采用了不同的发酵及分离纯化工艺。Reverdia 公司(DSM 和Roquette 合资)的丁二酸工厂位于意大利,该生产线技术特点在于他们将一种产丁二酸的重组酵母(S.cerevisiae)作为生产菌株,在低pH 条件下进行好氧发酵。该技术的优点在于丁二酸在低pH处于非解离状态,无须调节pH,分离提取时可采取直接结晶的工艺,使下游分离成本大幅减低。BioAmber 早期的工厂是将大肠杆菌(E.coli)用作生产菌株,使用电透析法回收丁二酸。后来BioAmber和Mitsubishi 合资的工厂采用酵母Candida krusei进行低pH 发酵生产丁二酸。Succinity 公司(BASF 与Purac合资)的生产线采用的是一种从牛瘤胃中分离出的新型丁二酸生产菌株Basfia succiniciproducens,该菌株属于巴斯德菌科,拥有利用三碳、五碳和六碳糖能力,也具备很好的固碳能力[12-13]。Succinity在发酵工艺上也创新地使用Mg(OH)2维持pH,该方法能提高发酵液中Mg2+的浓度以增加丁二酸产量[14]。Myriant 则将一株能利用木质纤维素水解液的大肠杆菌(E. coli)用作生产菌株,使用氨水作pH 调节剂,并选择氨沉淀法分离丁二酸[15]。
1.3 丁二酸的衍生物
作为平台化合物,丁二酸能通过化学反应转化为1,4-丁二醇(1,4-BDO)、γ-丁内酯(GBL)、四氢呋喃(THF)等多种大宗化学品[16-17]。研究者们还开发出多种非均相金属催化剂,以使发酵液中的丁二酸直接转化为目标产物[18]。而丁二酸的巨大市场潜力就在于它能否作为前体合成许多大宗化学品。这很大程度上取决于它在生产价格上能否与石化产品中间体——顺丁烯酸酐竞争,由于石油价格上涨该化学品的价格已增长了三倍[19]。但碍于生产工艺所限,生物基丁二酸的生产成本目前仍然较高,且各类衍生物合成路径在成本上也无法对石化法路径构成威胁,所以生物基丁二酸仍不具备取代石化中间体的实力。这也使丁二酸目前主要被用作食品酸化剂、表面活性剂、离子螯合剂等高附加值产品。如果生物基丁二酸的生产成本能降到可接受的范围内,相信未来作为平台化合物的丁二酸产品市场将大幅度增长。
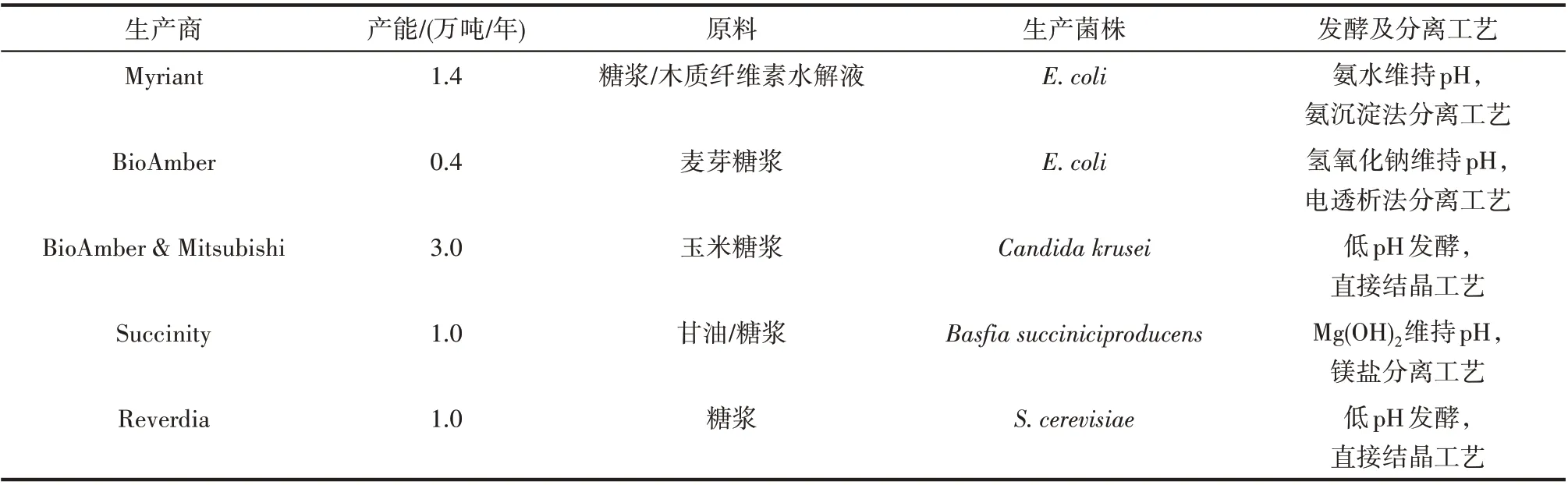
表1 已建成的生物基丁二酸生产线Table 1 Status of industrial production of succinic acid
2 生产菌株
生产菌株决定了发酵产量、得率及生产强度,这三个是决定生物转化经济性的参数。同时,生产菌株也决定了配套的发酵及下游分离工艺,从而决定了生物基丁二酸的总体生产成本。近二十年来,研究者们在丁二酸生产菌株的选育和代谢工程改造方面做了大量工作[20]。从菌种来源及改造方式上可将这些生产菌株分为三类,天然产丁二酸菌株:产琥珀酸放线杆菌(Actinobacillus succinogenes)、产琥 珀 酸 厌 氧 螺 菌 (Anaerobiospirillum succiniciproducens)、产琥珀酸曼氏杆菌(Mannheimia succiniciproducens);原核类基因工程菌株:大肠杆菌(Escherichia coli)、谷氨酸棒杆菌(Corynebacterium glutamicum);真核类基因工程菌株:酿酒酵母(Saccharomyces cerevisiae)、解脂耶氏酵母(Yarrowia lipolytica)。表2列出了具备工业价值的丁二酸生产菌株。本节将选择这三类菌株中较具代表性的三种菌株:大肠杆菌(E. coli)、产琥珀酸放线杆菌(A.succinogenes)以及解脂耶氏酵母(Y.lipolytica),分别介绍这三种菌株各自的特点,及采用的代谢工程改造策略或菌种选育方法。
2.1 大肠杆菌
代谢工程发展30年来,研究者们在利用代谢工程策略改造模式微生物生产有机酸方面做了大量工作。大肠杆菌(E. coli)由于遗传背景清楚、易操作、易调控、培养基要求简单和生长迅速等优点,被广泛用于研究以获得高产丁二酸的基因工程菌株[32]。大肠杆菌合成丁二酸的代谢途径见图1。为了使代谢流流向丁二酸,研究者利用到的代谢工程策略包括加强丁二酸生成途径并消除副产物积累、增加底物转运、优化辅因子代谢等方法。
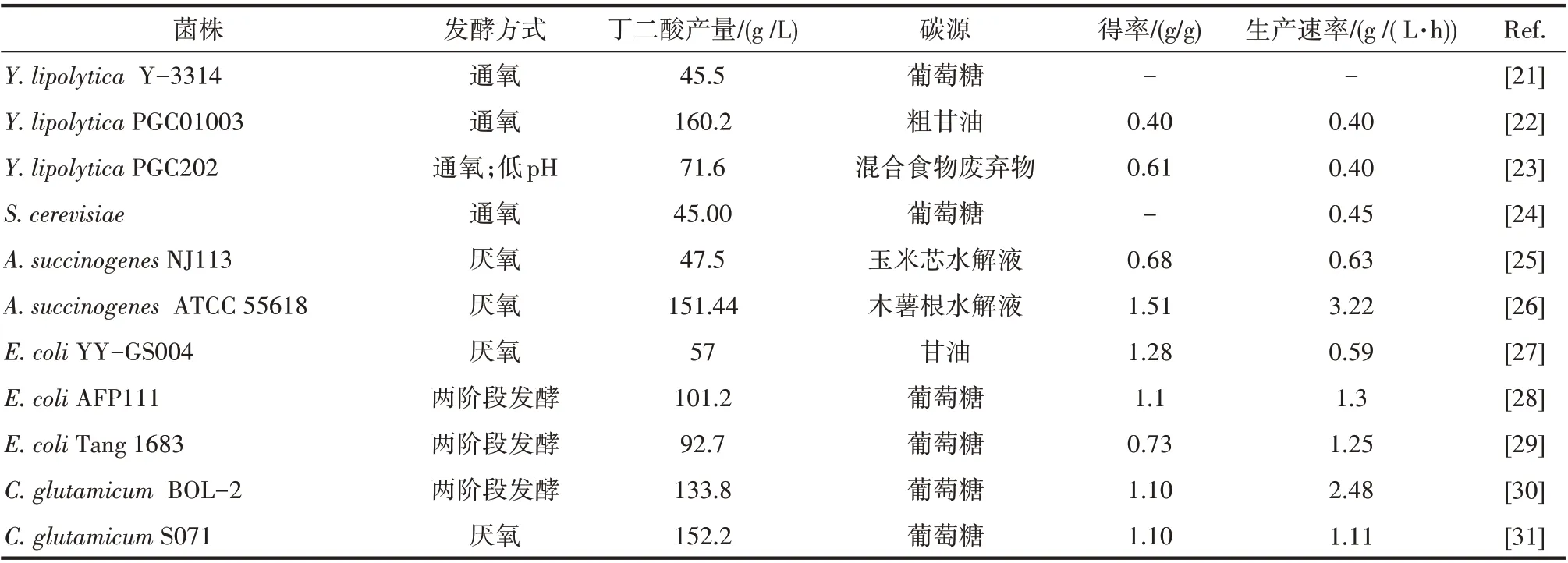
表2 高产丁二酸的生产菌株Table 2 Production strain of succinic acid
2.1.1 调控丁二酸代谢路径中的关键酶 为了使代谢流流向TCA 循环还原支路以生成丁二酸,可以过表达几种关键的羧化酶。其中,PEP 羧化酶(PPC)和PEP 羧化激酶(PCK)是催化磷酸烯醇式丙酮酸(PEP)转化为草酰乙酸(OOA)反应的关键酶[33-34]。PCK 在大肠杆菌中主要参与的是糖异生途径,但它却是产琥珀酸放线杆菌中参与PEP 羧化反应的关键酶。PCK在参与羧化时能比PPC多生成一分子ATP,因此从能量守恒层面PCK 更有利于菌株生成丁二酸[35]。Singh 等[36]结合热力学代谢流平衡分析(TFBA),在E. coliAD32 (ΔldhA, ΔpflB, ΔptsG)中过表达PEP 羧化激酶基因(pck),发现能同时提高菌体生长速率和丁二酸的产量及得率。Zhang 等[37]发现大肠杆菌KJ073参与丁二酸生成的四种羧化酶基因(ppc,maeA,maeB,pck)中,pck基因的缺失对菌株的生长、糖代谢、丁二酸产量及产率影响最为明显。进一步,他们在ppc基因缺失的菌株中加强pck基因表达,发现PCK 能代替PPC 的羧化活性,并能提高菌株在厌氧条件下的丁二酸生产能力。
另外,引入外源基因构建新的羧化途径使代谢流流向丁二酸生成方向,也能明显提高丁二酸的产量。丙酮酸羧化酶(PYC)能将丙酮酸(pruvate)羧化为草酰乙酸(OOA),在大肠杆菌中引入外源丙酮酸羧化酶基因(pyc),有助于丁二酸生成并降低副产物产生[38]。Vemuri 等[39]在两株重组大肠杆菌NZN111(Δldh,Δpfl) 和AFP111(Δldh,Δpfl,ΔptsG) 中 表 达Rhizobium etli的丙酮酸羧化酶基因(pyc),该方法消除了菌株中丙酮酸积累并激活了乙醛酸途径,使菌株的丁二酸产量以及细胞生长速率和底物转化率都明显增高。Okino 等[40]在C.glutamicum(ΔldhA)中过表达pyc基因,也获得了丁二酸产量和生产速率高达146g/L和3.2 g/(L·h)的菌株。
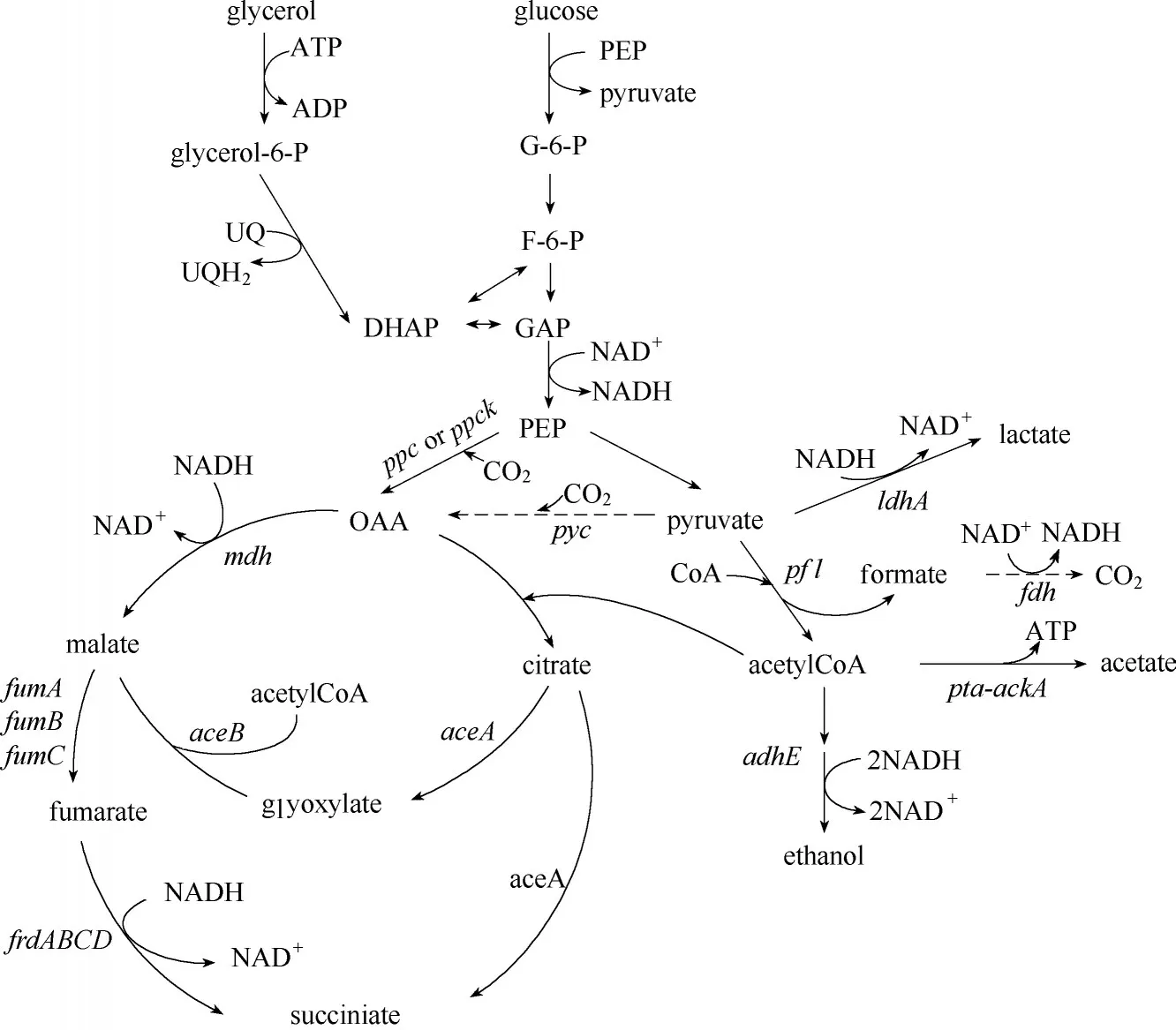
图1 大肠杆菌合成丁二酸的代谢途径Fig.1 Metabolic pathway of synthesis of succinic acid by Escherichia coli
2.1.2 优化工程菌株内的辅因子 在厌氧条件下,通过TCA 循环还原支路合成丁二酸的主要障碍是NADH 的限制。要提高丁二酸的转化率,一方面要增加NADH 的生成量,另一方面要提高NADH 的利用率。Wang 等[41]利用数学及计算机建模从基因组层面分析大肠杆菌的代谢模型,认为激活乙醛酸途径——通过该途径生成1 mol 丁二酸仅消耗1.25 mol NADH,能提高NADH 的利用率以增加菌株丁二酸产量。Sánchez 等[42]在敲除了大肠杆菌MG1655菌株中乙醇脱氢酶基因(adhE)、乳酸脱氢酶基因(ldh)、乙酸磷酸转移酶基因和乙酸激酶基因(ptaack)这些竞争性副产物生成途径上的关键酶基因后,进一步敲除aceBAK操纵子阻遏物的基因(iclR)以激活大肠杆菌中的乙醛酸途径,得到的大肠杆菌SBS550MG 丁二酸得率和生产强度分别为1.1 g/g 和1.18 g/(L·h)。Balzer 等[43]将C.boidinii的NAD+依赖型甲酸脱氢酶基因fdh1转入大肠杆菌SBS550MG中,减少了菌株中副产物甲酸积累并提供额外的还原力,使菌株的丁二酸生产速率从1.4 g/(L⋅h)提高到2.0 g/(L ⋅h)。Litsanov 等[30]在C. glutamicum(Δcat,Δpqo, Δpta-ack)过表达三磷酸甘油醛脱氢酶基因(gapA)的同时,将M.vaccae的fdh基因整合进基因组中进行弱表达,降低了菌株的副产物生成,并使丁二酸得率提升到了1.06 g/g。
NAD(P)H 和NAD(P)+的平衡对于丁二酸生产同样重要。大肠杆菌NZN111(Δldh,Δpfl)具备潜在的丁二酸生产能力,但由于NADH 依赖的乳酸脱氢酶(LDH)的失活造成了菌株NAD+/NADH 比例失衡,使其在厌氧条件下几乎丧失了葡萄糖代谢能力[44]。梁丽亚等[45]构建了重组大肠杆菌NZN111/pTrc99amdh ,在厌氧发酵过程中通过添加IPTG 诱导苹果酸脱氢酶(MDH)表达,使得菌株中NADH/NAD+比例从0.64 下降到0.26,让该菌株在厌氧条件下重新具备了生长及代谢葡萄糖的能力。
2.1.3 消除竞争途径 消除竞争途径理论上确实能增加丁二酸合成,但失活竞争途径的关键基因,往往也会使菌体的生长和代谢受到影响[46]。微生物的代谢网络复杂,恢复生长速度往往涉及到多步代谢反应,通过改造特定的基因位点很难使菌株重新具有原来的生长速度。因此将敲除特定基因的菌株进行代谢进化(metabolic evolution),经过多次传代进化选育出生长速度快的菌株是一种有效的改造策略。Jantama 等[47]利用途径理性设计和代谢进化组合的策略构建出了大肠杆菌KJ060 (ΔldhA,ΔadhE,ΔackA,ΔfocA,ΔpflB) 和 KJ073 (ΔldhA,ΔadhE,ΔackA,ΔfocA,ΔpflB,ΔmgsA,ΔpoxB),能够以增加剩余酶的代谢通量方式维持菌体内氧化还原平衡、ATP供给和正常生长,菌株的丁二酸生产强度达到了70~80 g/L。为降低副产物生成,Jantama等[48]对KJ073 的代谢途径进一步进行了理性改造,最终得到的菌株KJ122 在厌氧条件下96 h 内生产83 g/L左右的丁二酸,得率达到0.9 g/g。
2.2 产琥珀酸放线杆菌
产琥珀酸放线杆菌(A.succinogenes)是从牛瘤胃中分离出的一种革兰阴性菌。它是一株兼性厌氧菌,并具有较高的底物耐受性。野生型产琥珀酸放线杆菌在通入CO2的厌氧条件下能将葡萄糖高效转化为丁二酸,密歇根生物技术研究所(MBI)早在1981 年就将该菌株用作丁二酸生产菌株[49]。McKinlay 等[50]对A. succinogenes进行全基因组测序并分析其代谢途径,发现它拥有利用20种不同碳源的能力,并且A. succinogenes缺乏完整的TCA 循环以及乙醛酸途径,它唯一的丁二酸合成途径是通过羧化PEP形成OOA后经TCA 还原支路生成丁二酸。他们还发现该菌株整体的电子供应及还原力生成都明显偏向利于丁二酸合成的方向。虽然对产琥珀酸放线杆菌代谢途径的认知逐渐清晰,但因为缺乏成熟的基因操作工具,菌种的选育手段仍以诱变技术、代谢控制育种、适应性进化等半理性育种方法为主。Zheng 等[51]利用基因组重排技术对A.succinogenes进行了菌种改造,出发菌株经过三轮基因重排后,筛选出的菌株F3-II-3-F 摇瓶产量比出发菌株增加73%,该菌株经过48 h 补料发酵能产生95.6 g/L 丁二酸,生产速率为1.99 g/(L·h),并且副产物生成明显减少。经改造后的A.succinogenes虽然具备了作为生产菌株的潜力,但由于其大量维生素和氨基酸的合成途径的缺失,造成了它基本培养基中营养成分复杂,一定程度上影响了将其用作生产菌株的经济性[52]。
2.3 解脂耶氏酵母
相较于细菌生产菌株,酵母具有耐高酸和高渗透压的特点。酵母作为生产菌株最大的优势在于能在低pH 条件下进行发酵。如若发酵过程中不加入pH 调节剂,将有效减少发酵过程中无机盐的产生,以节省下游工艺中分离纯化步骤,降低丁二酸下游分离成本。低pH 发酵策略在Cargill 公司生产D-乳酸的实践过程中得到了很好的应用。虽然Reverdia 声称他们能用酿酒酵母在pH 3.0 条件下发酵生产丁二酸达到100 g/L的产量,但并没有明确的信息表明他们这株生产菌株的来源和改造方法[53]。
由于酿酒酵母(S.cerevisiae)是最早被报道出的能通过低pH 发酵高产丁二酸的菌株,研究者早期的兴趣主要集中在酿酒酵母代谢改造上。与细菌类生产菌株不同,酿酒酵母的TCA 循环还原支路代谢能力十分弱,丁二酸也并不是酿酒酵母的代谢终端产物。代谢工程用于构建产丁二酸酿酒酵母的策略,一种是针对TCA 循环氧化支路和乙醛酸循环这两条途径的改造[54]。Raab 等[55]敲除酿酒酵母AH22ura3 的NADP+依赖型异柠檬酸脱氢酶基因(idh1)、NAD+依赖型异柠檬酸脱氢酶基因(idp1)以中断TCA 循环氧化支路中异柠檬酸到α-酮戊二酸的途径,使代谢流流向乙醛酸循环通过还原支路生成丁二酸,同时他们敲除琥珀酸脱氢酶基因sdh1、sdh2,阻断延胡索酸生成以增强丁二酸积累。改造后的菌株菌体生长并没有受到明显抑制,在摇瓶培养中产生了3.62 g/L 丁二酸。还有一种改造策略是在丙酮酸脱羧酶缺陷型酿酒酵母中,重新构建一条完整的TCA 循环还原支路,使酵母在通入CO2的厌氧条件下生产丁二酸。Yan 等[56]敲除酿酒酵母的丙酮酸脱羧酶基因(pdc)及延胡索酸酶基因(fum1)增加中间产物丙酮酸和延胡索酸积累,再通过过表达丙酮酸羧化酶基因(pyc2)、苹果酸脱氢酶基因(mdh3r)以及来自E.coli的延胡索酸酶基因(FumC)和富马酸还原酶基因(Frd S1),构建起一条还原途径合成丁二酸,pH 3.8环境中该菌株产13 g/L丁二酸。
近年,学者们开始尝试将解脂耶氏酵母(Y.lipolytica)改造成为丁二酸生产菌株,所获得的菌株生产能力不但明显强于酿酒酵母,且最高产量已超过了细菌类生产菌株[57]。解脂耶氏酵母是一种半子囊酵母,主要集中在富含脂质的环境中,能利用多种疏水性底物生长,由于其能够在胞内积累大量油脂,许多研究者选择解脂耶氏酵母用于脂质积累调控机理的研究[58]。而最近研究表明,它还具有生产柠檬酸、α-酮戊二酸及甘露醇等高附加值化合物的能力[59-60]。相比酿酒酵母,解脂耶氏酵母属于严格好氧型微生物,它需要完整的TCA 循环以维持生长[61]。也就是说,理论上失活解脂耶氏酵母的琥珀酸脱氢酶(SDH)将破坏其TCA 循环完整性,使菌株为致死表型。Yuzbashev 等[62]利用新的策略得到了缺失sdh2基因的解脂耶氏酵母突变株Y-3312,该菌株能在甘油上生长并生产丁二酸,在CaCO3缓冲液的摇瓶培养中该菌株丁二酸产量能达到45 g/L,在没有缓冲体系的摇瓶中也能产17 g/L 丁二酸。Gao等[22]通过失活解脂耶氏酵母Po1f 中编码亚基SDH5的基因Ylsdh5得到突变菌株PGC01003,该菌株能以粗甘油为底物产丁二酸,并具备在葡萄糖培养基中弱生长的能力,该菌株在摇瓶中发酵产43 g/L 丁二酸,在2.5 L 发酵罐中进行补料发酵丁二酸产量达160.2 g/L。为进一步降低副产物乙酸生成并提高低pH 发酵能力,Cui 等[63]敲除Y. lipolytica中编码乙酰CoA 水解酶的基因Ylach,并过表达来自酿酒酵母的PEP 羧基酶基因(Scpck)和琥珀酰CoA合成酶的beta亚基基因(Ylscs2)以加强丙酮酸羧化和TCA 氧化支路代谢通量,得到的菌株PGC202 丁二酸产量在出发菌株基础上提高了4.3 倍,该菌株能在自然pH 条件下通过补料发酵产110.7 g/L 丁二酸,产物得率为0.53 g/g。
3 生物过程优化
3.1 低值生物质利用
为降低原料成本,研究者们尝试将农林废弃物、餐饮有机废弃物、工业过程副产物等低值生物质用作生产丁二酸的发酵原料。这些低值生物质原料不但价格低廉,如甘油、山梨糖醇等碳源还能为发酵提供额外的还原力[64]。Zheng 等[65]比较了A.succinogenesCGMCC1593 在四种秸秆水解液中产丁二酸的能力,发现菌株利用玉米秸秆水解液发酵时丁二酸生产能力最强,经过44 h 补料发酵丁二酸产量达到53.2 g/L,转化率82.5%,产率1.21 g/(L·h)。Zhang 等[66]开发了一种完全利用过期面包作丁二酸发酵原料的生产工艺,他们先用A. awamori和A.oryzae混合孢子液把面包通过固态发酵方式水解,再利用A.succinogenes对水解液进行厌氧发酵,发酵结束后丁二酸产量达到31.7 g/L,经离子交换柱处理后进行减压蒸馏结晶,能够回收到纯度达96%~97.7%丁二酸晶体。Li等[23]利用富含葡萄糖的厨余垃圾水解液作碳源,在不添加pH 调节剂的条件下使用Y. lipolyticaPGC202 通过流加补料发酵产得71.6 g/L 丁二酸,产物得率为0.61 g/g。而过去几年来生物柴油产量增加,其生产过程中的副产物——粗甘油也成为一种潜在的低值生物质原料[67],Gao等[22]就是将粗甘油用作碳源,使解脂耶氏酵母PGC01003发酵得到了160 g/L丁二酸。
3.2 发酵过程控制
发酵策略对实现生物转化过程中高产量、高转化率和高生产效率有明显影响。由于底物浓度可能影响细胞生长和代谢产物产生,流加补料是常见的丁二酸发酵策略[68]。高产丁二酸菌株合成途径的差别,造成了丁二酸生产中用到了三种不同的供氧策略:解脂耶氏酵母和重组大肠杆菌HL27659k[69]能在有氧条件下高产丁二酸;产琥珀酸放线杆菌和多数大肠杆菌都利用厌氧或双阶段发酵策略生产丁二酸。Vemuri等[70]的研究表明使用两阶段发酵策略时,有氧阶段能够激活重组大肠杆菌的乙醛酸途径,菌株AFP111(pTrc99A-pyc)在最佳的供氧及转厌氧条件下最终丁二酸产量达到99.2 g/L,生产速率1.3 g/(L·h),得率1.1 g/g。而Wang等[71]利用在线控制溶氧方法,通过补料发酵使大肠杆菌SD121 在有氧阶段OD 值达到50,转入厌氧发酵后该菌株丁二酸产量能到达116.2 g/L,整个生物转化过程丁二酸转化率达到1.13 g/g,生产速率高达1.55 g/ (L·h)。此外,纤维床反应器[72]、膜生物反应器[73]也被用于实验室规模的丁二酸生产,但是这些发酵装置昂贵的投资和维护成本,以及使用过程中更高的故障和污菌风险,都限制了这些装置在大规模工业生产中的应用[74]。
3.3 CO2供给形式及pH调节剂
细菌类生产菌株进行厌氧发酵合成丁二酸时,通常会通入CO2气体,这一方面能为OAA 转化为PEP 提供所需CO2,另一方面也能维持发酵液环境处于厌氧。因为羧化酶对CO2亲和力较低,通常需要相当高浓度(分压)的CO2气体来驱动代谢流进入TCA 还原支路[75]。Lu 等[76]研究发现CO2气体浓度在0~50%区间时,丁二酸产量随CO2气体浓度增加呈明显上升趋势,但当浓度高于50%后丁二酸产量增加不明显。此外,溶解CO2浓度还可以通过添加碳酸盐实现,而碳酸盐也能起到维持发酵液中pH 的作用。
pH 通常是发酵过程中的关键控制参数,大多数细菌菌株需要接近中性pH 环境才能获得最佳的发酵性能。丁二酸发酵时会产生大量有机酸,因此必须添加pH 调节剂使发酵环境保持中性。Andersson 等[77]研究了pH 调节剂(Na2CO3、NaOH、K2CO3、KOH 和NH3·H2O)以及渗透压对大肠杆菌AFP184 发酵生产丁二酸的影响。使用Na2CO3时菌株能得到最高产量77 g/L,使用NH3·H2O 时菌体生长受到明显抑制,产量到40 g/L 时菌体生长就完全停止。Li 等[78]的研究表明,MgCO3、Na2CO3、NaHCO3、Mg(OH)2、Ca(OH)2、CaCO3、NaOH 和NH3·H2O 这8 种pH 调节剂中,固体MgCO3最利于A. succinogenesNJ113 细胞生长、底物利用及丁二酸生产,Ca(OH)2、CaCO3和NH3·H2O 用作pH 调节剂时会导致丁二酸产量降低。同时他们发现使用Mg(OH)2和NaOH 混合碱液能达到与固体MgCO3相同效果,这是因为混合碱液中也含有能增加PCK 酶活的镁离子,以使菌体代谢旺盛提高丁二酸产量。这里需要指出,虽然固体碳酸镁被认为是最有利于丁二酸发酵的碳酸盐,但在大规模工业生产中如何保证在添加这种固体盐时不染菌,仍是亟待解决的问题。
3.4 低pH发酵工艺
发酵生产有机酸的一个趋势是开发低pH 发酵技术,避免发酵过程中因添加碱液而形成无机盐。这是因为处理这些无机盐会增加下游单元操作中的投资成本和产量损失[79]。低pH 发酵生产丁二酸的工艺最早是在DSM 申请的专利中被提及,DSM的生产菌株是一株酿酒酵母。而有迹象表明,原先使用大肠杆菌的Bioamber 公司可能从嘉吉公司得到了一株酵母生产菌株C. krusei用于丁二酸低pH生产[80]。迄今为止,全球公开报道的低pH 发酵工艺下最高丁二酸产量的生产菌株,是由Li 等[63]通过代谢改造得到的一株解脂耶氏酵母,该菌株能在完全不添加pH 调节剂的情况下通过补加甘油有氧发酵产生110.7 g/L丁二酸。
4 分离过程
与石化法相比,生物法生产丁二酸的明显劣势在于,丁二酸发酵液中产物浓度低且成分复杂,造成产物分离困难,而下游分离的成本占丁二酸生产总成本的50%~70%[79]。丁二酸发酵液中的杂质主要包括菌体、发酵液中残留糖分、无机盐以及发酵副产物。生物基丁二酸的分离工艺很大程度上取决于发酵液中大量存在的无机盐,细菌菌株的发酵液中多数无机盐为发酵过程中添加碱液产生,对无机盐的去除及回收工艺显著影响着丁二酸的生产经济性。依据不同无机盐的分离方法差异,分离工艺主要分为直接结晶法、电渗析法、钙盐法、氨沉淀法、镁盐分离法(图2)。需要指出的是,本节介绍的是从发酵液中分离丁二酸的工艺。如要获得更高纯度(>99%)的聚合物单体,还需进一步纯化回收到的丁二酸晶体。
4.1 钙盐法
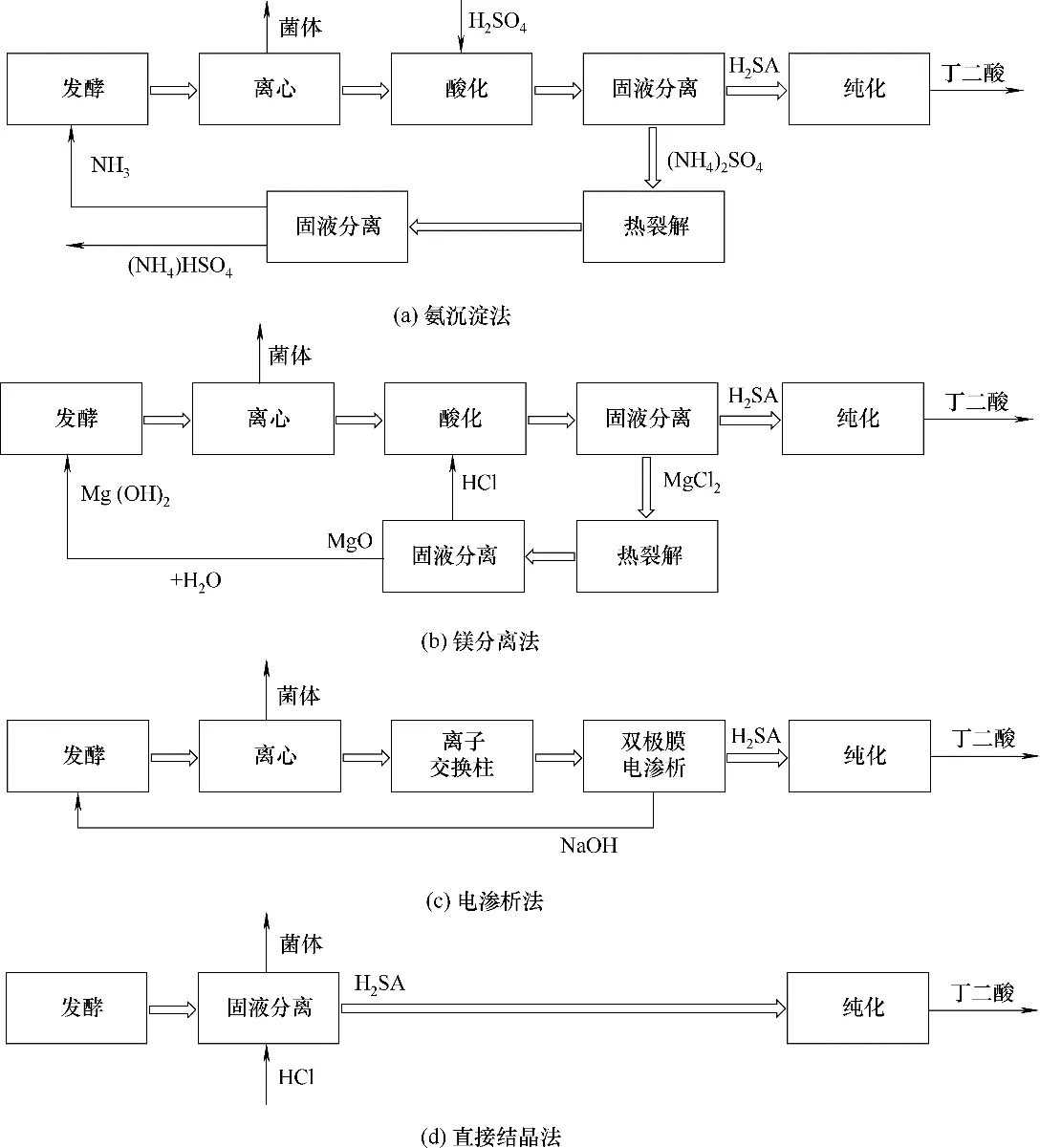
图2 丁二酸分离工艺流程图Fig.2 Process flow chart of succinic acid separation
钙盐法是传统的丁二酸分离方法,这一方法在乳酸及柠檬酸工业中已有了成熟的应用[81]。通过添加Ca(OH)2中和发酵液得到琥珀酸钙沉淀,过滤回收这些琥珀酸钙沉淀后,再加入硫酸从沉淀中释放出游离的琥珀酸,然后将游离的琥珀酸经进一步纯化就能得到高纯度的丁二酸[82]。虽然该方法有成熟的商业应用,但这一方法也存在着明显的缺点:一是产品收率低;二是沉淀过程中氢氧化钙和硫酸用量较大,且这些试剂不能重复使用;三是分离过程中会产生大量副产物硫酸钙沉淀,而这种副产物无法得到有效利用,并因此增加额外的成本。
4.2 氨沉淀法
在发酵过程中,使用氨水作为pH 调节剂时,会形成发酵产物琥珀酸铵,这时采用氨沉淀法分离发酵液中的丁二酸。通过离心将发酵液中细胞分离出后,将发酵液与硫酸或pH 1.5~1.8 的硫酸氢铵溶液混合,使游离氨基琥珀酸形成琥珀酸沉淀和硫酸铵盐,琥珀酸沉淀可溶解于甲醇中并通过重结晶将琥珀酸分离纯化,而副产物硫酸铵溶液可热裂解为氨和硫酸氢铵。这种分离方式的优点在于废弃副产物产生量较少,且可回收利用碱液,缺点在于氨对丁二酸发酵过程会起抑制作用[77],且热裂解硫酸铵过程中耗能较大,产生的副产物硫酸氢铵并不能作为碱液回用。
4.3 镁盐分离法
当使用氢氧化镁作pH 调节剂时,选用镁盐分离法从发酵液中分离丁二酸。发酵液在分离出细胞后,液体中琥珀酸镁在盐酸作用下转化为琥珀酸(未解离)和氯化镁。可以通过直接结晶的方法将琥珀酸沉淀,并把沉淀和氯化镁分离。而氯化镁通过热裂解可以得到氧化镁和盐酸。这一分离方法优势在于丁二酸发酵及分离过程中产生的无机盐都能得到重复利用。但需要注意的是氯化镁的热裂解成本较高,而回收后所得的碱液纯度会有影响。
4.4 电渗析法
利用氢氧化钠作为pH 调节剂时,采用电渗析法分离发酵液中的丁二酸。除去菌体的发酵液须通过离子交换柱后再利用双膜电渗析工艺将琥珀酸和氢氧化钠分离,并将氢氧化钠回用[83]。虽然电渗析的方法有较为成熟的商业应用,但考虑到前期设备的成本投入,还有电渗析膜使用过程中的维护成本,这一方案的使用费用也是所有分离方法里最高的[84]。
4.5 直接结晶法
低pH 发酵结合直接结晶工艺生产丁二酸被认为是较具潜力的丁二酸生产方案。如果发酵过程中只少量产生无机盐,将发酵液通过直接结晶的方法从中提取丁二酸,将大幅节省分离流程并降低丁二酸分离成本。Luque 等[85]发现利用真空蒸馏法可以有效分离低pH 发酵液中的甲酸、乙酸等发酵副产物。Li 等[86]的研究表明在4℃、pH 2.0 条件下,从产琥珀酸放线杆菌发酵液中能直接分离出90%纯度的丁二酸晶体,产品收率为70%。尽管低pH发酵存在生产速率和得率较低的缺点,但该方案具备有效节省下游单元操作中投资和生产成本的优势。
5 结 语
一直以来研究人员和生物技术公司都希望能得到经济可行的生物基丁二酸生产方案。要使丁二酸成为“生物基平台化学品”的目标真正实现,需要在现有生产工艺基础上进一步降低丁二酸的生产成本。研究人员在改造生产菌株提升丁二酸生产效率的同时,需要同时考虑与菌株配套的整体发酵及分离工艺的经济性。要使工业化水平生物基丁二酸具备更好的市场前景,还可以从以下方面进行优化:(1)利用代谢工程策略进一步优化菌株代谢途径,提高产物生产能力的同时降低副产物生成,降低产物分离过程难度;(2)选择价格低廉、质量稳定并有利于菌株生长及下游分离的发酵原料,降低发酵生产的整体成本;(3)优化下游分离工艺,尽可能简化分离纯化过程以降低分离成本,并提高丁二酸回收率及纯度。
总之,随着石油资源日渐枯竭,未来石油化工产品的价格必将逐年上涨,丁二酸作为生物基化学品产业链中重要的节点物质,如果研究人员们能探索出价格更低廉的生产方案,使生物基丁二酸应用从高附加值产品领域转向大宗化学品领域,必将为生物基化学品领域注入新的发展动力。

