长链非编码RNA MEG3靶向下调miR-21对IL-1β诱导的软骨细胞凋亡及炎症反应的影响
丁童 周彦鹏 冯立平
新乡医学院附属中心医院创伤外科,河南 新乡 453003
骨关节炎(osteoarthritis, OA)是现代社会经常发生的一种关节疾病,随着人类平均寿命逐渐增长,OA的发病率也如同预期的一样不断增加。OA常常会有关节疼痛、压痛、骨间摩擦加重、僵硬、关节积液以及行动能力丧失等症状,并伴随有不同程度的炎症发生[1]。关节软骨进行性破坏、滑膜炎、软骨硬化及骨质增生是导致OA关节疼痛及行动力损坏的主要原因[2]。在OA炎症发展过程中,白细胞介素-1β(interleukin-1β, IL-1β)发挥着关键的作用,可促进基质金属蛋白酶(MMPs)的表达、炎症介质PGE2及NO水平升高,引发炎症反应[3],IL-1β常被用于OA体外模型的建立。目前对OA的治疗手段主要有物理治疗、药物治疗和手术治疗等,仅仅能起到缓解关节炎症状,不能够有效的根治,并且现有的治疗方式还会受到不良反应的限制[4]。因此需要寻找更有效的治疗方式,从根本上阻止OA的发生。
MicroRNA(miRNA)是近年来的研究热点之一,作为一类长度约22 nt的内源单链非编码RNA,可与目的mRNA非翻译区结合,调控基因的表达。miRNA广泛参与了人类疾病的调控,在OA中也起着重要的调控作用[5]。已有研究[6]报道miR-21在软骨细胞中可调控OA的发展,而单miRNA往往可能对多个靶基因都存在调控机制,因此miR-21可能还存在其他机制参与调控OA[7]。本研究通过培养人关节软骨细胞株CH8,IL-1β处理建立OA体外模型,再通过miR-21 mimic和母系表达基因3(maternally expressed gene 3, MEG3)过表达慢病毒处理,初步探究了miR-21在OA软骨细胞中与MEG3的作用关系及调控机制。
1 材料和方法
1.1主要试剂
DMEM细胞培养液、胎牛血清购自美国Gibco公司,IL-1β购自南京金斯瑞生物科技公司,lipofectamine2000购自Invitrogen公司,QuantNova SYBR Green PCR 试剂盒购自德国Qiagen公司,Hoechst染色试剂、RIPA裂解液、Trizol试剂购自北京索莱宝生物公司,丙二醛(malondialdehyde, MDA)、超氧化物歧化酶(superoxide Dismutase, SOD)、乳酸脱氢酶(lactate dehydrogenase, LDH)、谷胱甘肽(glutathione, GSH)检测试剂盒及肿瘤坏死因子(tumor necrosis factor-α, TNF-α)、白细胞介素6(interleukin-6, IL-6)、白细胞介素10(interleukin-10, IL-10)ELISA试剂盒购自南京建成生物科技公司,miR-21 mimic、重组慢病毒颗粒购自上海吉玛公司,活化半胱天冬酶3(cleave Caspase-3)、活化半胱天冬酶9(cleave Caspase-9)、基质金属蛋白酶13(matrix metalloproteinase 13, MMP-13)、II型胶原蛋白(Collagen II)、聚蛋白聚糖(Aggrecan)、p65、p-p65、信号传导及转录激活因子3(signal transducers and activators of transcription 3, STAT3)、p-STAT3抗体购自美国Santa Cruz公司,实验所用引物采用Primer3 input设计,上海生工生物公司合成。
1.2细胞培养
人关节软骨细胞株CH8购自ATCC公司,细胞在37 ℃ 5 % CO2的环境下培养于含10%胎牛血清、100 U/mL青霉素和100U/mL链霉素的DMEM培养液中,隔天换液1次,2~3 d根据细胞生长情况换液。
1.3细胞分组及处理方法
将细胞分为空白对照(cTRL)组、IL-1β组、LV-MEG3组、miR-21 mimic组和LV-MEG3+mimic组,除cTRL组外,每组分为加入10 ng/mL的IL-1β处理2 h,MEG3重组慢病毒颗粒分别感染LV-MEG3和LV-MEG3+mimic组细胞,按照lipofectamine 2000转染试剂说明书,使用miR-21分别转染miR-21 mimic组和LV-MEG3+mimic组。
1.4病毒感染CH8软骨细胞株
将处理对数生长期的CH8细胞接种于6孔板,每孔5×104个,当细胞生长融合至70%汇合后,1×108TU/mL MEG3重组慢病毒液每孔加入10 μL感染细胞,24 h后完全培养液37 ℃继续培养48 h。
1.5RT-PCR检测mRNA表达水平
根据1.3的方法分组处理细胞后,用Trizol提取细胞总RNA,反转录合成cDNA,随后按照QuantNova SYBR Green PCR kit说明书进行PCR反应,条件设置为:95 ℃预变性2 min,95 ℃变性5 s,退火/延伸60 ℃ 10 s,40个循环。2-ΔΔCt法进行计算表达水平。
1.6Hoeschst检测细胞凋亡
根据1.3的方法分组处理细胞后,接种于6孔板,多聚甲醛固定细胞,并使用0.5 % TrintonX-100进行透膜处理,Hoeschst荧光染料室温染色30 min,荧光显微镜下观察细胞凋亡情况,以核固缩,细胞核致密浓染视为细胞凋亡,细胞凋亡率=凋亡细胞/细胞总数×100%。
1.7Western blot检测蛋白表达
根据1.3的方法分组处理细胞后,RIPA裂解液提取各组总蛋白,BCA定量,10% SDS-PAGE分离各组蛋白,点样孔每孔30 μg,分离后转移至PVDF膜上,5 % 脱脂牛奶封闭2 h,一抗4 ℃孵育过夜,PBS清洗3次后使用二抗孵育2 h,Ecl显色,GAPDH作为内参。
1.8MDA、SOD、LDH、GSH水平检测
根据1.3的方法分组处理细胞后,硫代巴比妥法(TBA)检测细胞培养液中MDA含量,羟胺法检测细胞培养液中SOD活力,比色法检测细胞培养液中LDH活力,比色法检测细胞培养液中GSH含量,所有操作按试剂盒说明书进行。
1.9ELISA检测TNF-α、IL-6、IL-10水平
根据1.3的方法分组处理细胞后,采用ELISA试剂盒检测细胞培养液中TNF-α、IL-6、IL-10水平,所有操作按试剂盒说明书进行。
1.10免疫荧光检测核定位水平
根据1.3的方法分组处理细胞后,多聚甲醛固定细胞,TrintonX-100透膜处理,14 min后使用PBS缓冲液清洗3次,10 %封闭山羊血清室温封闭2 h,一抗4 ℃孵育过夜。清洗后滴加FITC标记的荧光二抗室温避光孵育1 h,DAPI即用液避光孵育15 min,PBS清洗3次,荧光显微镜观察p65的核定位情况。
1.11统计学处理
用统计学软件SPSS 17.0处理实验数据,组间采用t检验,多组间采用单因素方差分析比较数据,均数±标准差表示实验结果,当P<0.05,认为差异有统计学意义。
2 结果
2.1OA软骨细胞中MEG3表达与miR-21表达存在相互作用关系
如图1所示,与cTRL组比较,IL-1β组MEG3表达水平显著降低(图1 A),miR-21表达水平显著升高(图1B),差异有统计学意义(P<0.01);与IL-1β组比较,LV-MEG3组MEG3表达水平显著升高(图1 A),miR-21表达水平显著降低(图1B),miR-21 mimic组MEG3表达水平显著降低(图1 A),miR-21表达水平显著升高(图1B),差异有统计学意义(P<0.01);与miR-21 mimic组比较,LV-MEG3+mimic组MEG3表达水平显著升高(图1 A),miR-21表达水平显著降低(图1B),差异有统计学意义(P<0.01)。
2.2OA软骨细胞中miR-21和MEG3表达对细胞凋亡的影响
如图2所示,与cTRL组比较,IL-1β组细胞凋亡比率显著升高(图2B),cl-Caspase-3和cl-Caspase-9蛋白表达水平升高(图2C),差异有统计学意义(P<0.01);与IL-1β组比较,LV-MEG3组细胞凋亡比率显著降低(图2B), cl-Caspase-3和cl-Caspase-9蛋白表达水平降低(图2C),miR-21 mimic组细胞凋亡比率显著升高(图2B),cl-Caspase-3和cl-Caspase-9蛋白表达水平升高(图2C),差异有统计学意义(P<0.01);与miR-21 mimic组比较,细胞凋亡比率显著降低(图2B),cl-Caspase-3和cl-Caspase-9蛋白表达水平降低(图2C),差异有统计学意义(P<0.01)。
2.3OA软骨细胞中miR-21和MEG3表达对细胞外基质相关基因表达的影响
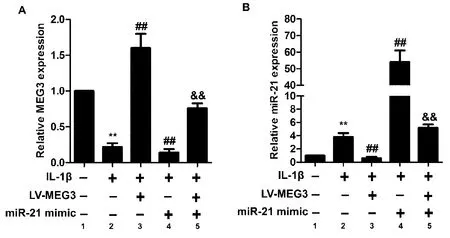
图1 OA软骨细胞中MEG3与miR-21的基因表达注:A:OA软骨细胞中MEG3的相对表达; B:OA软骨细胞中miR-21的相对表达;1:cTRL组;2:IL-1β组;3:LV-MEG3组;4:miR-21 mimic组;5:LV-MEG3+mimic组。Fig.1 The expressions of MEG3 and miR-21 in OA chondrocytesA, The relative expression of MEG2 in OA chondrocytes; B, the relative expression of miR-21 in OA chondrocytes. 1, cTRL group; 2, IL-1β group; 3, LV-MEG3 group; 4, miR-21 mimic group; 5, V-MEG3+mimic group.
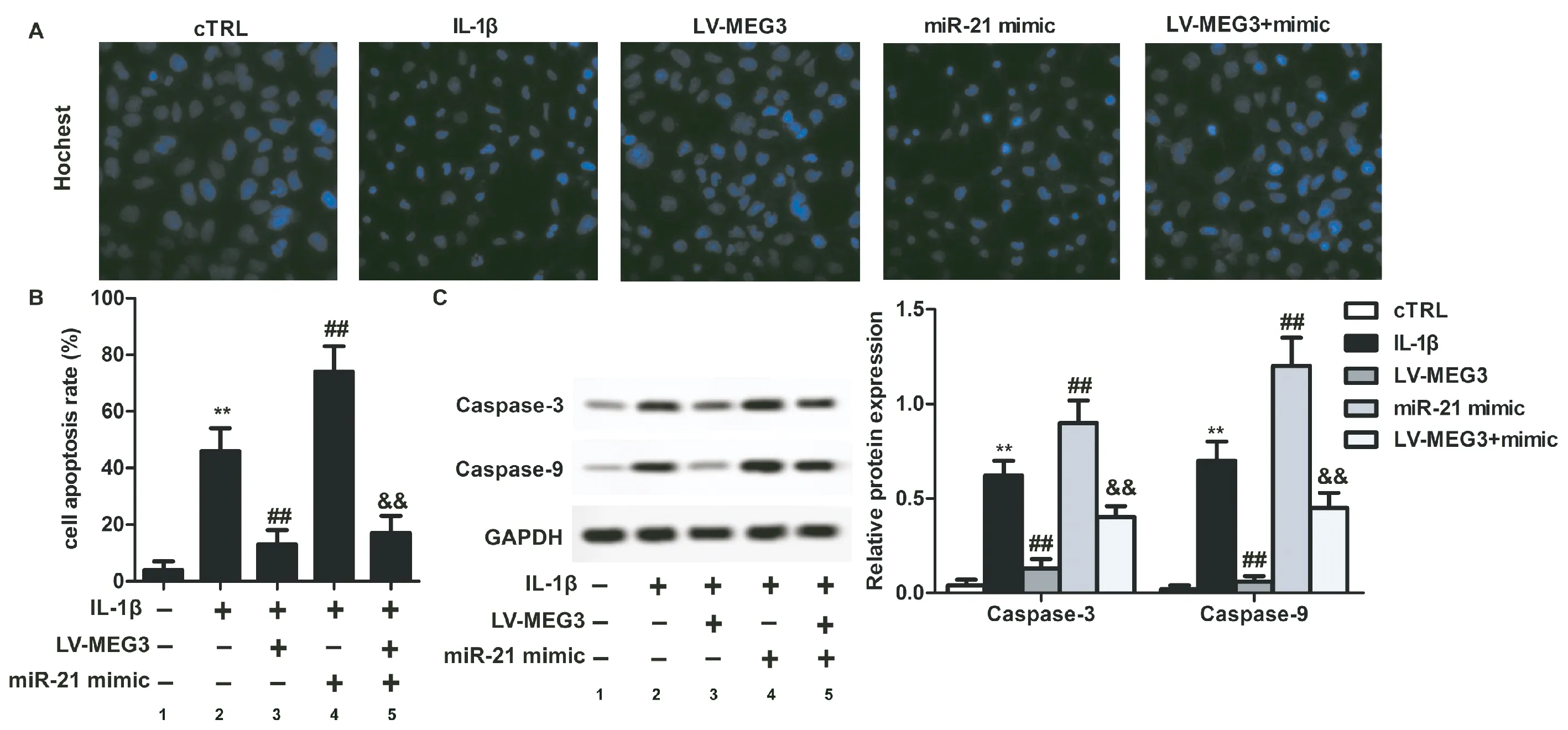
图2 miR-21和MEG3对OA软骨细胞凋亡的影响(200×)注:A:Hoeschst检测细胞凋亡;B:OA软骨细胞凋亡率;C:Western blot检测凋亡相关蛋白cl-Caspase-3和cl-Caspase-9相对表达水平;1:cTRL组;2:IL-1β组;3:LV-MEG3组;4:miR-21 mimic组;5:LV-MEG3+mimic组。Fig.2 The effects of miR-21 and MEG3 on cell apoptosis of OA chondrocytesA, Cell apoptosis detected with Hoeschst staining; B, apoptosis rate of OA chondrocytes; C, the relative expression of apoptosis-related proteins cl-Caspase-3 and cl-Caspase-9 detected with Western blotting. 1, cTRL group; 2, IL-1β group; 3, LV-MEG3 group; 4, miR-21 mimic group; 5, V-MEG3+mimic group.
如图3所示,与cTRL组比较,IL-1β组MMP-13基因和蛋白表达水平显著升高(图3 A,C),Collagen II和Aggrecan基因和蛋白表达水平显著降低(图3 A,C),差异有统计学意义(P<0.01);与IL-1β组比较,LV-MEG3组MMP-13基因和蛋白表达水平显著降低(图3 A,C),Collagen II和Aggrecan基因和蛋白表达水平显著升高(图3 A,C),miR-21 mimic组MMP-13基因和蛋白表达水平显著升高(图3 A,C),Collagen II和Aggrecan基因和蛋白表达水平显著降低(图3 A,C),差异有统计学意义(P<0.01);与miR-21 mimic组比较,LV-MEG3+mimic组MMP-13基因和蛋白表达水平显著降低(图3 A,C),Collagen II和Aggrecan基因和蛋白表达水平升高(图3 A,C),差异有统计学意义(P<0.01)。
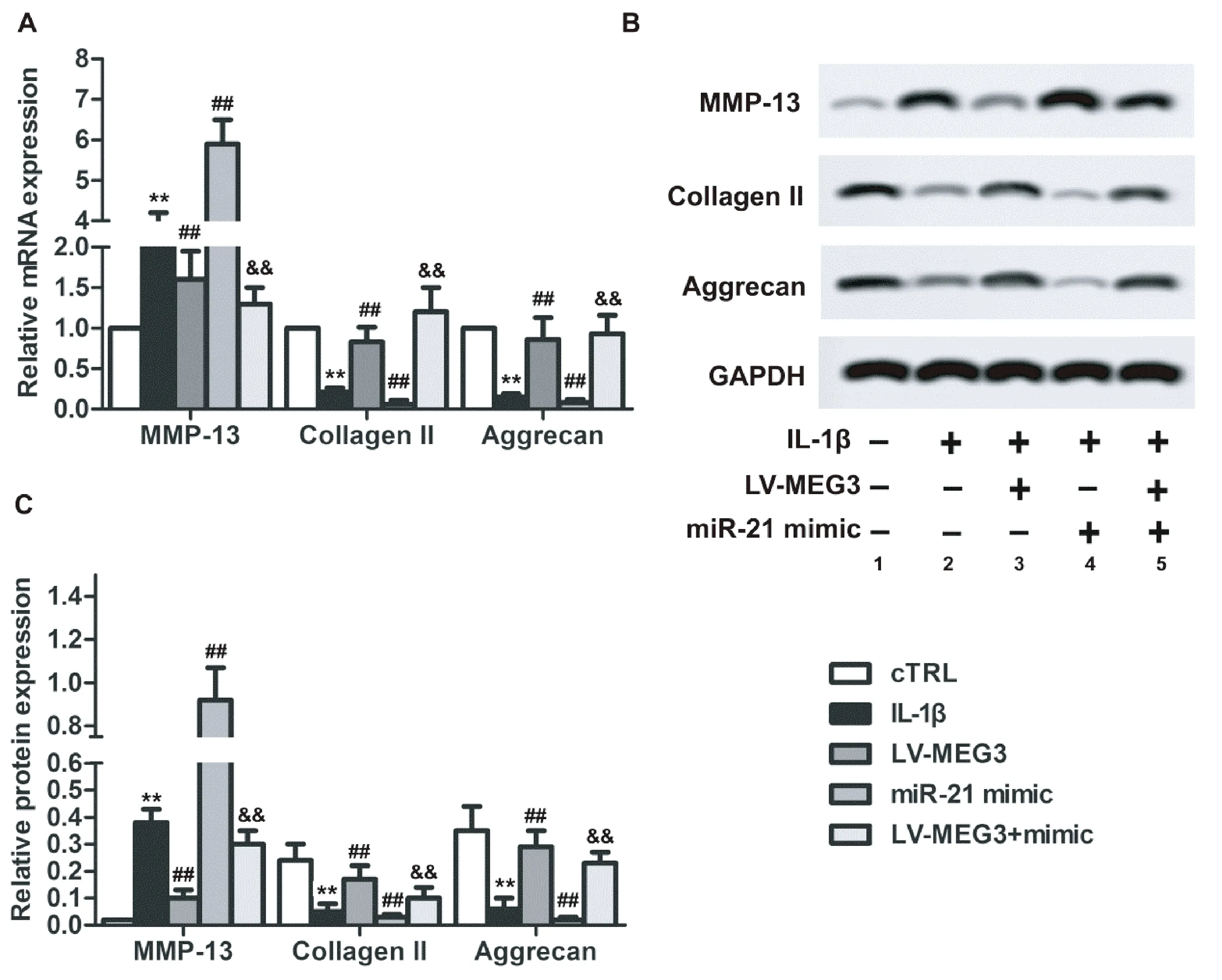
图3 miR-21和MEG3对OA软骨细胞MMP-13、Collagen II和Aggrecan基因和蛋白表达的影响注:A:MMP-13、Collagen II、Aggrecan相对mRNA表达水平;B:Western blot检测MMP-13、Collagen II、Aggrecan蛋白表达;C:MMP-13、Collagen II、Aggrecan相对蛋白表达水平;1:cTRL组;2:IL-1β组;3:LV-MEG3组;4:miR-21 mimic组;5:LV-MEG3+mimic组。Fig.3 The effects of miR-21 and MEG3 on MMP13, collagen II, and Aggrecan genes and proteins in OA chondrocytesA, The relative mRNA expression levels of MMP-13, collagen II and Aggrecan; B, the protein expression of MMP-13, collagen II, and Aggrecan detected with Western blotting, C, the relative protein expression of MMP-13, collagen II, and Aggrecan. 1, cTRL group; 2, IL-1β group; 3, LV-MEG3 group; 4, miR-21 mimic group; 5, V-MEG3+mimic group.
2.4miR-21和MEG3表达影响OA软骨细胞的氧化应激
如图4所示,与cTRL组比较,IL-1β组MDA、LDH水平显著升高(图4 A,B),SOD和GSH水平显著降低(图4C,D),差异有统计学意义(P<0.01);与IL-1β组比较,LV-MEG3组MDA和LDH水平显著降低(图4 A,B),SOD和GSH水平显著升高(图4C,D),miR-21 mimic组MDA和LDH水平升高(图4 A,B),SOD和GSH水平降低(图4C,D),差异有统计学意义(P<0.01);与miR-21 mimic组比较,LV-MEG3+mimic组MDA和LDH水平显著降低(图4 A,B),SOD和GSH水平显著升高(图4C,D),差异有统计学意义(P<0.01)。
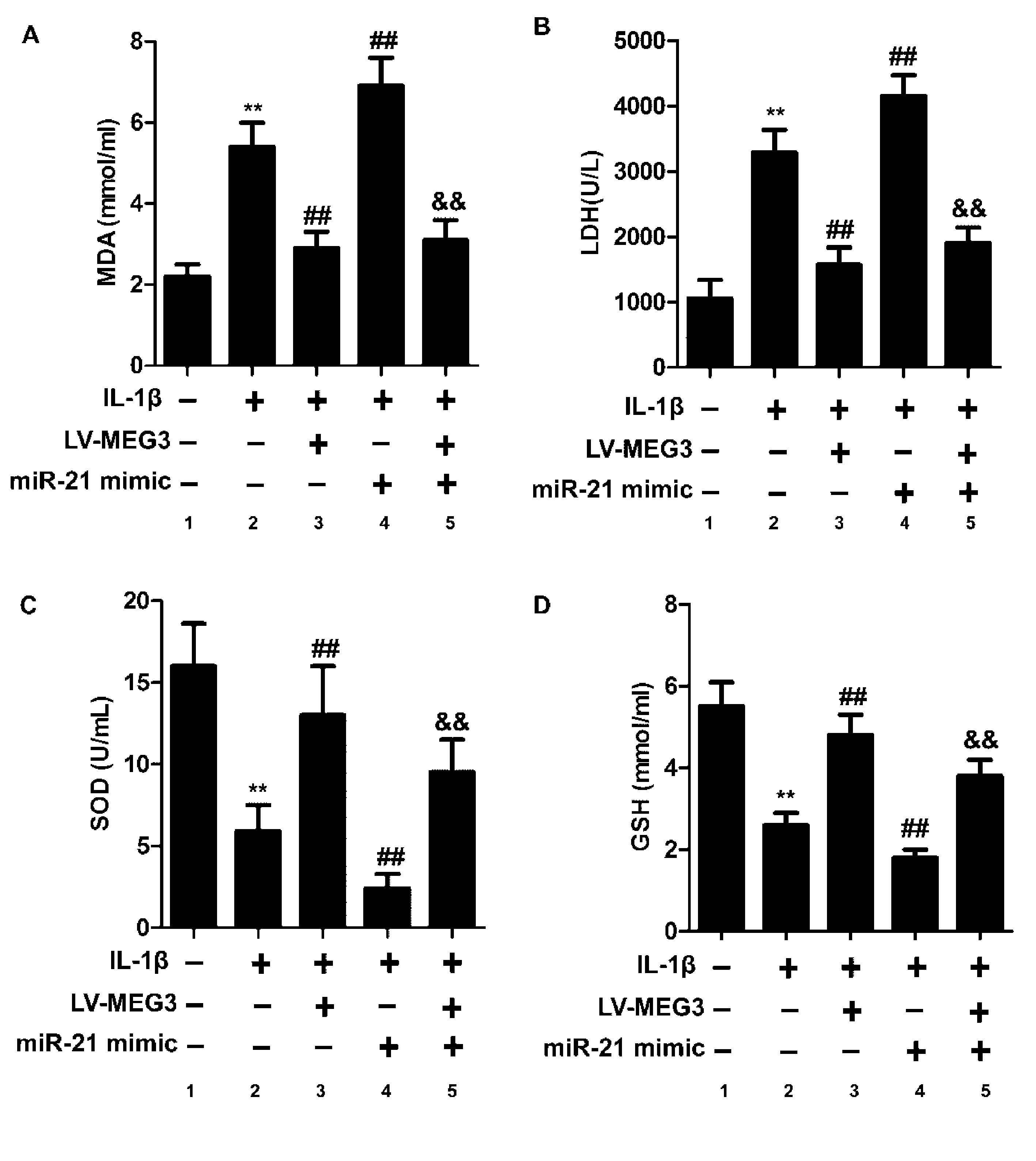
图4 miR-21和MEG3对OA软骨细胞MDA、LDH、SOD和GSH水平的影响注:A:MDA水平检测;B:LDH水平检测;C:SOD水平检测;D:GSH水平检测;1:cTRL组;2:IL-1β组;3:LV-MEG3组;4:miR-21 mimic组;5:LV-MEG3+mimic组。Fig.4 The effects of miR-21 and MEG3 on the levels of MDA, LDH, SOD, and GSH in OA chondrocytesA, MDA level; B, LDH level; C, SOD level; D, GSH level. 1, cTRL group; 2, IL-1β group; 3, LV-MEG3 group; 4, miR-21 mimic group; 5, V-MEG3+mimic group.
2.5OA软骨细胞中miR-21和MEG3对炎症细胞因子的影响
如图5所示,与cTRL组比较,IL-1β组TNF-α和IL-6水平显著升高,IL-10水平显著降低,差异有统计学意义(P<0.01);与IL-1β比较,LV-MEG3组TNF-α和IL-6水平显著降低,IL-10水平显著升高,miR-21 mimic组TNF-α和IL-6水平升高,IL-10水平降低,差异有统计学意义(P<0.01);与miR-21 mimic组比较,LV-MEG3+mimic组TNF-α、IL-6水平显著降低,IL-10水平升高,差异有统计学意义(P<0.01)。
2.6OA软骨细胞中miR-21和MEG3对NF-κB信号通路的影响
如图6所示,与cTRL组比较,IL-1β组p65和STAT3磷酸化比率显著升高(图6 A),细胞核内p65信号水平显著升高(图6B),差异有统计学意义(P<0.01);与IL-1β组比较,LV-MEG3组p65和STAT3磷酸化比率显著降低(图6 A),细胞核内p65信号水平显著降低(图6B),miR-21 mimic组p65和STAT3磷酸化比率显著升高(图6 A),细胞核内p65信号水平显著升高(图6B),差异有统计学意义(P<0.01);与miR-21 mimic组比较,MEG3+mimic组p65和STAT3磷酸化比率显著降低(图6 A),细胞核内p65信号水平显著降低(图6B),差异有统计学意义(P<0.01)。
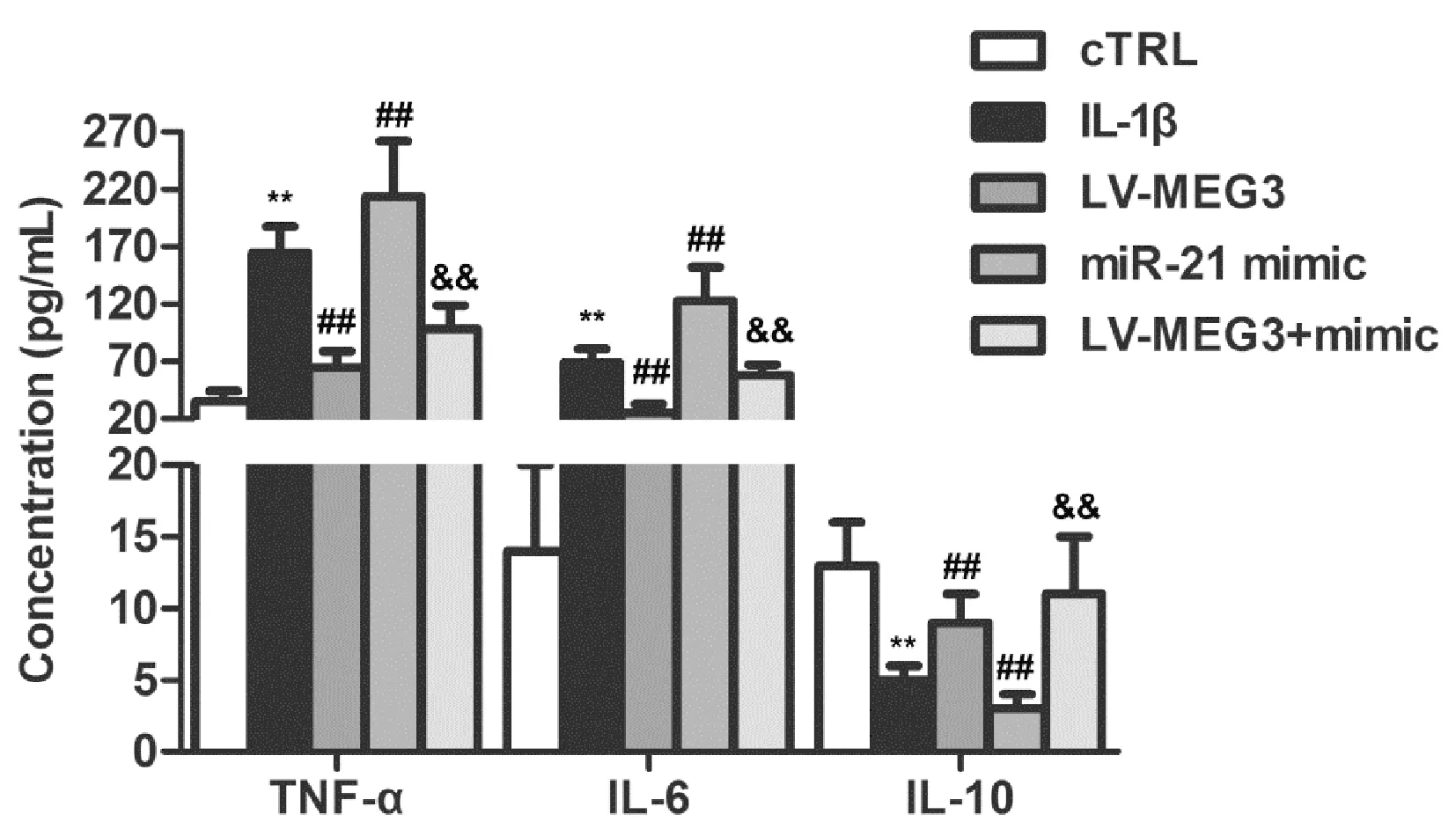
图5 miR-21和MEG3对OA软骨细胞TNF-α、IL-6和IL-10的水平影响Fig.5 The effects of miR-21 and MEG3 on the levels of TNF-α, IL-6, and IL-10 in OA chondrocytes**P<0.01 versus cTRL group; ##P<0.01 versus IL-1β group; &&P<0.01 versus miR-21 mimic group.
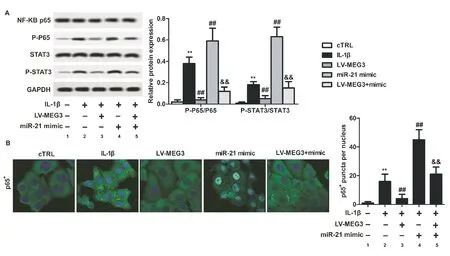
图6 miR-21和MEG3对OA软骨细胞p65、STAT3磷酸化的影响及p65在细胞核内的表达(400×)注:A:Western blot检测p-P65/P65和p-STAT3/STAT3蛋白表达比率;B:p65在细胞核内的表达;1:cTRL组;2:IL-1β组;3:LV-MEG3组;4:miR-21 mimic组;5:LV-MEG3+mimic组Fig.6 The effects of miR-21 and MEG3 on phosphorylation of p65 and STAT3 in OA chondrocytes and the expression of p65 in the cell nuclearA, The relative protein expression rate of p-P65/P65 and p-STAT3/STAT3 detected with Western blotting; B, the expression of p65 in the cell nuclear. 1, cTRL group; 2, IL-1β group; 3, LV-MEG3 group; 4, miR-21 mimic group; 5, V-MEG3+mimic group.
3 讨论
长链非编码RNA(long non-coding RNA, lncRNA)是一类长度大于200 nt的非编码RNA[8],有着复杂的作用机制,可通过基因印记、染色质重塑、细胞周期调控、剪接调控、mRNA降解和翻译调控等方法调控各种生物学进程[9]。其中MEG3因与肿瘤的密切联系而受到研究者的广泛关注[10],Zhu等[11]的研究表明,MEG3过表达可通过下调miR-21抑制乳腺癌肿瘤的形成,荧光素酶报告检测结果表明,MEG3和miR-21存在直接的靶向关系。而在正常及疾病组织中,MEG3与miR-21的靶向关系可能发挥着截然不同的调控作用。Su等[12]的研究表明,在OA组织中,MEG3表达水平下调;Xu等[13]的研究表明,MEG3下调将会导致OA发展,作用机制是与miR-16/SMAD7有关。同时,Zhang等[6]的研究报道了miR-21在软骨细胞中的上调可通过靶向作用于GDF-5促进OA的发展,因此,在OA软骨细胞中,MEG3和miR-21之间可能存在着相互作用调控OA的机制。
为了证实这一推测,本研究首先检测了MEG3和miR-21的基因表达水平,发现在IL-1β诱导的OA软骨细胞中,MEG3显著降低,miR-21显著升高,并且MEG3可显著抑制miR-21的表达,表明在OA软骨细胞中MEG3可靶向下调miR-21的表达。进一步研究发现,MEG3过表达可显著抑制IL-1β引起的细胞凋亡,miR-21可显著提高细胞凋亡,而MEG3可显著缓解miR-21过表达引起的细胞凋亡,表明MEG3可通过下调miR-21抑制OA软骨细胞凋亡;同时,在分子水平上,MEG3过表达显著抑制了cl-Caspase-3和cl-Caspase-9的蛋白表达,miR-21过表达则可显著提高cl-Caspase-3和cl-Caspase-9的蛋白表达,并且MEG3可显著抑制miR-21过表达引起的cl-Caspase-3和cl-Caspase-9蛋白表达提升。cl-Caspase-3和cl-Caspase-9同属于半胱氨酸天冬氨酸特异性蛋白酶(cysteinyl aspartate specific proteinase, Caspase)家族,cl-Caspase-3细胞凋亡的执行因子,表达水平上调与细胞凋亡紧密关联[14]。cl-Caspase-9参与了内源凋亡途径的起始,作用方式是裂解激活下游的执行因子,其中cl-Caspase-3的酶原是cl-Caspase-9的主要底物之一[15]。结合实验结果表明,MEG3可通过下调miR-21,抑制OA软骨细胞凋亡,其作用机制与内源凋亡途径相关。
软骨细胞外基质降解对于OA的发展起着重要作用,Collagen II和Aggrecan是构成软骨细胞基质的主要成分,和软骨细胞存在大量的信息、物质和能量交流,细胞外基质发生降解是导致软骨细胞坏死,功能丧失的重要原因[16],MMP-13属于基质金属蛋白酶(MMPs)家族,能降解多种胶原蛋白,在软骨细胞中,其最主要的底物是Collagen II,是OA中研究较多的胶原酶指标[17]。本研究发现, MEG3过表达显著抑制了IL-1β诱导的MMP-13的表达上调,并促进Collagen和Aggrecan表达,miR-21则具有相反的调控作用,MEG3可显著抑制miR-21对MMP13的上调和对Collagen II、Aggrecan的下调,表明MEG3可通过下调miR-21,抑制OA软骨细胞外的基质降解。
氧化应激参与了OA的发展,活性氧(reactive oxygen species, ROS)在正常关节中具有重要的生理功能,并与SOD、GSH的清除作用达成动态平衡,在OA患者体内活性氧含量增加,造成关节软骨的破坏[18],MDA是脂膜氧化的终产物[19],LDH存在于各组织器官中,当软骨细胞膜损伤时表现为活性升高[20],MDA、LDH、SOD、GSH均是测定氧化应激的可用指标。本研究发现MEG3过表达可显著抑制OA软骨细胞氧化应激的水平,miR-21加重氧化应激的水平,MEG3可缓解miR-21对氧化应激的上调,表明MEG3可通过下调miR-21,缓解氧化应激对OA软骨细胞的损坏。
炎症在OA发展中起着重要作用,TNF-α、IL-6、IL-1β均是参与OA炎症发生的重要促炎细胞因子[21],TNF-α可与IL-1β协同作用,促进软骨基质降解和关节软骨破坏[22],TNF-α还可诱导IL-6的产生,进一步加重对关节软骨的破坏。TNF-α与IL-6表达与OA炎症严重程度呈正相关[23]。IL-10为OA炎症中的抗炎细胞因子,可抑制TNF-α和IL-1等促炎细胞因子的合成,保护软骨细胞[24]。本研究发现,MEG3过表达可抑制IL-1β诱导的TNF-α、IL-6水平升高及IL-10水平降低,miR-21过表达的作用正好相反,MEG3可抑制miR-21引起的TNF-α、IL-6水平升高和IL-10水平降低,表明MEG3可通过下调miR-21,缓解OA的炎症反应。
核转录因子kappa B(nuclear factor-kappa B, NF-κB)和信号传导及转录激活因子(signal transducers and activators of transcription, STAT)信号通路在免疫应答和炎症反应的调控中起着重要作用[25-26]。NF-κB与包括OA在内的诸多疾病的氧化应激和炎症细胞因子有着密切联系,Zuo等[27-28]研究表明,马尾藻可通过下调包括NF-κB在内的一系列信号通路,减轻IL-1β诱导的OA软骨细胞中的氧化应激和炎症反应。在NF-κB信号通路中,p65是NF-κB家族最常见的成员之一,通常与p50形成二聚体,当诱导物如TNF-α激活其上游通路后,二聚体活化转运进入细胞核参与基因表达调控,STAT3是STAT家族的一员,当诱导物如IL-6激活上游通路后,STAT3发生磷酸化形成二聚体,进入核内调控基因表达。本研究发现MEG3过表达可抑制IL-1β诱导的p65和STAT3活化水平升高,降低p65核定位水平,miR-21可提升IL-1β诱导的p65和STAT3活化并促进p65入核,MEG3可抑制miR-21的作用,表明MEG3可通过下调miR-21,抑制NF-κB和STAT3信号通路的激活。
综上所述,MEG3可通过与miR-21靶向作用,下调miR-21在OA软骨细胞当中的表达水平,进而抑制IL-1β诱导的细胞凋亡,降低软骨细胞外基质的降解水平,抑制IL-1β诱导的氧化应激,缓解炎症反应,其作用机制可能与抑制NF-κB和STAT3信号通路的激活有关。本研究首次探究了MEG3可通过靶向下调miR-21表达,抑制IL-1β诱导的细胞凋亡及炎症反应,并初步探究了其作用机制,可能为OA治疗提供了新的靶向治疗思路和诊断标志物。后期将重点对MEG3对OA其他作用机制进行进一步探究。

