酸性KMnO4-HCHO化学发光体系检测硫酸庆大霉素注射液中硫酸庆大霉素的含量
杨 荣,颜雪梅,汪燕飞,熊昌美,龙星宇,2*
(1.贵州师范大学 化学与材料科学学院,贵州 贵阳 550025;2.中科院地球化学研究所 环境地球化学重点实验室,贵州 贵阳 550081)
0 引言
硫酸庆大霉素(Gentamicin(GM) sulphate,GMS,其结构式如图1所示),是广泛应用的氨基糖苷类广谱抗生素,由于是与细菌核糖体30S亚单位结合,抑制细菌蛋白质的合成。对多种革兰阴性菌及阳性菌都具有抑菌和杀菌作用,尤其是对产气杆菌、绿脓杆菌、大肠杆菌、肺炎杆菌、沙门氏菌属及变形杆菌等金葡菌和革兰阴性菌等作用较强[1]。具有疗效好、广谱性、价格便宜、能抑制多种细菌的生长、细菌对该药的耐药性发生率较低等优点,是兽医临床治疗中较为安全的抗生素之一[2]。其不良反应比链霉素、卡那霉素少,所以目前临床应用仍然较为广泛[3]。其注射剂、口服片剂等常常被应用于临床,一些医疗机构还开发出口服溶液等用于治疗胃及十二指肠溃疡病、肠炎和痢疾等。尽管GM抗菌谱广,但有效治疗浓度范围狭窄,易发生毒副反应,为临床安全有效用药,精确测定其在制剂中含量非常重要[4]。
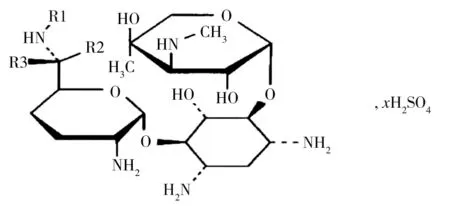
图1 硫酸庆大霉素的结构Fig.1 Structure of Gentamicin sulphate (GMS)
目前测定硫酸庆大霉素的方法有光度法[5-7]、浊度法[8]、反相离子对色谱-脉冲安培电化学法[9]、HPLC-ELSD法[10]、离子色谱法[11]、流动注射电化学发光分析法[12]、UPLC-QTOF-MS联用技术法[13]等,这些建立的硫酸庆大霉素的分析方法,或灵敏度不高,或仪器设备比较昂贵,适用范围受限。因具有仪器设备简单易操作,灵敏度高,线性范围宽等特点,流动注射化学发光分析法被广泛地应用到药物、食品、环境等领域中[14-18]。
预实验表明,在酸性介质中,高锰酸钾可以氧化硫酸庆大霉素产生微弱的化学发光现象,但发光效率较低,信号较弱,作为增敏剂,在甲醛的存在下,可以大大增强该反应的化学发光强度。据此,建立了甲醛-酸性高锰酸钾体系测定硫酸庆大霉素的流动注射化学发光分析方法。该方法重现性好,精密度高,并将该方法应用于硫酸庆大霉素注射液中含量的测定,结果令人满意。
1 实验部分
1.1 仪器与试剂
1.1.1 仪器
BPCL-1-TIC型流动注射化学发光体系仪器(北京物理化学分析仪器有限公司);IFIS-D型智能流动注射进样器(西安瑞迈分析仪器有限公司);FA2004型电子天平(精确至0.1 mg,上海舜宇恒平科学仪器有限公司)。
1.1.2 试剂
甲醛(分析纯,无锡市亚盛化工有限公司)、高锰酸钾(分析纯,天津市科密欧化学试剂有限公司)、硫酸(98%)、硫酸庆大霉素注射液(1 mL∶0.2 g,山西省芮城科龙兽药有限公司),实验用水为去离子水。
1.2 溶液配制
硫酸庆大霉素标准储备液(10 mg/mL):硫酸庆大霉素注射液标示含量为0.2 g/mL,准确移取5.0 mL至100 mL容量瓶中,准确定容,配制为10 mg/mL的溶液,保存备用。
硫酸的标准储备液(2.0 mol/L):准确移取55.56 mL 98%的浓硫酸至500 mL容量瓶中,准确定容,配制成2.0 mo/L的溶液,保存备用。
甲醛的工作液(4%):取66 mL 30.03%的甲醛,稀释后,将其移至500 mL容量瓶中,准确定容,配制成4%的甲醛溶液,保存备用,现用现配。
高锰酸钾的标准储备液(约5×10-2mol/L):称取3.950 7 g高锰酸钾固体,在烧杯中溶解,配制定容于500 mL容量瓶中,准确定容,保存备用。特别说明的是:由于高锰酸钾物质不纯,里面含得有MnO2等杂质,故需要标定,我们采用大约的浓度表示。以下所涉及到所使用高锰酸钾浓度时,均以此储备液浓度下(约5×10-2mol/L)作逐级稀释。酸性高锰酸钾溶液临用时现配现用。
1.3 实验方法
图2为硫酸庆大霉素的BPCL-1-TIC型流动注射化学发光法示意图。通过自动泵将A管通路的甲醛与B管通路的酸性高锰酸钾溶液(内含硫酸)先在线混合反应,再通C管路中用水做载液将S通路中的硫酸庆大霉素泵入混合点后,进入流通池F,由光电倍增管(PMT)将光信号转化为电信号,通过检测器检测电信号,最终传输至个人电脑(PC)由电脑记录光谱信号图,对化学发光信号进行采集。设定仪器参数,自动进样,由记录仪记录发光信号,以平行3次测定发光强度结果求平均(n=3)。由于硫酸庆大霉素对甲醛-酸性高锰酸钾溶液有明显的增敏作用,且硫酸庆大霉素浓度(c)与增敏的相对发光强度(ΔI)成正比,由此展开实验操作。
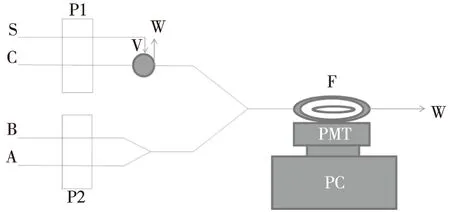
P1,P2:蠕动泵;V:进样阀;W:废液;F:流通池;PMT:光电倍增管(PMT);PC:电脑;A:甲醛溶液;B:酸性高锰酸钾(含硫酸);C:载液(水);S:硫酸庆大霉素图2 流动注射-化学发光测定硫酸庆大霉素的流路示意图Fig.2 Schematic diagram of the flow injection chemiluminescencedetermination of Gentamicin sulphate
2 结果与讨论
2.1 化学发光反应动力学性质
实验中我们通过自动泵注入试剂混合液,通过仪器检测化学发光动力学曲线,所得结果如图3所示。我们先通入甲醛和酸性高锰酸钾产生稳定的化学发光曲线后,我们再通入硫酸庆大霉素,其发光信号显著增强,并在3 s左右达到了最大发光强度,整个化学发光持续了10 s左右的时间(见图3b)。从化学发光反应动力学说明了甲醛-酸性高锰酸钾发光体系具有快速发光的特点。
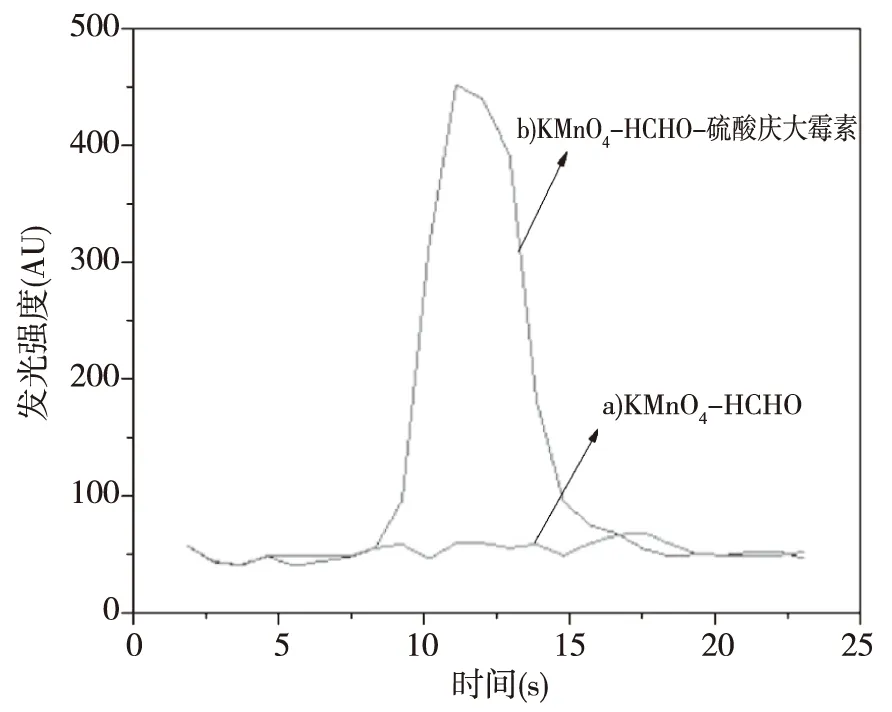
图3 化学发光动力学曲线 a)甲醛+酸性高锰酸钾;b)甲醛+酸性高锰酸钾+硫酸庆大霉素Fig.3 The kinetic curve of the Chemiluminescence reactiona) KMnO4-HCHO; b) KMnO4-HCHO-GMS
2.2 条件优化考察
2.2.1 流动注射化学发光仪参数条件的选择
启动仪器,仪器预先预热15 min以上,并将光电倍增管参数设置为1 000 Pa,并对智能自动注射进样器的参数进行设置。当步号为0时,此时对应的为取样阶段,蠕动泵主泵数及副泵数均为60,主泵方向及副泵方向均为正转,A阀位为手动,B阀位为右,运行时间为100 s,重复次数为1,重复起点为0;当步号为1时,此时对应的为进样阶段,蠕动泵主泵数及副泵数参数均为60,主泵方向及副泵方向均为正转,A阀位为手动,B阀位为左,运行时间为20 s,重复次数为99(有助于每次都可以进行进样,优化条件时不会产生停泵的现象),重复起点为0。在此参数下运行,能快速地进行化学发光反应,且所得谱图时间合理,即前一次进样后发光反应完全且发光信号完全返回至基线后,再进行下一次进样,两次进样所得的并不相互影响。
2.2.2 不同条件对相对化学发光信号的影响
甲醛-高锰酸钾发光体系中,必需在酸性条件下进行反应。因此,我们首先考察不同浓度的硫酸对化学发光信号强度的影响。考察硫酸在0.1~1.2 mol/L范围内,化学发光体系的化学发光信号影响。随着硫酸浓度的升高,相对化学发光强度逐渐增大,而达到1.0 mol/L之后,相对化学发光强度又随着浓度减小(见图4A)。当浓度超过1.0 mol/L后,变化不明显,且对管路有腐蚀,不利于后续的实验研究。因此选择了1.0 mol/L的硫酸为最优的浓度。
高锰酸钾作为氧化剂,其浓度是一个重要因素,对该化学发光体系有明显的影响。选定1.0 mol/L硫酸的条件下,我们进一步考察了高锰酸钾浓度为5×10-3mol/L、1×10-4mol/L、3×10-4mol/L、5×10-4mol/L和7×10-4mol/L时对化学发光强度的影响(见图4B)。由图3B可知,3×10-4mol/L高锰酸钾浓度时,可以获得最大相对发光强度。
分别考虑不同甲醛浓度,在0.5%~5%范围内对体系的相对化学发光强度,结果见图4C所示。结果表明,随着甲醛浓度不断增加,相对化学发光强度也增强。当甲醛浓度超过4%时,相对发光强度增大不明显。因此,选择4%甲醛浓度作为最佳浓度。
由于甲醛-酸性高锰酸钾-硫酸庆大霉素化学发光体系中,该体系是一个快速的发光反应。当两种溶液混合后,如果泵速过慢的话,最大化学发光强度会在检测器之前;泵速过快的话,最大化学发光强度在检测器之后,不管泵速过慢还是过快,在检测器处均未能检测到最大化学发光信号强度。因此,选择合适的泵速直接影响着可检测到的化学发光信号强度。我们通过设置参数的不同来代替泵速的不同,分别考察了自动进样装置中泵速参数为20、30、40、50、60、70、80、90时对化学发光强度的影响,在参数为20时,基线不是太稳定,参数在60以后数值增加得并不是很明显,但是总体上随着参数的增加,化学发光强度也随之增加,结果如图3D所示。本着节省试剂经济的目的,因此,我们最终选择最佳泵速设置参数为60。
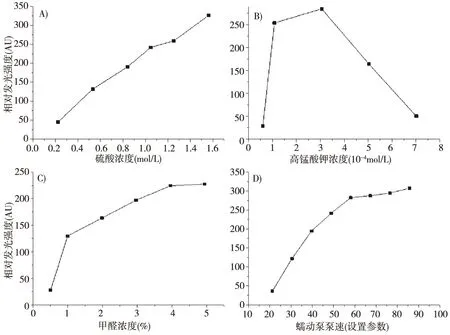
图4 不同条件对相对化学发光强度的影响硫酸A);高锰酸钾B);甲醛浓度C);蠕动泵泵速D)Fig.4 Effect relative chemiluminiscence intense on different conditionsH2SO4 (A); KMnO4 (B); HCHO (C); Flow rate for peristaltic pump (D)
2.3 线性方程、精密度及检出限
在以上优化条件的选择下,即在浓度为1 moL/L的硫酸介质,当高锰酸钾浓度为3×10-4moL/L,甲醛浓度为4%,蠕动泵流速设置为60的条件下,化学发光强度在硫酸庆大霉素(GMS)浓度范围为5.0×10-5~5.0×10-4g/L内呈良好的线性关系ΔI=3.338 24c-7.379 34(R2=0.995 3),结果见图5所示。以3倍的信噪比计算,方法最低检出限为1.5×10-5g/mL,并对3.0×10-4g/mL的硫酸庆大霉素(GMS)连续测定10次(见图6),其相对标准偏差(RSD)为1.4%。说明该方法简单、可靠。
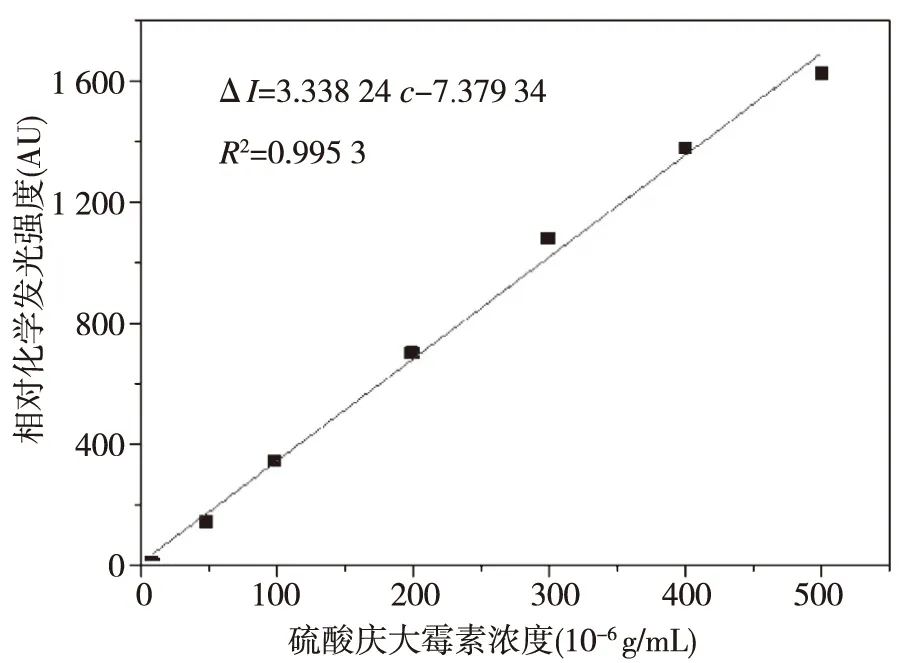
图5 硫酸庆大霉素标准曲线Fig.5 Calibration curve of GMS
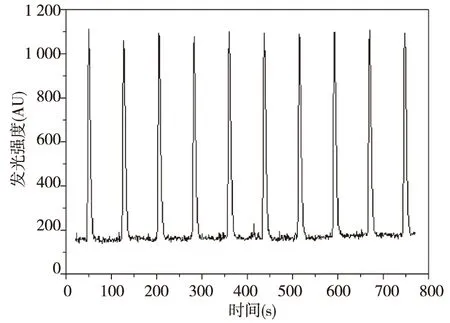
图6 10次连续测定3.0×10-4 g/mL硫酸庆大霉素的化学发光响应特性曲线Fig.6 Chemiluminescence response signal on sequential determination 10 times for 3.0×10-4 g/mL GMS
2.4 干扰实验
2.5 硫酸庆大霉素注射液样品分析
硫酸庆大霉素(GMS)注射液主要成分是硫酸庆大霉素(GMS),主要用于治疗敏感的革兰氏阴性和阳性菌感染,如败血症、泌尿生殖道感染、呼吸道感染、胃肠道感染、腹膜炎、胆道感染、乳腺炎及皮肤和软组织感染以及传染性鼻炎等[6]。按照标准样品溶液配制方法,将0.2 g/mL硫酸庆大霉素注射液分别配制成1.0×10-4g/mL和2.0×10-4g/mL两种不同浓度的样品作为基底含量,并分别对其进行加标回收测定。加标的原则为基底浓度的0.5倍、0.8倍和1.0倍,即在1.0×10-4g/mL的样品中分别添加0.5×10-4g/mL、0.8×10-4g/mL和1.0×10-4g/mL;2.0×10-4g/mL的样品中添加0.5×10-4g/mL、0.8×10-4g/mL、1.0×10-4g/mL,确保加标后的浓度均在线性范围内。测定结果如表1所示。两种人工制成的样品的加标回收率在96.1%~100.3%之间,相对偏差(RSD)在0.3%~3.1%之间。这说明我们所建立的新的流动注射化学发光分析方法可以用于硫酸庆大霉素注射液中硫酸庆大霉素的测定,结果准确,方法简便可靠。
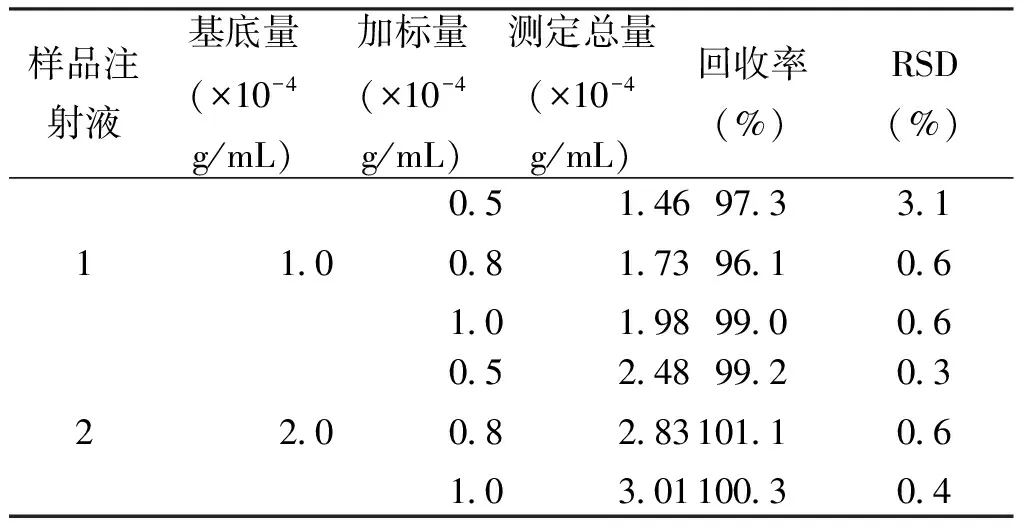
表1 硫酸庆大霉素(GMS)注射液加标回收测定结果(n=5)Tab.1 Analysis results of determination of GMS in GMS injection (n=5)
3 结论
基于酸性条件下,建立流动注射-甲醛增敏的高锰酸钾化学发光体系测定硫酸庆大霉素的新方法。硫酸庆大霉素在5.0×10-5~5.0×10-4g/mL范围内呈现良好的线性关系,R2=0.995 3,方法检测限为1.5×10-5g/mL(S/N=3),并对3.0×10-4g/mL的硫酸庆大霉素连续测定10次,其相对标准偏差(RSD)为1.4%。并将该方法用于硫酸庆大霉素注射液中硫酸庆大霉素含量的测定,数据可靠,结果令人满意。也为硫酸庆大霉素的测定提供了一种新型的简便方法途径。

