红外热成像在乳腺疾病检测的应用研究
曾靓妮,邓方阁
红外热成像在乳腺疾病检测的应用研究
曾靓妮,邓方阁
(广州医科大学附属第一医院广州呼吸健康研究院呼吸疾病国家重点实验室国家呼吸系统疾病临床医学研究中心,广东 广州 510120)
乳腺疾病已严重危害女性身心健康,其中乳腺癌更位居全球范围内女性癌症发病率和死亡率首位,因此乳腺癌的早期发现意义重大。传统结构影像学早期检测疾病具有一定局限性,而红外热成像作为功能成像技术可为乳腺癌的早期筛查提供有效线索。因此本文主要就红外热成像在乳腺疾病的早期检测及预后评估的应用价值进行综述。
红外热成像;乳腺疾病;早期发现;预后评估
0 引言
乳腺疾病是危害女性健康的常见疾病类型之一,随着生活方式、社会环境等因素的变化,乳腺疾病的发病人数逐渐增多。近年来,据多项统计数据显示乳腺癌发病率和死亡率逐年上升,且发病年龄呈年轻化趋势[1]。国际癌症研究机构数据显示,2018年全球乳腺癌发病率和死亡率仍居女性癌症首位[2]。乳腺恶性疾病的早期发现、早期诊断意义重大,更是降低其死亡率及改善预后的关键。
乳腺疾病的影像学检查方法主要分为结构性影像和功能影像两种,前者主要包括乳腺X线钼靶(mammography,MG)、核磁共振成像(magnetic resonance imaging,MRI)、超声(ultrasound,US),后者主要为红外热成像技术(infrared thermal imaging,IRTI)。乳腺X线钼靶对致密型乳腺病灶的检出敏感性较差,并可带来一定的辐射暴露风险,同时在检查过程中需压迫乳房会给患者带来不适感。MRI的特异性相对较低且价格较昂贵、检查耗时长,不作为常规影像检查。超声是目前国内乳腺检查最常用的影像方法,在判断病灶的性质、位置、大小、数目及血流情况等方面具有独有优势,但极依赖于设备及操作医生的熟练度和诊断经验。红外热成像技术是近几十年兴起的功能成像技术,具有无创、无辐射、快速、灵敏等优点,已被应用于多种疾病的临床辅助诊断,本文主要就红外热成像在乳腺疾病的早期检测及预后评估价值进行综述。
1 IRTI在乳腺成像的应用基础
一般来说,机体任何部位出现病变都是先出现局部组织的代谢异常,而对于恶性肿块或炎症病变,由于糖代谢增快、局部血流量增加、新生血管的形成以及一氧化氮(nitric oxide,NO)和雌激素的生成,局部热辐射也因此出现相应变化,在人体体表表现为温度的升高。在过去的几十年里,越来越多的研究集中于利用红外热像图来获得热生理学和皮肤温度之间的相关性,皮肤表面温度信息已被用于辅助诊断人体的各种疾病,包括外周血管疾病、乳腺癌、糖尿病神经病变、发热筛查、疼痛、皮肤病、妇科疾病、针灸治疗及法医学等[3-4]。IRTI是通过捕捉人体主动辐射的红外能量进而转换成可视的温度图像来反映机体组织器官血供及代谢情况,基于病灶及其周围组织的代谢活性与正常组织不同从而温度不同的原理来判别疾病[5-6]。现代红外热像仪的灵敏度已经可以检测到0.025℃的温差,IRTI作为安全可靠的功能成像方法检测乳腺疾病,其适用人群广,包括所有年龄段女性、孕妇、哺乳期妇女、假体植入者及术后患者,也可用于监测疾病治疗及了解腋窝情况[7]。
2 IRTI检测乳腺疾病的临床应用价值
乳腺疾病严重危害女性身心健康,包括乳腺纤维瘤、乳腺增生、乳腺炎、乳腺囊肿、乳腺癌等。乳腺肿块按性质可分为囊性肿块及实性肿块,因内部成分不同二者的代谢率不同,囊性病变缺乏血液供应不会额外产生热量因此可区分于实性病变。Zare I.和Zadeh等人[8-9]通过对60名疑有乳腺疾病患者的热像图结果与超声、活检结果对比研究,发现IRTI识别实性肿块和囊性肿块的准确性分别为91.89%、92.30%,认为热像图可区分实性低回声肿块和囊性肿块。
乳腺实性肿块中以乳腺癌危害最为严重,癌症细胞的生长不受控制,当癌前细胞及癌细胞快速生长时,为了满足对营养物质及氧气的需求,癌症组织会产生新生血管、局部代谢加快导致相应部位组织温度升高。1956年Lawson首次将IRTI用于乳腺癌的检测,发现病变组织处的皮肤温度高于正常乳腺组织[10]。1963年Lawson和Chughtai分析这是由于癌性组织代谢活动增加产热增多及新生血管生成增加的缘故[11]。基于此原理,有学者就IRTI对乳腺癌发生的预警作用进行了研究。Gautherie等[12]的研究发现约35%热像图异常的健康女性在5年内罹患乳腺癌,认为异常热像图在预测乳腺癌发生中的作用比一级家族史更重要,异常的热像图是未来患乳腺癌风险的最重要的标志。Amalric等人[13]在长达10年的时间里,使用热像仪对61000名女性进行了筛查,结果发现对于60%的病例而言热像图最早提供乳腺癌的信息。也有报道称热像图能够比乳腺X线钼靶提早8~10年预警乳腺癌的发生[14]。以上研究表明,IRTI在预测乳腺癌发生中有一定价值。由于IRTI对乳腺血管成像的独特能力,长期随访可得到非常早期的预警信息,热像图是目前已知最早预测乳腺癌进展的指标。
乳腺癌最常见的热像图特征为乳房温度分布明显不对称,可见局灶性热区,血管形态不规则增粗迂曲,温度梯度可区分良恶性肿瘤,目前多数认为较高的温度梯度(>1℃)可作为恶性肿瘤的判断指标,较低的温度与乳腺良性疾病有关。图1和图2为经活检证实的乳腺癌患者的红外热像图[15-16]。迄今,越来越多的研究证明IRTI可用于乳腺恶性疾病的早期筛查、良恶性判断及辅助诊断。Rassiwala等[17]对1008例20~60岁未诊断为乳腺癌的女性进行IRTI检查,发现IRTI对局部温差超过3℃的乳腺癌具有较高的敏感度和特异度(分别达97.6%、99.17%),阳性预测值和阴性预测值分别为83.67%、99.89%,认为IRTI可作为乳腺癌筛查的有用工具。Sarigoz等[18]将54例触诊有乳腺肿块的患者的IRTI结果与超声、活检结果进行对比,认为IRTI可用于鉴别乳腺肿块的良恶性,其灵敏度和特异度分别为95.24%、72.73%,在乳腺浸润性导管癌、纤维腺瘤及囊肿的鉴别中亦具有一定作用。随着IRTI在乳腺的应用,近年来学者们致力于对图像处理进行技术突破以提高其乳腺癌筛查的能力,Morales-Cervantes等人[19]利用计算机辅助诊断来研究IRTI检测乳腺癌的有效性,提出了利用自动化程序对热像图进行图像分类评分的方法,该研究共纳入206例疑似乳腺癌患者,通过分析病灶处与对侧镜像处乳房的温度差及乳房的血管密度,对比病理结果,发现IRTI的灵敏度可达100%,特异度为68.68%,阳性预测值为11.42%,阴性预测值为100%,再次证实IRTI是一种较好的乳腺癌筛查工具。Ekici等[20]利用贝叶斯算法优化的卷积神经网络(Convolutional Neural Networks,CNNs)对140例乳腺癌女性进行数据分析,将乳腺热像图分为正常或可疑两类,其筛查准确率达到98.95%。以上研究均表明IRTI早期筛查乳腺癌的灵敏度较高,可作为乳腺癌辅助筛查工具用于临床。
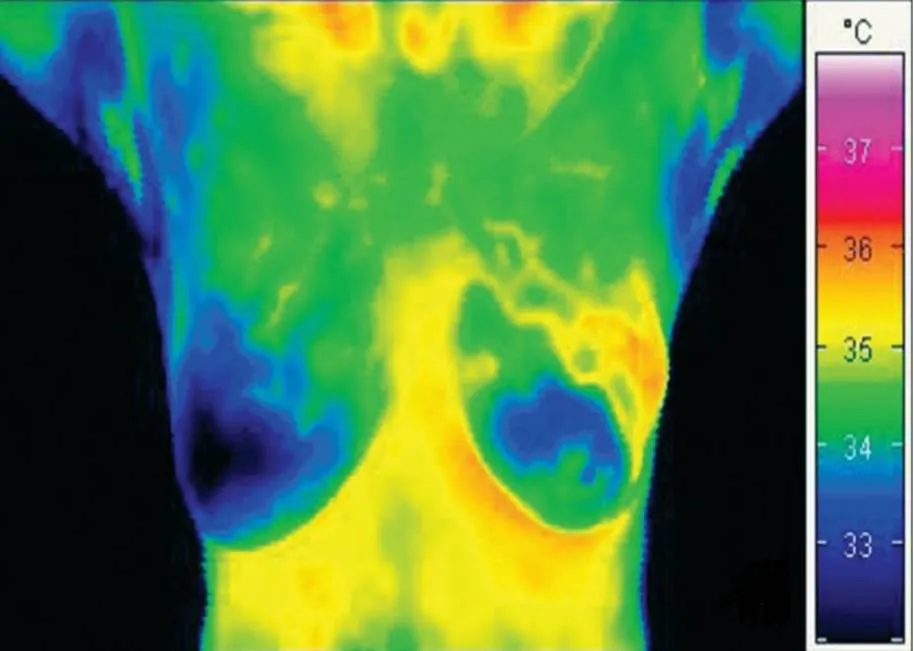
图1 58岁女性右乳腺癌(乳晕下区)热像图
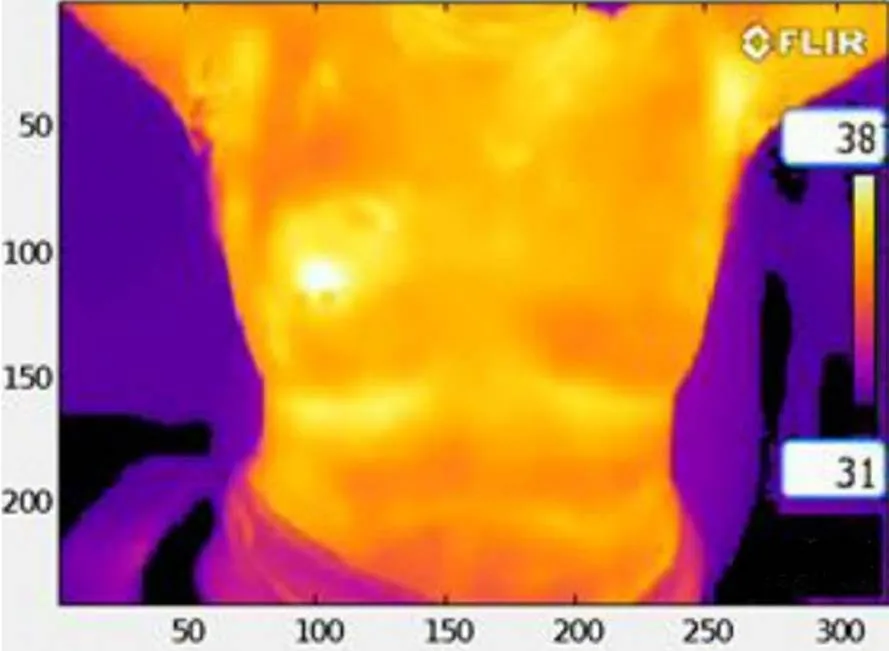
图2 54岁左乳肿块女性,热像图显示左乳外上象限温度高于右乳,活检证实为恶性肿瘤
同时不少学者将IRTI与超声、乳腺X线钼靶对乳腺疾病的诊断有效性进行对比研究来明确其临床实际应用效能。Yao等[21]对2036例乳腺疾病患者行乳腺X线钼靶、超声及IRTI检查,以术后病理结果为标准,发现对于2cm以下的病灶IRTI的准确性高于超声和钼靶(分别为97.1%、95.8%、96.1%),而>2cm的病灶IRTI与超声准确性相当,高于X线钼靶的准确性,因此认为IRTI在乳腺癌大规模人群的早期筛查中具有较高应用价值。Alikhassi等[5]对78例女性患者进行乳腺IRTI与超声对比研究,发现IRTI的灵敏度、特异度和准确率依次为85.7%、78.5%、78.8%,超声的灵敏度、特异度和准确率依次为100%、95.3%、95.5%,在诊断效能上IRTI仍低于超声,认为IRTI仅可作为诊断乳腺恶性病变的辅助手段。Omranipour等[22]则对132名拟行乳腺穿刺活检的患者进行钼靶及IRTI检查,发现二者的灵敏度相差不大(钼靶、IRTI分别为80.5%、81.6%),但钼靶的特异度、阳性预测值、阴性预测值及准确性较IRTI稍高(钼靶依次为73.3%、85.4%、66%、76.9%,IRTI依次为57.8%、78.9%、61.9%、69.7%),认为IRTI虽可用于乳腺癌的早期辅助诊断但不能代替乳腺X线钼靶。而在Kolaric等[23]的研究中IRTI的灵敏度已到达100%,高于X线钼靶的灵敏度(85%)。以上研究虽对IRTI与超声、钼靶的诊断有效性报道不一,但均表明IRTI可用于乳腺恶性病变的辅助诊断,但仍不能作为其他检查方法的替代手段,几种方法联合应用更是有望提高诊断准确率。
目前红外热成像技术作为乳腺癌筛查或辅助诊断工具得到了广泛认可(表1),但仍有部分学者存在不同意见,这主要是由于不同作者研究所得到的IRTI特异性和灵敏度不一致所致。Vreugdenburg等人[24]对7个生物医学数据库进行检索,观察到IRTI灵敏度(0.25~0.97)和特异度(0.12~0.85)的异质性较大,因此认为没有足够证据支持IRTI作为筛查手段。Sajadi等人[25]也得出相似结论,并认为与其他诊断技术相比,热成像诊断价值不高。关于这些报道中结果异质性归因于各项研究中使用的设备性能不同,以及用于将红外热图分类为正常或疾病的算法的差异,同时作者也指出纳入的部分文献的研究质量或研究方法不理想,另外可能遗漏部分研究,因此需谨慎对待其结果。
3 IRTI在乳腺癌预后评估中的价值
随着分子生物学研究的不断进展,乳腺癌发生、发展及预后与各种分子生物学指标的关系已得到证实,乳腺癌相关预后因子在指导个体化诊断、治疗方案选择、疗效检测及预后判断方面有重要意义。其中,最常用的预后因子是雌激素受体(estrogen receptor, ER)、孕激素受体(progesterone receptor, PR)和人类表皮生长因子受体-2(human epidermal growth factor receptor-2, HER-2)。ER阴性、PR阴性和HER-2阳性的肿瘤侵袭性较强,生长速度快,需要更多新生血管生成供应其生长,从而导致局部温度升高。同时雌激素及孕激素可扩张周围血管,并可通过增加NO的生成调节血管舒张,引起整个乳房温度的改变。国外学者已经就乳腺癌的红外热成像与组织病理学、免疫组化因子的相关性展开了研究以明确IRTI在预测乳腺癌预后的价值。Wang J.等[26]通过对163名乳腺癌患者共171例病灶的红外热像图特征与激素受体表达情况关系的研究发现,乳腺癌病灶区与镜像部位的温差与ER、PR表达呈负相关,同侧乳房病灶部位与相邻正常乳腺组织温差与PR表达呈负相关,而HER-2与热像图特征无相关性。Zore等人[27-29]的几项研究表明ER-、PR-、HER-2+肿瘤病灶部位的温度较ER+、PR+、HER-2-肿瘤高,ER阴性对乳房整体温度升高的影响较小,ER+患者患侧乳房的温度高于ER-患侧乳房。Mance等人[30]的研究也发现ER+和PR+肿瘤的温度较高,而HER-2与乳腺温度无相关性。以上研究表明激素受体表达情况与热像图之间有一定相关性,可通过热像图表现初步评估患者预后。然而,另外有研究却认为激素受体表达情况与红外热像图之间并无关联,但与生长速度相关的预后指标与热图密切相关[31-32]。Ohsumi等[33]利用IRTI对340例无远处转移的单侧浸润性乳腺癌患者进行预后评估,分析肿瘤部位与其对侧镜像部位的温差D与各因素的关系,发现D虽与雌激素受体表达情况无关,但却与肿瘤大小、组织学状态、核分级显著正相关,对于淋巴结阳性的乳腺癌患者,D可作为判断预后的有用指标。以上多项研究表明乳腺癌激素受体表达情况与热像图的关系尚无一致结论,但由于目前该方面相关研究文献较少,因此红外热成像技术是否可用于评估乳腺癌预后尚需更多的深入研究以明确其临床应用价值。
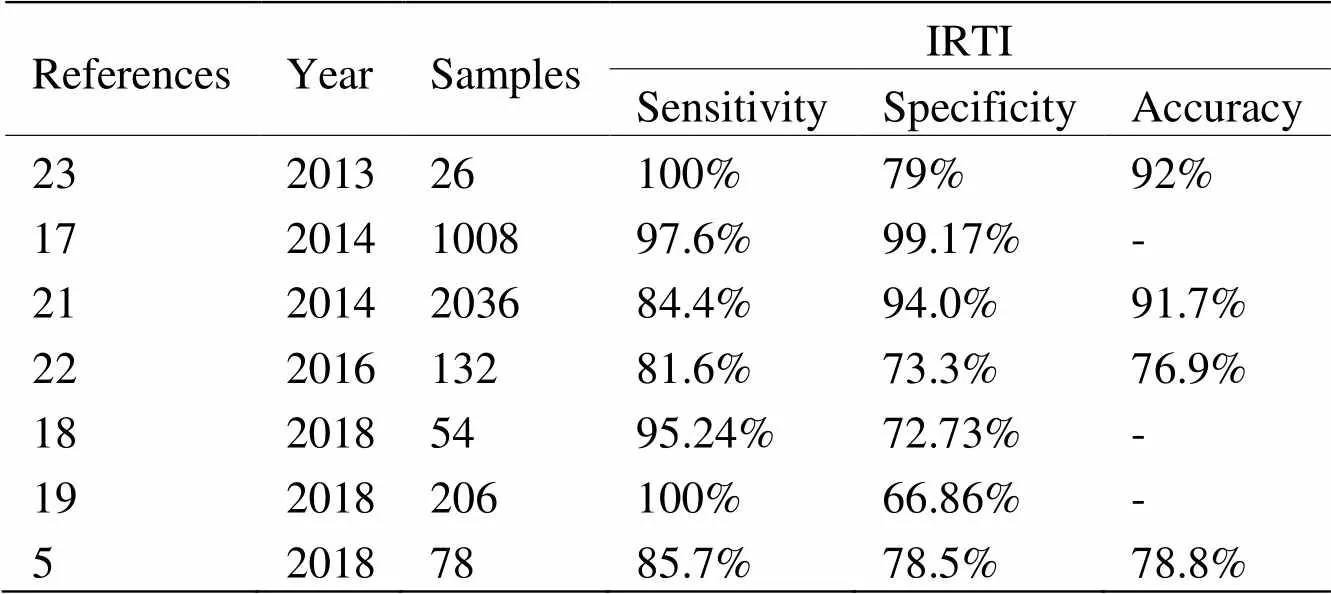
表1 IRTI检测乳腺癌效能结果
4 乳腺肿瘤特点对IRTI成像的影响
体表温度易受环境和个体因素影响,如血管及生物活性的变化、组织传导的改变、内分泌因素。目前研究认为在对检测环境和受检人员进行质控后,乳腺肿瘤的红外热像图主要受肿瘤自身特性影响,如肿瘤的大小、深度、血流丰富程度和组织学特征等。Yan Zhou和Herman[34]利用COMSOL软件评估了二维乳腺模型中不同肿瘤位置和大小的表面热对比度,发现肿瘤的大小和深度是影响热成像最大热对比度的最主要因素。Mance等[30]对50名经活检确诊为乳腺导管癌的女性分析发现,病变乳腺温度与肿瘤体积呈正相关,与肿瘤深度呈负相关。Gonzalez等[35]通过建立乳腺及癌性肿瘤简化模型表明IRTI可检测到距离皮肤7cm以上的3cm的肿瘤,而对于小于0.5cm的肿瘤仅距离皮肤表面较近时才能被检测到。Jiang等人[36]的研究则发现皮肤温度的改变通常只能在深度小于20mm的浅表肿瘤中发现。肿瘤深度小于20mm时可使健乳与患乳温差增加1.5℃,深度在20mm以上时其引起的表面温度差异不明显,相对于肿瘤直径,深度对温度的影响更大。也有研究证实IRTI对直径2cm以下的肿瘤灵敏度高于其他影像学方法[21]。Kandlikar等[37]也得出相似结论认为肿瘤深度是影响表面温度的主要因素。而皮肤温度受皮肤血流量的影响,肿瘤周围组织温度也与肿瘤微血管密度正相关[38]。这些研究说明乳腺病灶表面温度主要与肿瘤位置和大小有关,相对于肿瘤直径,肿瘤深度对乳腺表面温度的影响更大,对于一定深度的肿瘤,红外热像图对其显示不佳,随着肿瘤靠近体表,皮肤表面的热对比度增大。
5 总结及展望
作为功能成像技术,红外热成像已成为乳腺疾病检查的新方法,可较早发现异常病变,在一定程度上弥补了结构影像学的不足。尽管红外热成像作为乳腺疾病早期筛查的工具具有较高临床应用价值,但仍不能代替现有的乳腺疾病检查技术。与此同时,因其具有操作简单、价格便宜、成像直观易于解读、精确灵敏等优点,适用于大规模的人群乳腺癌筛查,而我国人口基数大、人均收入普遍较低,许多基层医院诊断手段不足导致乳腺癌患者不能早期得到有效治疗而延误病情,红外热成像的应用可以提高基层医院的医疗诊断水平,帮助乳腺癌的早期发现,尤其对经费不足但同时需要提高医疗水平的中、小型医院更是值得推广。
[1] 师金, 梁迪, 李道娟, 等. 全球女性乳腺癌流行情况研究[J]. 中国肿瘤, 2017, 26(9): 683-690.
SHI Jin, LIANG Di, LI Daojuan, et al. Epidemiological Status of Global Female Breast Cancer[J]., 2017, 26(9): 683-690.
[2] Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]., 2018, 68(6): 394-424.
[3] Lahiri B B, Bagavathiappan S, Jayakumar T, et al. Medical applications of infrared thermography: a review[J]., 2012, 55(4): 221-235.
[4] Figueiredo A, Do N J, Malheiros F C, et al. Breast tumor localization using skin surface temperatures from a 2D anatomic model without knowledge of the thermophysical properties[J]., 2019, 172: 65-77.
[5] Alikhassi A, Hamidpour S F, Firouzmand M, et al. Prospective comparative study assessing role of ultrasound versus thermography in breast cancer detection[J]., 2018, 37(4): 191-196.
[6] De Jesus G R, Oliveira L L V M, Das N L, et al. Accuracy and Reliability of Infrared Thermography in Assessment of the Breasts of Women Affected by Cancer[J]., 2017, 41(5): 87.
[7] Milosevic M, Jankovic D, Milenkovic A, et al. Early diagnosis and detection of breast cancer[J]., 2018, 26(4): 729-759.
[8] Zare I, Ghafarpour A, Zadeh H G, et al. Evaluating the thermal imaging system in detecting certain types of breast tissue masses[J]., 2016, 27(3): 670-675.
[9] Zadeh H G, Haddadnia J, Ahmadinejad N, et al. Assessing the potential of thermal imaging in recognition of breast cancer[J]., 2015, 16(18): 8619-8623.
[10] LAWSON R. Implications of surface temperatures in the diagnosis of breast cancer[J]., 1956, 75(4): 309-311.
[11] Lawson R N, Chughtai M S. Breast Cancer and Body Temperature[J]., 1963, 88(2): 68-70.
[12] Gautherie M. Thermobiological assessment of benign and malignant breast diseases[J]., 1983, 147(8): 861-869.
[13] Amalric R, Giraud D, Altschuler C, et al. Does infrared thermography truely have a role in present day breast cancer management?[J]., 1982, 107: 269-278.
[14] Ng E Y, Ung L N, Ng F C, et al. Statistical analysis of healthy and malignant breast thermography[J]., 2001, 25(6): 253-263.
[15] Prasad S S, Ramachandra L, Kumar V, et al. Evaluation of efficacy of thermographic breast imaging in breast cancer: A pilot study[J]., 2016, 36(4): 143-147.
[16] Umadevi V, Raghavan S V, Jaipurkar S. Framework for estimating tumour parameters using thermal imaging[J]., 2011, 134(5): 725.
[17] Rassiwala M, Mathur P, Mathur R, et al. Evaluation of digital infra-red thermal imaging as an adjunctive screening method for breast carcinoma: A pilot study[J]., 2014, 12(12): 1439-1443.
[18] Sarigoz T, Ertan T, Topuz O, et al. Role of digital infrared thermal imaging in the diagnosis of breast mass: A pilot study Diagnosis of breast mass by thermography[J]., 2018, 91: 214-219.
[19] Morales-Cervantes A, Kolosovas-Machuca E S, Guevara E, et al. An automated method for the evaluation of breast cancer using infrared thermography[J]., 2018, 17: 989-998.
[20] Ekici S, Jawzal H. Breast Cancer Diagnosis Using Thermography and Convolutional Neural Networks[J]., 2020, 137: 109542.
[21] YAO X, WEI W, LI J, et al. A comparison of mammography, ultrasonography, and far-infrared thermography with pathological results in screening and early diagnosis of breast cancer[J]., 2014, 8(1): 11-19.
[22] Omranipour R, Kazemian A, Alipour S, et al. Comparison of the Accuracy of Thermography and Mammography in the Detection of Breast Cancer[J]., 2016, 11(4): 260-264.
[23] Kolarić D, Herceg Ž, Nola I A, et al. Thermography–a feasible method for screening breast cancer?[J]., 2013, 37(2): 583-588.
[24] Vreugdenburg T D, Willis C D, Mundy L, et al. A systematic review of elastography, electrical impedance scanning, and digital infrared thermography for breast cancer screening and diagnosis[J]., 2013, 137(3): 665-676.
[25] Sajjadi H S, Seyedin H, Aryankhesal A, et al. A systematic review on the effectiveness of thermography in diagnosis of diseases[J]., 2013, 23(2): 188-193.
[26] WANG J, Shih T T, Yen R, et al. The Association of Infrared Imaging Findings of the Breast with Hormone Receptor and Human Epidermal Growth Factor Receptor 2 Status of Breast Cancer[J]., 2011, 18(2): 212-219.
[27] Zore Z, Boras I, Stanec M, et al. Influence of hormonal status on thermography findings in breast cancer[J]., 2013, 52(1): 35-42.
[28] Zore Z, Filipović-Zore I, Stanec M, et al. Association of clinical, histopathological and immunohistochemical prognostic factors of invasive breast tumors and thermographic findings[J]., 2015, 68: 201-205.
[29] Zvonimir Z, Ivanka B, Irina F, et al. The impact of human epidermal growth factor receptor-2 status of invasive breast tumors on thermography findings[J]., 2012, 33(10): 1118-1121.
[30] Mance M, Bulic K, Antabak A, et al. The influence of size, depth and histologic characteristics of invasive ductal breast carcinoma on thermographic properties of the breast[J]., 2019, 18: 549.
[31] Sterns E E, Zee B, SenGupta S, et al. Thermography. Its relation to pathologic characteristics, vascularity, proliferation rate, and survival of patients with invasive ductal carcinoma of the breast.[J]., 1996, 77(7): 1324-1328.
[32] Head J F, Wang F, Elliott R L. Breast thermography is a noninvasive prognostic procedure that predicts tumor growth rate in breast cancer patients[J]., 1993, 698: 153-158.
[33] Ohsumi S, Takashima S, Aogi K, et al. Prognostic Value of Thermographical Findings in Patients with Primary Breast Cancer[J]., 2002, 74(3): 213-220.
[34] ZHOU Y, Herman C. Optimization of skin cooling by computational modeling for early thermographic detection of breast cancer[J]., 2018, 126: 864-876.
[35] Gonzalez F J. Infrared imager requirements for breast cancer detection[C]//, 2007: 3312-3314.
[36] JIANG L, ZHAN W, Loew M. Combined thermal and elastic modeling of the normal and tumorous breast[C]//, 2008: 6916.
[37] Kandlikar S G, Perez-Raya I, Raghupathi P A, et al. Infrared imaging technology for breast cancer detection – Current status, protocols and new directions[J]., 2017, 108: 2303-2320.
[38] Yahara T, Koga T, Yoshida S, et al. Relationship between microvessel density and thermographic hot areas in breast cancer[J]., 2003, 33(4): 243-248.
Application of Infrared Thermal Imaging in Breast Disease Detection
ZENG Jingni,DENG Fangge
(National Clinical Research Center for Respiratory Disease, State Key Laboratory of Respiratory Disease, Guangzhou Institute of Respiratory Health, The First Affiliated Hospital of Guangzhou Medical University, Guangzhou 510120, China)
Breast diseases are a threat to the physical and mental health of women. The occurrence of breast cancer and mortality resulting from it ranks the highest among cancer cases in women. Hence, early detection and diagnosis of breast cancer becomes extremely important. Traditional structural imaging has some limitations in early detection of diseases, while infrared thermal imaging, as a functional imaging technology, can provide effective clues for early screening of breast cancer. This work mainly reviews the usefulness of employing infrared thermal imaging in the early detection and prognosis evaluation of breast diseases.
infrared thermal imaging, breast disease, earlydetection, prognosis evaluation
R445.7;R737.9
A
1001-8891(2020)05-0501-05
2019-12-17;
2020-05-01.
曾靓妮(1993-),女,湖南省邵阳市人,硕士研究生,主要从事超声诊断及红外热成像临床应用,E-mail:1197141269@qq.com。
邓方阁(1971-),女,博士后,教授,主要从事红外热成像与临床应用,E-mail:parisdeng256@163.com。

