腹部局限型Castleman病的超声表现分析
王 群,黄备建,陆蓓蕾,李翠仙 ,徐亚丹,袁 伟,王文平
1.复旦大学附属中山医院超声科,上海 200032;
2.上海市影像医学研究所,上海 200032;
3.复旦大学附属中山医院病理科,上海 200032
Castleman病(Castleman’s disease,CD)又称巨淋巴结增生,为一种罕见的、原因不明的、以肿大淋巴结为特点的介于良恶性之间的不典型淋巴组织增生性疾病,由Castleman于1956年首先报道,并以其名字命名[1]。CD按临床类型分为局限型CD(local Castleman’s disease,LCD)及多中心型CD(multiple Castleman’s disease,MCD)。国内外对腹部LCD的CT及磁共振成像(magnetic resonance imaging,MRI)报道相对较多,而关于其超声声像图表现特征报道少见。按照Frizzera[2]制定的CD的诊断标准,本研究收集了25例经复旦大学附属中山医院病理科明确诊断为腹部LCD的患者,分析其超声声像图特点,以期提高对该病的认识和术前诊断准确率。
1 资料和方法
1.1 研究对象
分析总结2011年7月—2019年11月于复旦大学附属中山医院病理科行超声检查并经病理学确诊为腹部LCD的25例患者的超声声像图资料,其中3例患者行超声造影(contrast-enhanced ultrasound,CEUS)。男性12例,女性13例;年龄19~81岁,平均年龄(44.6±14.8)岁。就诊原因分别为体检发现14例,腹痛、腰背痛、外伤各2例,上腹部饱胀、上腹部触及肿块、血尿、四肢瘀斑、双下肢水肿各1例。
1.2 仪器与方法
采用美国GE公司的LOGIQ E9、荷兰Philips公司的EPIQ7、意大利Esaote公司的MyLab Twice等彩色多普勒超声诊断仪,探头频率为3.5~5.0 MHz,均配有实时灰阶谐波CEUS软件。检查时取仰卧位或左右侧卧位,先用常规灰阶超声多切面详细观察肿块的声像图特征,包括位置、回声、大小、边界、形态和内部结构等,再用彩色多普勒血流显像(color Doppler flow imaging,CDFI)观察肿块的血流分布情况,并用频谱多普勒超声检测肿块的阻力指数(resistent index,RI)。采用意大利Bracco公司生产的声诺维(SonoVue),使用前注入5 mL 0.9%的NaCl溶液振荡摇匀,造影时每次抽取2.0 mL,经前臂肘静脉呈弹丸式注射,然后迅速注入5 mL 0.9%的NaCl溶液冲管。采用低声压扫查,机械指数<0.1。CEUS时选择病灶的合适切面进行并记录全过程,然后在造影模式下观察CEUS表现,包括开始增强时间、达峰时间、开始减退时间、增强方式、峰值期表现及延迟期表现等。本研究行CEUS的3个病灶均位于腹部,缺乏相应的参照物,故选择距离其较近的脏器作为参照,1例以肝脏作为参照物,2例以肾脏作为参照物。根据造影剂到达、退出病灶与肝肾实质的时间,分别将病灶早于肝肾实质增强设定为快速增强,与肝肾实质同时增强设定为同步增强,晚于肝肾实质增强设定为缓慢增强,与肝肾实质同时减退设定为同步减退,快于肝肾实质减退设定为快速减退,慢于肝肾实质减退定为缓慢减退,达峰值时病灶的强化程度高于、等于、低于肝肾实质分别称之为高回声、等回声、低回声。
1.3 统计学处理
本组中数据处理采用SPSS 20.0统计学软件,计量资料采用±s进行统计描述,计数资料采用率和百分比进行统计描述。
2 结 果
2.1 常规超声
本组中的25例LCD肿块最大径线18~110 mm,平均(61.9±24.1)mm;病灶边界清晰23例(92%),欠清1例(4%),不清1例(4%);17例形态规则(68%),5例欠规则(20%),3例不规则(12%);19病灶表现为低回声(76%),5例为混合回声(20%),1例为高低不均质回声(4%);回声均匀5例(20%),欠均匀8例(32%),不均匀12例(48%);内部有点状及细线状高回声11例(44%)(图1A),内部有钙化灶13例(52%)(图1B),内部有囊性区6例(24%),同时伴有点状、细线状高回声及钙化灶的有4例(16%),同时有钙化灶及囊性区有5例(20%)(图1C);16例病灶内部及(或)周边有丰富线状彩色血流(64%),其中有5例测及粗大血管自肿块边缘切迹处进入内部并分支(图1D),类似淋巴门样血流,2例内部有少量短线状彩色血流(8%),1例周边有少量点状彩色血流(4%),6例无明显彩色血流(24%);11例病灶内测及RI,RI<0.6有7例,RI>0.6有4例。
2.2 CEUS
3例患者的CEUS表现见表1,这3个病灶的CEUS表现相同点为增强早期造影剂均快速进入肿块内部,其中1例病灶中央有小片状始终未增强区(图2)。
2.3 病理学检查
本研究患者中有24例病灶位于腹膜后,1例位于肾盂,其中透明血管型17例(68%,图3A),浆细胞型7例(28%,图3B),混合型1例(4%,图3C)。
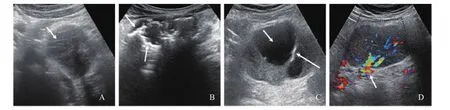
图1 典型病例1~4的超声声像图及CDFI表现

表1 CEUS表现特征
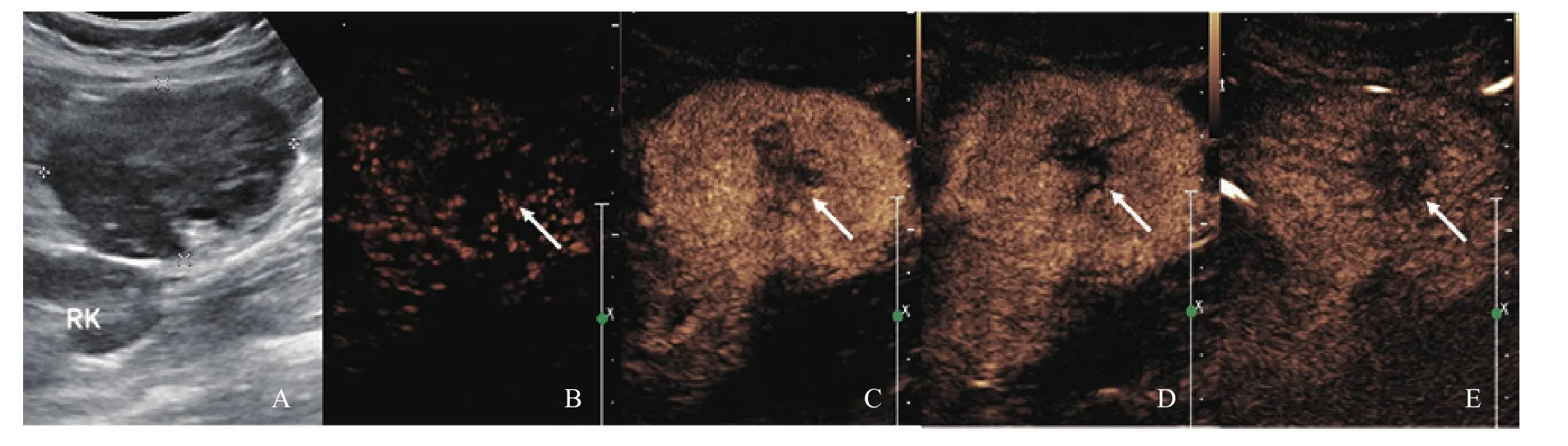
图2 病例5(患者,女性,32岁)的超声声像图及CEUS表现
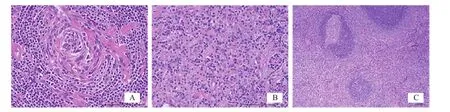
图3 多例典型病例的病理组织图
3 讨 论
CD的发病诱因及发病机制尚不完全明确,多数学者认为白细胞介素-6(interleukin-6,IL-6)的异常表达、人类8型疱疹病毒(human herpes virus-8,HHV-8)感染、人类免疫缺陷病毒(human immunodeficiency virus, HIV)感染为CD的主要发病机制,其中IL-6为CD发病最为密切相关的细胞因子[3]。确诊CD主要依靠病理学检查,按病理学类型分为透明血管型、浆细胞型及混合型,其中以透明血管型最常见。LCD以透明血管型多见,占80%~90%[4],本组透明血管型仅占68%,可能与本研究患者病例数较少有关。CD主要病理学改变是具有完整的淋巴组织结构、淋巴滤泡增生及小血管肿瘤样增生,不同病理学类型的CD具有不同的显微镜镜下特征性表现。透明血管型镜下特征为“洋葱皮”样或“棒棒糖”样结构,“洋葱皮”样结构是由于大量增生的淋巴滤泡周围见紧密呈同心圆状排列的淋巴细胞环绕着一个或多个退行性转化的生发中心而形成;“棒棒糖”样结构是由于淋巴滤泡间部分发生玻璃样变性或纤维化的小血管穿入退行性转化的生发中心内形成。浆细胞型镜下特征表现为生发中心萎缩,淋巴滤泡间有大量弥漫性增生的成熟浆细胞,但是淋巴滤泡间无明显玻璃样变性的小血管,代之以滤泡中心无定型的嗜酸性物质沉积。镜下同时具有这两种特征表现的为混合型。免疫组织化学法检测在CD的诊断中无显著特异性,但在其病理学分型上有一定的鉴别诊断价值,一般CD20(+)、CD34(+)、CD21(+)、Ki-67标记指数<10%常提示为透明血管型,而CD38(+)、CD138(+)、Ki-67标记指数>10%常提示浆细胞型。
CD可发生于全身任何部位,有文献报道[5]CD最常见的发病部位为胸腔纵隔内,发生于腹部的较少见,发生于腹部的多位于腹膜后,极少数亦可见于肾脏、肌肉等。LCD一般起病隐匿,病程长短不一,各年龄段均可发病,以中青年多见,男女发病率无明显差异。实验室检查多正常也有异常,实验室指标特异度低。多数患者为体检发现,部分患者为触及身体肿块,或因肿块过大压迫邻近脏器引起相应症状于入院检查后发现,由于腹膜后组织疏松,给肿瘤的生长提供了较大的空间,因此这类患者发现时病灶体积已经较大。临床上LCD以透明血管型为主,一般无明显的临床症状,预后较好;浆细胞型可有贫血、发热、腹痛、肝脾肿大等症状,且浆细胞型常为多中心型,此型预后较差,但局限的浆细胞型预后较好;混合型少见。LCD无论哪种病理学类型,手术均为最佳治疗手段,绝大部分通过手术切除病灶能够治愈,对于手术不能完全切除的病灶或无法耐受手术的患者可选择放疗、化疗、激素治疗等,但治疗效果各异。无论术中病灶是否完整切除,LCD均罕见复发,但由于CD可能会诱发淋巴系统或血液系统疾病,因此术后需要长期随访。
本研究患者中的病灶多表现为边界清晰、形态规则、椭圆形或类圆形的低回声肿块,其中有20例肿块内部回声欠均匀或不均匀,这与陈路增等[6]的报道并不一致,原因可能为本组病灶均集中于腹部且病灶较大,相较于浅表部位的LCD,腹膜后病灶内部的毛细血管壁更易发生退变。11例肿块内部有点状及细线状高回声,13例肿块内部有钙化,其中多发粗大线状钙化有6例,病灶内部同时伴有点状、细线状高回声及钙化的有4例,且这4例均为透明血管型。有学者[7]认为,这些肿块内部的高回声为束状、结节样纤维组织及发生玻璃样变性的血管结构。病理学检查证实,钙化组织主要位于小血管发生透明变性的部位,其病理学基础可能为毛细血管壁增厚的同时伴有玻璃样变性、纤维化变性等退行性改变,钙质沿着退变的毛细血管壁沉积形成了钙化。有学者[8]认为,钙化为LCD的特征性表现,且大多见于透明血管型,这与本组结果相仿。本组患者中有6例肿块内部有囊性区,其中5例内部同时伴有钙化灶,病理学分型均为透明血管型。这6例含囊变区的肿块中有5例血流丰富,另1例周边有少量点状彩色血流。Germaine等[9]认为,LCD肿块内部的囊性区为淋巴窦及淋巴管扩张形成的。回顾既往文献绝大多数腹部LCD肿块内部无囊性区,主要观点是由于肿块内部有较丰富增生的毛细血管及较好的侧支循环,肿块血供丰富,不易发生缺血坏死。笔者认为,对于腹部单发同时伴有囊性区及钙化的血流丰富的肿块,应考虑到LCD的可能性,且更倾向为透明血管型,但由于本研究患者病例数较少,这是否为腹部透明血管型LCD的超声声像图特征性表现还有待将来进一步研究。
本组患者中有16例病灶CDFI测及肿块丰富彩色血流,其中有5例测及粗大血管自肿块边缘切迹处进入内部并分支,与正常形态的淋巴结血流特征相似。既往文献中的LCD所纳入的病灶分布于全身各个部位,多位于胸腔纵隔内或外周浅表软组织内,而位于腹部者罕见。本组研究中所纳入的病灶皆位于腹部,且绝大多数位于腹膜后,由于肿块位置较深且腹腔内的脏器及血管结构复杂,相较于浅表软组织内的LCD,部分位于腹部的LCD病灶,尤其是小病灶,超声检查不能充分地显示病灶的血供特点,这与刘娜香等[10]的研究结果不同。
倪贤伟等[11]报道了1例腹膜后混合回声的病理学类型为透明血管型LCD的CEUS表现,称其类似于“肝血管瘤”的增强表现。本组患者中仅有3例患者做了CEUS检查,这3例CEUS表现相同点为增强早期造影剂均快速进入肿块内部;达峰值时表现各不相同,分别为始终低、不均匀强化、始终高;达峰值后1例病灶快速减退,2例病灶缓慢减退;延迟期有2例病灶呈低回声,1例呈稍高回声伴中央小片状始终未增强区。由于本研究所纳入的CEUS患者数较少,其CEUS表现特征有待将来进一步研究。
尽管本组病灶超声均能于术前检查发现,但均未在术前明确诊断为LCD,绝大多数考虑为腹膜后来源的良性或恶性病变,究其原因可能与CD的发病率低、临床少见、容易误诊及无典型超声声像图表现有关。目前国内外关于腹部LCD的超声研究报道较少见。本研究的不足之处主要为患者数量较少,而CEUS患者数更少,因此需要更多样本量来研究其常规超声及CEUS的表现,以提高超声对腹部LCD的术前诊断准确率。
腹部的局限型CD需要与以下疾病鉴别:① 淋巴瘤,单发的腹腔淋巴瘤回声往往比LCD更低一些,常为弱回声或无回声团块,肿块内部一般没有钙化灶及囊性区,CDFI示肿块内部多血流丰富,且淋巴瘤常为全身多发病灶,部分肿块之间可见相互融合,这有利于二者鉴别。② 副神经节瘤(paraganglioma,PGL),多发生于有副神经节聚集的部位,原发于腹膜后的副神经节瘤仅占腹膜后肿瘤的1.88%[12]。有功能的副神经节瘤最常见的临床表现为高血压,头痛、出汗、心悸、面色苍白等亦为较常见的症状。③ 脂肪肉瘤(retroperitoneal liposarcoma,RPLS):高分化型RPLS表现为高回声或高回声为主的肿块,低分化型RPLS表现为低回声或低回声为主的肿块,RPLS肿块边界多较清晰,但形态多不规则,肿块内部一般无囊性区及钙化灶,CDFI示肿块血流多不丰富[13]。
综上所述,腹部边界清晰、形态规则、内部回声欠均匀或不均匀、血供丰富的低回声肿块,出现囊性区及钙化灶应想到腹盆部LCD的可能。肿块内点状、细线状高回声或钙化灶,尤其为粗大线状钙化灶及肿块血供呈淋巴门样为相对特异性的超声声像图特征。必要时可以在超声引导下经皮穿刺活检,以提高其术前诊断的准确率。

