多酚氧化酶的分离纯化及生理功能的研究进展
韩倩云,王坤立,温馨,王笑园,吴嘉斓,倪元颖*
1. 中国农业大学食品科学与营养工程学院(北京 100083);2. 国家果蔬加工工程技术研究中心(北京 100083)
多酚氧化酶(Polyphenol oxidase,PPO)是一类广泛存在于动物、植物、细菌和真菌体内的铜结合酶,在食品工业、医药工业、废水处理等领域有着重要应用。在有氧的条件下,多酚氧化酶能将组织中内源性酚类物质氧化成邻醌,醌类物质聚合并与细胞内蛋白质氨基酸结合,形成黑色或褐色物质从而导致组织褐变[1]。除此之外,多酚氧化酶能够保护生物体免受生物和非生物胁迫[2]。由于多酚氧化酶基因家族及其表达的复杂性,使得不同来源及同一品种不同类型多酚氧化酶的性质差异显著。拟综述多酚氧化酶的分离提取方法,比较不同来源PPO的生理特性,以期为深入研究多酚氧化酶与酶促褐变提供参考。
1 PPO的来源与功能
多酚氧化酶是引起果蔬酶促褐变的主要内源性酶,细胞化学和细胞免疫化学分析发现多酚氧化酶是一种质体酶,存在于正常细胞的光合组织(如叶绿体内囊体的囊泡)和非光合组织质体中(如马铃薯块茎细胞的造粉体)[3-4]。植物在细胞质中合成PPO前体,通过两个步骤将PPO运输到叶绿体中,首先依靠N末端的转运肽将高分子量的PPO导入叶绿体基质,利用基质肽酶将转运肽切除,随后依赖光的作用将PPO导入类囊体中成为一个较低分子量的成熟酶蛋白[5-7]。所有位于叶绿体内PPO的特征是前体蛋白必须含有转运肽,通过基质肽酶的切除,以使PPO到达叶绿体中的指定位置并进行表征[8]。大量研究表明,前体和成熟态PPO的分子量分别约为68和60 kDa,其比例受到植物的种类、年龄和生长条件等多种因素的影响[6]。褐变通常是由多酚氧化酶引起的,随后是由衰老、损伤、病虫害和病原体的侵袭造成细胞损伤。多酚氧化酶通过两个氧化步骤将酚类物质转化为邻醌,第一步是现有的羟基发生邻位羟基化(“单酚氧化酶”或“单酚酶”活性,也称为羟化酶或甲酚酶活性),第二步是邻二羟基苯氧化为邻苯醌(“二酚氧化酶”或“二酚酶活性”,也称为儿茶酚酶或氧化酶活性)[6,9]。根据特定底物及其作用机理,多酚氧化酶可分为三类:酪氨酸酶、儿茶酚氧化酶和漆酶。酪氨酸酶具有甲酚酶和儿茶酚酶活性;儿茶酚酶也称为双酚氧化酶,能将邻二酚催化氧化为邻醌;漆酶则通过自由基催化反应机制氧化一系列芳香族化合物。多酚氧化酶一般是指儿茶酚氧化酶和漆酶的统称[1]。当植物体受到外界压力、伤害、病原体或食草动物侵袭时,也可以诱导PPO的活动水平[10-12]。
2 PPO的提取和纯化
基于酶活性、纯化倍数、蛋白浓度和酶的应用,产生了一系列的分离纯化方法。在大多数的研究中,一般采用盐沉淀法、温度诱导分离法和色谱法对PPO进行提取和纯化。三相分离、双水相萃取、等电点沉淀法、圆盘电泳等新方法也被逐渐采用。以下列出的大多数方法都与酶的提取效率相关。
2.1 表面活性剂的使用
表面活性剂可以在水溶液中加速胶束的形成,胶束具有疏水性核心区域,可用于大部分酚类、脂类、单宁类和非极性蛋白质的提取[9]。在粗酶液的提取中,Triton X-114是最常见的一种非离子表面活性剂,它不仅提供一个温和的蛋白溶解环境而且避免蛋白质发生变性。通过后续的离心步骤可以清除表面活性剂,亲水性蛋白也能被快速分离。如表1所示,添加1.5%~4%的Triton X-114或Triton X-100可以提高纯化倍数,提取效率与表面活性剂的电荷和疏水性指数有关[13-16]。非离子型表面活性剂如Triton X-114具有较低的疏水性指数,与离子型表面活性剂相比效率更高[17]。添加表面活性剂的提取方法不仅工艺简单、耗时短,还可以最大限度地去除酚类物质来提高PPO的稳定性。
双水相萃取和三相分离法作为一种简单经济的操作方法,可同时进行生物大分子的提取和纯化[18]。双水相萃取是以水溶性聚合物、盐-聚合物或盐-醇的方式形成不同的两相,三相分离法是将硫酸铵等盐类和丁醇等水溶性醇类物质添加到提取液中形成三相[19]。这两种方法在PPO的分离中可以提高纯化效率,但是提取过程中聚合物不能被很好地回收利用,在PPO分离纯化的相关文献中很少被报道[20]。
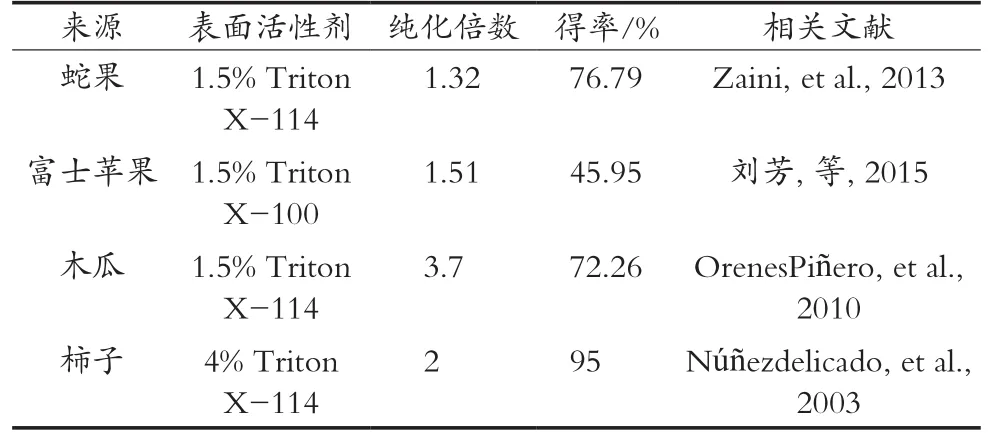
表1 表面活性剂对不同来源PPO提取的影响
2.2 溶剂沉淀法
溶剂法的目的是用于沉淀蛋白。常用的有机溶剂有乙醇和丙酮,该方法直接应用于匀浆混合物。有机溶剂能将PPO从不同缓冲液中分离出来,由于它们会导致蛋白质结构的变化且通常需要在非常低的温度下(-20 ℃)进行[21],所以有机溶剂沉淀法的应用范围有限。硫酸铵盐是目前最常用的蛋白质沉淀剂[22-24]。蛋白质表面有亲水和疏水区域,过量添加硫酸铵盐会增加其表面张力从而增加蛋白质的疏水相互作用,使其发生沉淀,这种现象称为盐析作用[25]。不同分子量大小的蛋白质所需的硫酸铵沉淀浓度不同,大多数研究结果表明50%~85%的硫酸铵盐浓度用于提取PPO的效果最佳[26-30](表2)。盐析作用虽然会导致蛋白质构象的变化,但不会使蛋白质发生变性。为了保持酶活性,提取过程通常是在较低(4 ℃)温度条件下进行的,后续的试验中可通过添加SDS来提高酶活性[13]。
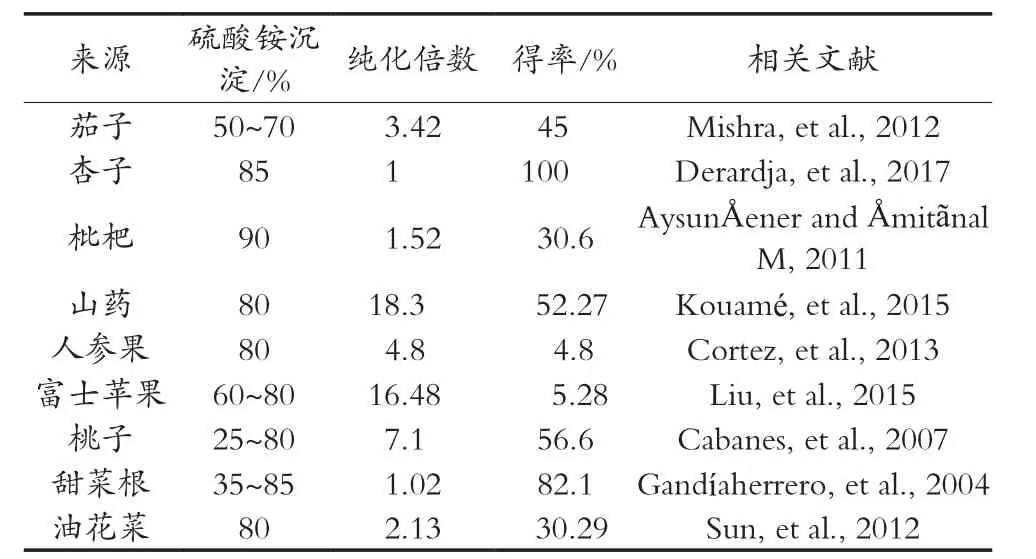
表2 硫酸铵沉淀对不同来源PPO提取的影响
2.3 色谱法
蛋白质分子由于自身性质的特殊性,可通过色谱的方法进行纯化。常用的色谱方法主要有离子交换色谱(IEX)、凝胶过滤(GF)、疏水相互作用(HIC)、反相色谱(RPC)和亲和色谱(AC)等[31]。色谱法的选择取决于多酚氧化酶的类型、电荷、分子量和杂质等。为了获得高纯度的目的蛋白,通常会将两种或两种以上的色谱法相结合进行操作[32-33]。如表3所示,通过离子交换色谱和凝胶过滤色谱,山药、花椰菜、人参果中PPO的纯化倍数分别提高了76.2,66和51倍[23-24,34],富士苹果PPO仅用了一种色谱法,其纯化倍数也提高了64.3倍[25],说明利用色谱法可以有效纯化多酚氧化酶。为了保证酶活性,大部分试验选择pH在6~8范围内的洗脱液,通过逐步的线性梯度洗脱以减少蛋白酶的损失。在进行色谱法之前,采用温度诱导分离法和双水相等提取方法,可以进一步增加酶的回收率[15,25,35]。色谱法可以有效实现高纯度PPO的纯化,为了提高其活性回收率,可以通过数学建模的方式优化色谱分离条件。
3 PPO的理化性质
由于多酚氧化酶重要的生理意义,其性质受到研究者的关注,分子量、温度、pH、底物特异性和抑制剂作用等特征被广泛研究。
3.1 分子量与结构
植物PPO主要由转运肽、Cu原子结合区域和疏水区域三部分组成[36-37]。转运肽是叶绿体蛋白的典型特征,主要作用是指导PPO进入类囊体膜,分子量约为4~9 kDa;Cu原子结合区是PPO的主要功能区域,具有高度保守性且分子量约为40 kDa,大多数植物、动物、细菌和真菌PPO具有两个Cu原子结合区(CuA和CuB),其中CuA的保守性大于CuB;Cu原子结合区对PPO的结构和构象起到维持作用,主要是由一个耦合的双核3型铜中心组成,漆酶则含有4个铜离子组成的三核中心[38]。C-末端是疏水性的,其结构区域屏蔽了PPO的活性位点,因此在正常生理条件下,酶活性非常低[6]。由于PPO来源广泛以及基因的复杂性,其分离纯化和结晶的难度较大,因此高级结构的详细信息仍未被发现。目前,从歌海娜葡萄(Vitis vinifera)中分离出的多酚氧化酶的晶体结构已经得到发现,X-射线分析发现,多酚氧化酶是以α-螺旋为主的二级结构,与组氨酸结合的铜离子活性位点位于螺旋束的中心位置[39]。
由于多酚氧化酶的不同存在形式及同工酶的存在,不同植物、同一植物不同部位及同一部位的PPO分子量存在差异。多酚氧化酶的活性不受SDS的干扰,分子量的测定通常采用SDS-PAGE电泳法与已知分子量的蛋白质进行比较[40]。如表3所示,不同来源PPO的分子量大致在45~130 kDa之间,在某些情况下可以观察到PPO存在多个条带,说明同一来源的PPO中存在不同的亚型[41-42]。
3.2 最适温度和pH
酸碱介质会影响酶活性位点基团的电离,从而改变活性位点的正确构象或阻碍酶-底物结合的催化反应[43]。植物PPO的最佳pH因植物来源的不同而存在差异,但是一般在4.5~7.5之间(表4)。一些PPO显示了两个最佳pH,这是由于提取物中存在不同的PPO亚型[44-45]。温度是催化PPO活性的另一个重要因素,低温条件会降低反应分子的活动速率,高温下酶分子的结构完整性受到破坏和变性。温度的改变也会影响氧气的溶解度,进而影响酶促褐变。PPO的最适温度在8~70 ℃之间,其变化取决于植物来源和底物类型[46-50]。
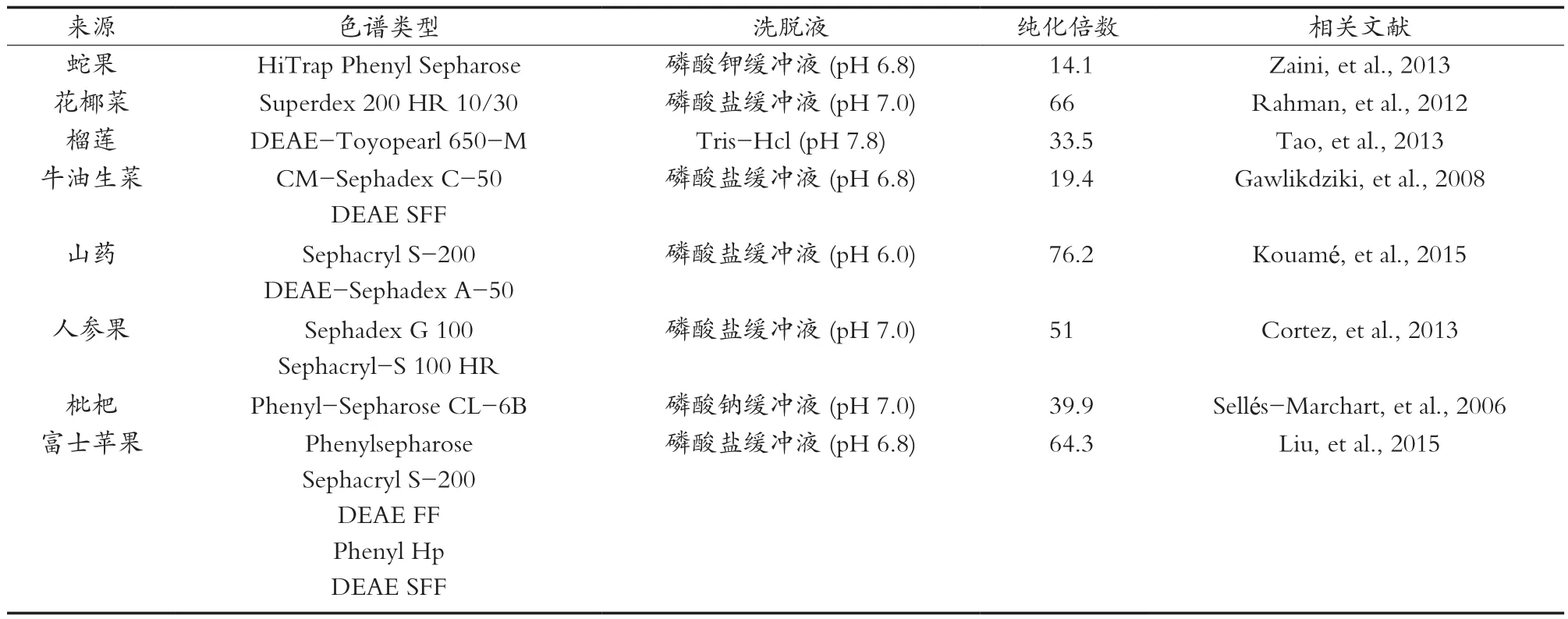
表3 采用不同色谱方法纯化不同来源的PPO
3.3 底物特异性和抑制剂
酚类物质是PPO的关键底物,酶活性与酚类物质的种类有关[51]。邻苯二酚是目前应用最广泛的底物,研究表明,PPO的底物特异性与植物品种有关(表5)[52-54]。抑制剂作为控制酶促褐变的有效手段被广泛研究,根据其作用机理,可分为六类:(1)还原剂(抗坏血酸及其类似物、亚硫酸盐等);(2)螯合剂(乙二胺四乙酸乙酯、叠氮钠等);(3)络合剂(环糊精、壳聚糖等);(4)酸类物质(抗坏血酸、柠檬酸等);(5)酶抑制剂(底物类似物、卤化物等);(6)酶处理剂(蛋白酶、邻甲基转移酶等)[55]。这些化合物通过消除反应过程中的参与元素如酶、底物、铜原子或反应中间产物来降低或抑制褐变的反应速率。不同来源的PPO与抑制剂的反应相似,但是其抑制效果可能会有显著差异。

表5 不同来源PPO的底物特异性和最佳抑制剂
4 结语与展望
多项研究发现,盐沉淀法、色谱法、温度诱导法、三相分离法和双水相法是多酚氧化酶最常用的分离纯化方法,为了提高酶活性和提取效率,亲和层析、超滤或金属结合等方法可用于后续试验。近年来研究发现众多水果中的多酚氧化酶主要以结合态的形式存在,如苹果中可溶态只占了8%~15%[42]。膜结合态的多酚氧化酶与叶绿体内囊体膜结合,处于低活性状态,在外界环境的刺激下,膜系统受到破坏或膜的通透性发生改变,结合态的多酚氧化酶会逐渐转化为可溶态,使多酚氧化酶的酶活提高。植物中结合态多酚氧化酶负责细胞内初始酶量的积累,说明了结合态多酚氧化酶研究的重要性,但是国内外对可溶态多酚氧化酶的分离和性质研究较多,对结合态多酚氧化酶未展开系统性的研究,其作用机理未被完全阐明,一些核心问题仍未被解决[56-57]。现今分子生物学已被广泛应用于酶的功能,但是关于该酶的潜伏期现象以及其在体内是如何转化为活性形式和控制潜伏态向活性态转化的作用机理尚不清楚[58]。关于多酚氧化酶与底物的相互作用以及在不同环境中它们是如何相互影响还需要进一步研究[59]。多酚氧化酶在应对病原体和食草动物的侵袭以及防御和应激反应之间的相关性已经被证实,但是多酚氧化酶是如何增强植物抗病性的作用机理还有待进一步研究[60]。目前关于多酚氧化酶在除叶绿体外的其他细胞器中的定位,在植物和真菌细胞中不同发育阶段的功能和活性水平仍是研究的重点[61]。多酚氧化酶在食品加工和褐变反应中有着重要作用,未来的研究仍应更多地关注酶的作用机制,以期深入推进多酚氧化酶对植物体生理变化规律的研究。

