转cry1Ab/c水稻环介导等温扩增快速检测方法
王镓璇,胡昱萱,吴海星,檀建新*
河北农业大学食品科技学院(保定 071001)
转基因作物(Genetically modified crops,GMC)是应用转基因技术,将已知的一种或几种基因序列(DNA)构建到载体上,将构建好后的载体转移到植物(如玉米、棉花、水稻等)细胞内,从而实现基因重组,表达相应的多肽或蛋白质产物,得到转基因作物[1]。转基因作物根据其性能可分为4个种类:一是转Bt农作物[2],可有效抵抗虫害,同时减少农药使用和残留;二是抗除草剂农作物[3],减轻除草剂对农作物的危害;三是抗病毒农作物,防治病毒侵害农作物,从而增加其产量;四是营养增强型农作物,其特定营养组分含量更高,其正成为饲料市场中越来越重要的部分[4]。在转基因作物带给人们革命性创新的同时,转基因作物对于人体健康安全性和农作物种植过程中对于环境安全性同样引起各国的重视[5]。源于对其安全性的担忧,市场广泛需要建立一种简便、灵敏的检测作物中是否含有转基因成分的方法。
目前国内检测转基因成分的方法[6]主要分为以下几种:一是以蛋白质为标准的检测技术,分为酶联免疫吸附法[7]和蛋白质印记杂交法[8],蛋白质在加工过程中容易变性,从而失去作为检测指标的意义,影响试验结果;二是基因芯片[9]和生物传感器检测方法[10];三是近红外光谱技术[11];四是聚合酶链式反应(PCR)方法[12]和LAMP方法。其中前三种方法技术要求高、仪器设备昂贵、实用性低。PCR方法需PCR仪,成本高、耗费时间长且灵敏度较低;相比较,环介导等温扩增法(Loop-mediated isothermal amplification,LAMP)是2000年开发的一种恒温核酸扩增方法,其特点是针对靶基因的6个区域设计4条特异引物,利用一种链,置换DNA聚合酶,在恒温条件短时间内即可完成核酸扩增反应,具有高灵敏度、强特异性、操作简单等优点[13],该反应被广泛应用于微生物病原体的检测[14]和进出口中转基因食品的检测中。此次试验建立了以LAMP反应为基础的水稻中cry1Ab/c为目的基因快速检测方法,以观察浊度、电泳法、荧光染料法[15]三种方法进行结果分析。
1 材料与方法
1.1 材料与仪器
抗虫转基因水稻‘TT51-1’、抗虫转基因水稻‘科丰六号’为天津市农业科学院农产品检验与标准鉴定所保存;普通水稻‘4021-P6’‘9311’‘TP309-P6’由河北农业大学生命科学学院刘丽娟老师惠赠。BstDNA聚合酶、10X Bst buffer、MgSO4,分析纯,购自New England Bio Labs公司;dNTPs购自Solarbio公司;Taq酶Mix、DNA分子量Marker购自大连宝生物公司。
PCR仪,Biometra Co.,Ltd.;电泳仪,北京市六一仪器厂;紫外分光光度计,上海菁华科技仪器有限公司;高速台式离心机,上海卢湘仪离心机仪器有限公司;凝胶成像系统,北京市六一仪器厂;电子天平,北京赛多利斯天平有限公司;连续可调微量移液器,德国Eppendorf公司。
1.2 方法
1.2.1 基因组提取
总基因的提取方法参考CTAB方法[16]。利用分光光度计测定所提取到的核酸在260~280 nm处的吸光度,确定其纯度和浓度,将浓度调整为50 ng/μL,保存在-20 ℃,备用。按上述方法提取抗虫转基因水稻TT51、抗虫转基因水稻科丰六号,普通水稻‘4021-P6’‘9311’‘TP309-P6’的DNA,并调整浓度用作LAMP检测cry1Ab/c特异性的模板;同时用分析天平为十万分之一的规格称取转基因水稻和非转基因水稻,以一定的比例进行混合,使转基因水稻占总质量的2.5%,1%,0.5%,0.1%,0.05%,0.01%和0.005%,完全混匀,提取DNA,浓度统一调至50 ng/μL,用作LAMP检测cry1Ab/c灵敏度的模板。
1.2.2 DNA模板质量控制
为确定检测结果是否可靠及准确,首先判断待测样品的内标基因是否为水稻的蔗糖磷酸合酶(SPS基因,Genbank编号U33175),从而监控提取的DNA质量。PCR反应水稻的内标基因SPS是按照农业部953号公告-6-2007进行扩增,正向引物SPS-F1的序列为:5’-TTGCGCCTGAACGGATAT-3’;反向引物SPS-R1序列为:5’-GGAGAAGCACTGGACGAGG-3’[17]。PCR扩增反应体系共25 μL,包括上下游引物F3和B3各0.6 mmol/L,2.5 μL DNA模板,12.5 μL mix,用灭菌双蒸水补足至25 μL。PCR反应在PCR仪中进行,检测水稻内标准基因SPS的PCR反应程序为94 ℃预变性5 min,进入循环,94 ℃变性40 s,54 ℃退火30 s,72℃延伸30 s,共35个循环,最后72 ℃终延伸6 min;PCR扩增产物进行2%的琼脂糖凝胶电泳分析。
1.2.3 LAMP引物设计筛选与合成
使用来源于转基因水稻外源基因Bt cry1Ab/c的人工改造序列,运用引物设计软件Primer Explorer Version 4在线进行LAMP引物设计。筛选4条特异性引物:两个外引物分别为上游外引物(F3)和下游外引物(B3);两个内引物分别为上游内引物(FIP)和下游内引物(BIP),FIP由F1的互补序列和正向序列F2构成,BIP由B1的互补序列和正向序列B2构成。特异性引物所对应的目的基因片段从358~575区域218 bp目的基因片段。引物由华大基因合成(见表1)。
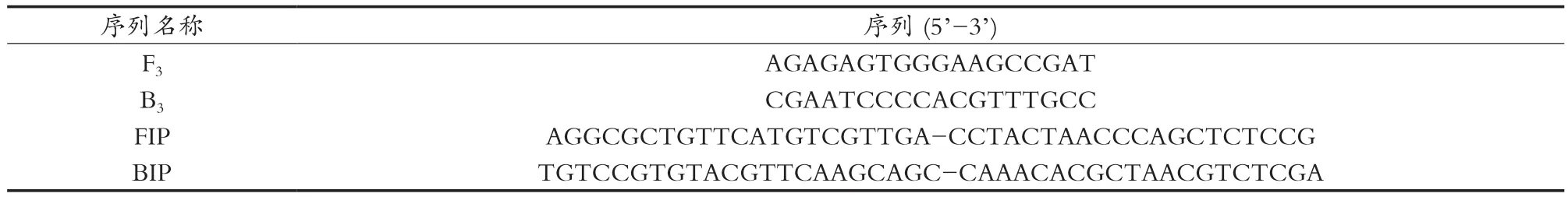
表1 LAMP引物
1.2.4 LAMP反应体系
应用的反应体系共25 μL,包括有内引物(FIP和BIP)各1 mmol/L,外引物(F3和B3)各0.2 mmol/L,2.5 mmol/L dNTPs,0.5 mmol/L MgSO4,8 UBstDNA聚合酶,2 μL DNA模板,2.5 μL 10×Thermo Pol Buffer,用灭菌双蒸水补足体系至25 μL。LAMP反应过程:95 ℃变性5 min,65 ℃水浴反应60 min,然后80 ℃ 10 min终止反应。肉眼观察其浊度变化,并高速离心后观察管底部是否产生白色焦磷酸镁沉淀。同时,取5 μL扩增产物,与1 μL 6×loading buffer混合均匀,进行2%的琼脂糖凝胶电泳,观察梯形条带是否正确,以证实LAMP反应是否发生。也可直接加入SYBR Green Ⅰ观察是否变为绿色,判断反应是否发生。
1.2.5 PCR反应体系
于PCR仪中进行PCR反应,94 ℃预变性5 min,然后进入循环,94 ℃变性40 s,54 ℃退火30 s,72 ℃延伸30 s,共35个循环,最后72 ℃终延伸6 min。结果检测为5 μL PCR扩增产物,然后进行2%的琼脂糖凝胶电泳分析。
1.2.6 反应条件的优化
LAMP体系中所使用的不同浓度比的内外引物于扩增反应是最为重要的影响因素之一。固定外引物的浓度,改变内引物的浓度,使外引物与内引物的浓度比为1∶5,1∶6,1∶7和1∶8。dNTPs对扩增效率有显著影响,为DNA合成提供原料和能量,在LAMP体系中dNTPs浓度梯度为0.7,0.8,0.9,1.0,1.1和1.2 mmol/L;LAMP反应特殊之处是合成大量产物的同时,生产副产物焦磷酸镁白色沉淀。此次试验反应体DNA聚合酶的活性因子,其浓度对扩增的产量和特异性有显著影响。浓度过低会降低DNA聚合酶活性,使产物量减少;而浓度过高,酶会催化非特异性扩增,反应的特异性会降低。Mg2+的游离浓度又受到带负电荷离子基团(如磷酸基团)的影响,因此反应体系中应不含带负电荷离子基团,LAMP体系中磷酸根的主要来源dNTPs,其浓度的变化会影响Mg2+的浓度。因此在优化反应条件时,已将dNTPs的加入量设为1.0 mmol/L。此次试验反应体系中把Mg2+浓度依次设为0.5,1.0,1.5,2.0和2.5 mmol/L。同时针对试验中的反应温度进行探索,设为61,62,63,64,65和66 ℃。
1.2.7 LAMP反应的灵敏度和特异性检测
以1.2.1提取的DNA模板分别做LAMP和PCR扩增,扩增后分别取5 μL反应物进行凝胶电泳,向剩余的反应物中加入1 μL 100倍SYBR Green Ⅰ荧光染料,充分混匀,观察颜色变化。SYBR Green Ⅰ是一种直接与dsDNA双螺旋小沟区域非特异性结合后具有绿色激发波长的染料。在游离状态下,SYBR Green Ⅰ发出微弱的荧光,一旦与双链DNA结合,荧光会增强1 000倍,如果发生了扩增反应,反应结束后混合液会由橙色变为绿色;如果未发生反应,则反应结束后混合液的颜色仍保持SYBR Green Ⅰ的橙色不变。试验采用凝胶电泳法和荧光染料法显示LAMP扩增和PCR扩增的灵敏度和特异性结果,并对LAMP和PCR法进行比较。
2 结果与分析
2.1 水稻模板DNA质量控制
以‘TT51-1’转基因水稻和非转基因水稻DNA为模板,对SPS水稻内标基因进行PCR扩增,结果见图1。转基因水稻和非转基因水稻均扩增出大小为277 bp的明显条带,与目的产物片段大小一致,可作为进一步检测应用的模板。

图1 水稻基因组SPS基因PCR检测
2.2 LAMP反应条件的优化
LAMP反应条件的优化结果见图2~图5。由图2可知,反应温度在61~66 ℃区间对反应影响不大,最终选择为65 ℃;图3表明dNTPs浓度在1.0~1.2 mmol/L范围内效果相当,最终选择1.0 mmol/L;图4显示LAMP反应的内外引物比例在1∶5时条带最亮,因此选择内外引物比例为1∶5;图5证明LAMP反应的最佳Mg2+浓度为0.5 mmol/L,由此确立上述参数为最佳LAMP反应体系。
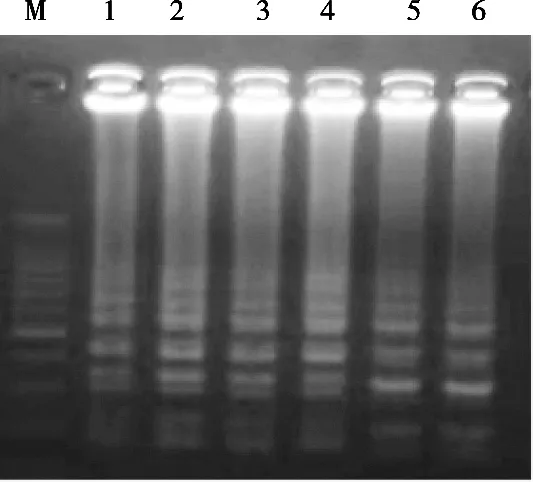
图2 LAMP反应温度的优化
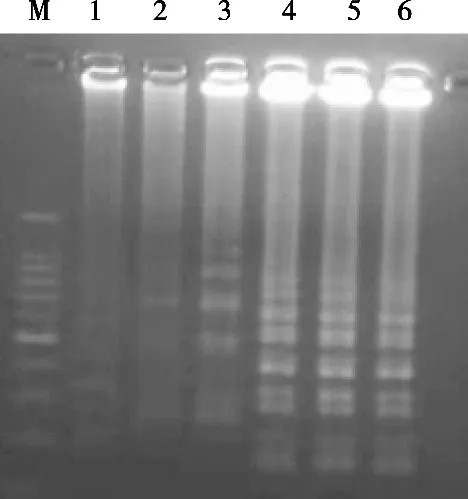
图3 LAMP反应体系中dNTPs浓度优化
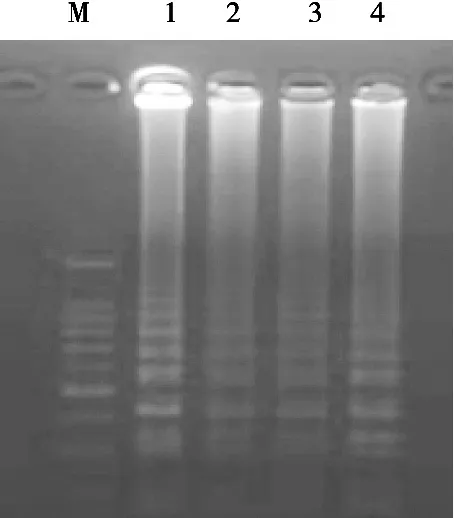
图4 LAMP反应体系中内外引物比例的优化
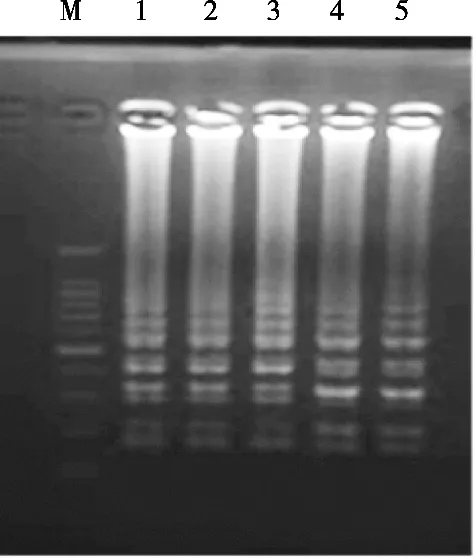
图5 LAMP反应体系中Mg2+浓度的优化
2.3 LAMP法检测cry1Ab/c的灵敏度
LAMP扩增和PCR扩增电泳结果见图6(A)和图6(B)。
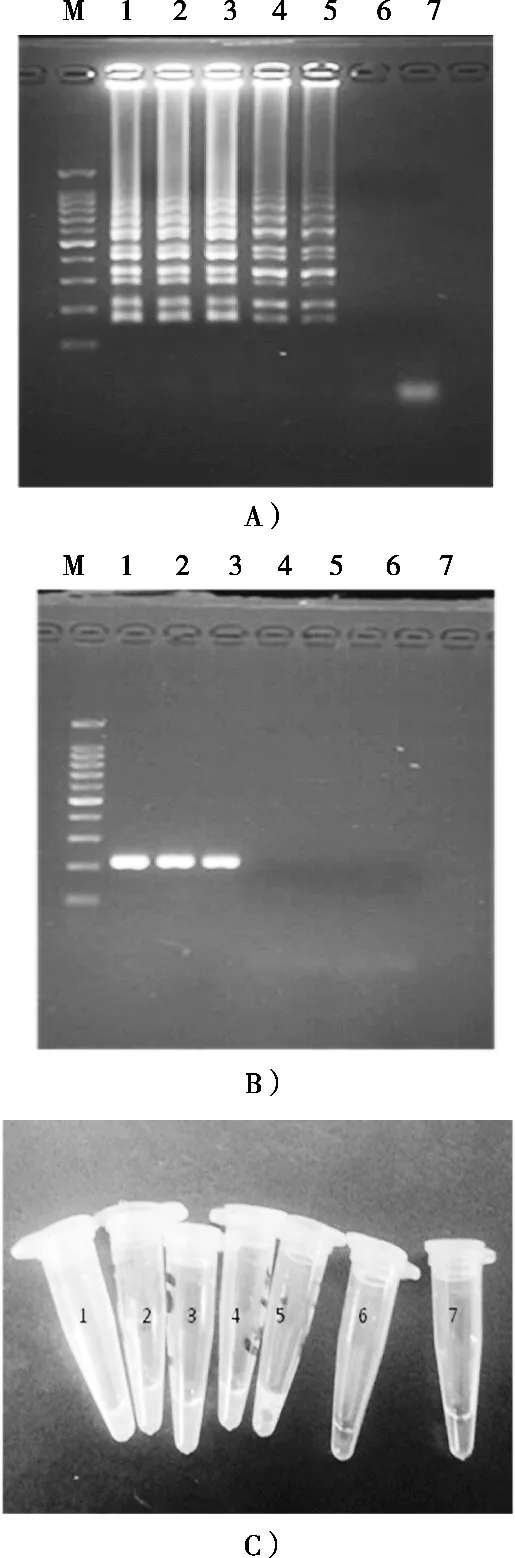
图6 LAMP法和PCR法的检测灵敏度
由图6(A)可见,泳道1~5均出现LAMP反应特有的阶梯状电泳条带,最低检测限可以达到0.05%;由图6(B)可见,泳道1~3常规PCR均扩增出218 bp大小的特异性条带,PCR只能扩增浓度在0.5%以上的样品。电泳结果显示,此次试验所建立的LAMP方法的灵敏度是常规PCR的10倍。荧光染料检测结果(图6C)与凝胶电泳法LAMP扩增结果一致。
2.4 LAMP法检测cry1Ab/c的特异性
LAMP法和PCR法测定特异性结果见图7。
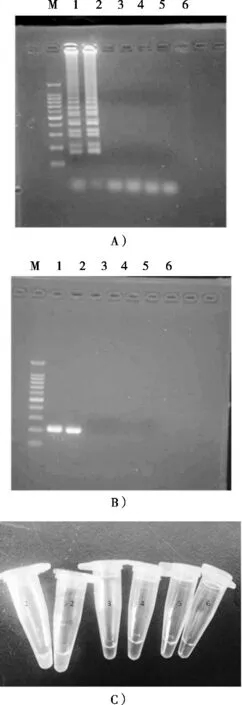
图7 LAMP法和PCR法的特异性
荧光染料法结果(图7C)显示科丰六号反应管呈绿色,与阳性反应管转基因水稻TT51-1结果一致,表明出现大量扩增产物,为cry1Ab/c阳性结果。非转基因水稻4021-P6、9311、TP 309-P6的反应管呈浅橙色,与空白对照反应管可视结果一致,表明引物未能与模板配对扩增,无产物生成,为cry1Ab/c阴性结果。凝胶电泳分析(图7A和图7B)结果显示科丰六号有明显阶梯状条带,与阳性对照TT51-1完全相同。其余三个样品无条带出现,与空白对照结果一致,该电泳结果与LAMP扩增后直接加入SYBR GREEN I荧光染料的结果是一致的。
3 讨论与结论
用LAMP法检测水稻中是否含有转基因成分需要以下四方面的准备:第一,分析检测水稻中插入的改造后crylAb/c基因的序列;第二,从转基因水稻中提取DNA来作为反应的模板;第三,针对该水稻品种设计4条特异性引物;最后,优化该法中一系列有关反应条件,得到最优用于检测的反应体系。此次试验对象为转基因水稻,以其内标准基因SPS基因为靶基因,根据文献合成特定引物,建立了以内标准基因SPS基因能否实现PCR扩增来判断从水稻中提取模板DNA质量优劣的方法。同样运用引物设计软件设计出针对crylAb/c基因的LAMP特异性引物。通过优化影响LAMP反应的各种因素,确立了快速检测转基因水稻的LAMP反应体系:Mg2+浓度为0.5 mmol/L,dNTPs浓度为1.0 mmol/L,上、下游内引物FIP、BIP浓度均为1 mmol/L,上、下游外引物F3、B3浓度均为0.2 mmol/L,8 U Bst DNA聚合酶大片段的添加量为0.7 μL,模板DNA浓度为50 ng/μL,反应温度为65 ℃,反应时间为60 min。采用上述建立的优化后LAMP体系进行灵敏度试验,以PCR方法作对比试验,结果显示LAMP方法最低检测限度可以达到0.05%,而PCR方法最低检测限在0.5%,即LAMP方法检出限比传统PCR法低10倍。用LAMP法对转基因和非转基因水稻进行特异性检测,电泳结果与荧光呈色结果一致。LAMP法比PCR法检测更方便快捷,体现在扩增时间更短(LAMP法只需60 min;PCR需100 min)、仪器设备简单(LAMP法只需用恒温水浴锅在恒温条件下即可扩增;PCR法需昂贵的PCR仪,并且反复变性实现扩增)、结果检测更方便(LAMP法可以直接添加SYBR Green Ⅰ荧光染料,通过可视结果判断;PCR法通过普通的琼脂糖凝胶电泳法,时间比前者长且操作时会接触具有致癌性的EB,一定程度上有潜在的风险危害)、检测灵敏度更高。基于以上一系列的显著特性,运用LAMP法对转基因水稻快速检测有较强的优越性、可操作性、简便性,在市场或基层试验中有着较为广泛的应用前景。

