海藻酸钠-乳清蛋白复合包埋益生菌及特性
周莉,王晓瑞,谭静,平洋,徐钟*
河南省商业科学研究所有限责任公司(郑州 450002)
益生菌具有卓越的益生功效[1],不仅有利于维持肠道菌群平衡[2],增强胃肠道黏膜屏障[3],而且能够调节免疫系统[4],预防癌症[5],降低胆固醇[6],促进营养物质的吸收[7-8]。然而,益生菌对人体的保健效果与其到达肠道的菌活密切相关。胃肠道环境中的多种不良因素,尤其是胃酸,会使益生菌的活菌数量显著下降,明显限制其益生功能的发挥[9]。益生菌如果未经改造,生命力十分脆弱,是无法耐久存的,利用微胶囊技术,通过一定手段将益生菌包裹在微小且封闭的胶囊中[10],不仅能在加工或储藏过程中提高益生菌的有效活菌数,还能在通过胃肠道期间对益生菌进行保护,使其以较少的活性损失到达肠道靶位点[11],可有效增强菌体对消化道逆环境的抵抗力,并将益生菌在适当的位置释放,发挥其益生作用[12-13]。
试验拟制备海藻酸钠和乳清蛋白双层复合包埋益生菌微胶囊。以乳清蛋白包裹菌体形成营养保护层,与具有良好生物相容性和肠溶性的海藻酸钠发生交联凝聚发应,形成在胃中不消化、耐酸性能更好的双层微胶囊。该双层微胶囊即可发挥乳清蛋白高营养价值、网络锁水功能和对于益生菌的活性保护作用[14],又可利用外层凝胶避免其在胃中水解。双层包埋的益生菌比单层包埋益生菌更能抵御胃液的侵害。将乳清蛋白与海藻酸钠作为益生菌的包埋壁材,为益生菌的包埋研究提供依据,可以解决益生菌制剂在生产、使用过程中活性、数量及效价损失严重的问题,具有广泛的应用价值。
1 材料与方法
1.1 材料与试剂
MRS肉汤、MRS培养基、莫匹罗星锂盐改良MRS琼脂(青岛海博);两歧双歧杆菌(广东环凯,本实验室传代保存);胃蛋白酶、胰蛋白酶(Biofroxx);海藻酸钠、乳清蛋白(80%)(源叶生物);磷酸氢二钠、磷酸二氢钠、氯化钙、氯化钠、盐酸(均为分析纯,国药集团化学试剂有限公司)。
1.2 仪器与设备
YQX-Ⅱ厌氧培养箱、DPX-9162B-2电热恒温培养箱(上海福玛实验设备有限公司);YXQ-LS-50型立式压力蒸汽灭菌锅(上海博迅实业有限公司);85-2恒温磁力搅拌器(海司乐仪器有限公司);UNIVERSAL 320R型高速离心机(德国Hettich公司);QL-866型旋涡振荡器(江苏海门其林贝尔仪器制造有限公司);BSC-1500ⅡB2-X型生物安全柜(鑫贝西Biobase);SHZ-82型恒温振荡器(常州国华电器有限公司);HH-S恒温水浴锅(金坛市医疗器械厂);700 Series型-80 ℃冰箱(中科美菱);电子分析天平(梅特勒-托利多仪器(上海)有限公司);Milli-Q超纯水仪(美国Milipore)。
1.3 方法
1.3.1 菌种活化培养
将保存的两歧双歧杆菌接种于MRS肉汤中,于37℃恒温厌氧培养24 h,将植物乳杆菌、干酪乳杆菌接种于MRS肉汤中,于37 ℃恒温厌氧培养18 h,并根据2%接种量接种,连续活化传代2~3次。以6 000 r/min离心5 min,用0.85%无菌生理盐水洗涤2次,重悬于生理盐水中,使此浓缩菌液为109CFU/mL。利用平板计数法对浓缩菌液进行精确计数。
1.3.2 益生菌微胶囊的制备[15]
称取一定质量的海藻酸钠粉末溶于灭菌水中,70℃下水浴加热过夜至粉末充分溶解,制得海藻酸钠溶液,并经过0.22 μm滤膜过滤除菌,冷却备用。称取一定质量的乳清蛋白粉末,溶于含有质量分数1%盐酸的无菌水中,在磁力搅拌器上搅拌直至溶解完全。使用磁力搅拌器在800 r/min下,搅拌悬浮1 h后备用。
称取一定质量的氯化钙颗粒溶于双蒸水,以121℃高压灭菌15 min,制得氯化钙溶液,将菌液、乳清蛋白和海藻酸钠以一定的比例混合,用注射器将10 mL混合液滴入100 mL CaCl2固化剂中,形成微囊,磁力搅拌器搅拌30 min,使微囊充分凝固,用蒸馏水冲洗3次,除去多余的钙离子和未被包埋的益生菌,即得湿胶囊。
1.3.3 微胶囊包埋率的测定
准确称取1 g湿微胶囊样品,加入9 mL解囊液中[PBS缓冲液(pH 7.4)][16],振摇10 min至完全解囊。将梯度稀释后涂布于MRS琼脂上,37 ℃厌氧培养72 h并计数。微胶囊的包埋率计算公式:
包埋率=微胶囊中包埋的活菌数/制备微胶囊时添加的活菌数×100% (1)
1.3.4 益生菌微胶囊制备工艺优化
通过单因素试验测定不同海藻酸钠浓度(1%,2%,3%,5%和8%)、乳清蛋白浓度(3%,5%,8%,10%和12%)、氯化钙浓度(1%,2%,3%,5%和8%)和搅拌速度(200,400,600,800和1 000 r/min)对复合益生菌微胶囊的影响。采用四因素三水平L9(34)正交试验设计,研究4个因素对微胶囊包埋率的影响。正交试验设计如表1所示。
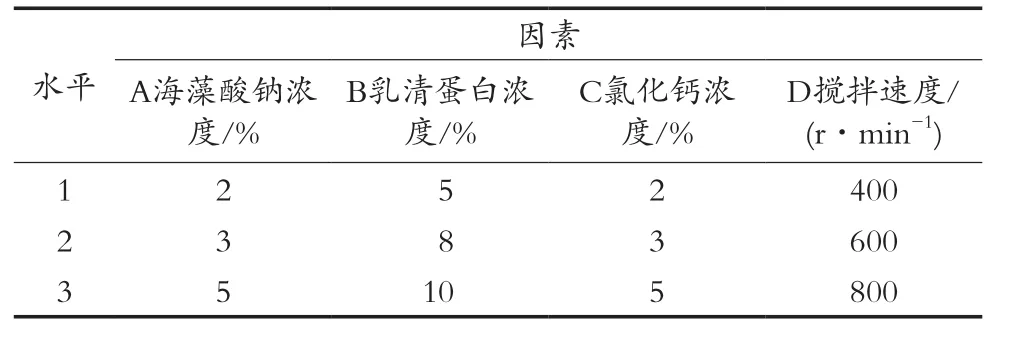
表1 正交试验因素水平表
1.3.4.1 海藻酸钠最佳浓度的确定
在乳清蛋白浓度10%,氯化钙浓度2%,海藻酸钠浓度1%,2%,3%,5%和8%的条件下,参照微胶囊的制备工艺制得微胶囊后,以微胶囊的包埋率为测定指标,探究海藻酸钠浓度对微胶囊包埋率的影响,以确定海藻酸钠的最佳浓度。
1.3.4.2 乳清蛋白最佳浓度的确定
在海藻酸钠浓度3%,搅拌速度800 r/min,乳清蛋白浓度3%,5%,8%,10%和12%的条件下,参照微胶囊的制备工艺制得微胶囊后,以微胶囊的包埋率为测定指标,探究乳清蛋白浓度对微胶囊包埋率的影响,以确定乳清蛋白的最佳浓度。
1.3.4.3 氯化钙最佳浓度的确定
在海藻酸钠浓度3%,乳清蛋白浓度10%,氯化钙浓度1%,2%,3%,5%和8%的条件下,参照微胶囊的制备工艺制得微胶囊后,以微胶囊的包埋率为测定指标,探究氯化钙浓度对微胶囊包埋率的影响,以确定氯化钙的最佳浓度。
1.3.4.4 搅拌速度的确定
在海藻酸钠浓度3%,乳清蛋白浓度10%,氯化钙浓度2%的条件下,参照微胶囊的制备工艺形成微囊后,然后用磁力搅拌器搅拌,搅拌速度为200,400,600,800和1 000 r/min,过滤,并用蒸馏水将胶囊冲洗3次,即得湿胶囊。以微胶囊的包埋率为测定指标。
1.3.5 益生菌微胶囊在模拟胃液中的耐受性
模拟人工胃液[17]:取16.4 mL稀盐酸,加约800 mL水,调pH至2.0,加10 g胃蛋白酶,搅匀后加水定容至1 000 mL即可。
取0.5 g微胶囊加入到模拟胃液(4.5 mL)中,充分混匀15 s,在37 ℃条件下,以200 r/min在摇床中振荡处理30,60,90,120和150 min,分别离心收集取样,活菌计数。同时进行对照试验。
1.3.6 益生菌微胶囊在模拟肠液中的释放性
模拟人工肠液[18]:取6.8 g磷酸二氢钾,加500 mL水。用0.4%氢氧化钠溶液调节pH 6.8;另取10 g胰蛋白酶,加适量水使其溶解,将两液混合后,加水定容至1 000 mL即可。
取0.5 g微胶囊加入到模拟肠液(4.5 mL)中,充分混匀15 s,在37 ℃条件下,以200 r/min在摇床中振荡处理30,60,90,120和150 min,分别离心收集取样,活菌计数。同时进行对照试验。
1.3.7 益生菌胶囊产品储藏稳定性
将最佳工艺条件下包埋的两歧双歧杆菌益生菌微胶囊置于4 ℃条件下进行保藏,每隔7 d取样计活菌数,检测微胶囊的稳定性。相同条件下取未被包埋的两歧双歧杆菌置于4 ℃条件下进行保藏,每隔7 d取样计活菌数。
2 结果及讨论
2.1 单因素试验
2.1.1 海藻酸钠浓度对益生菌微胶囊的影响
试验中,保持乳清蛋白浓度10%、氯化钙浓度2%,在海藻酸钠浓度1%,2%,3%,5%和8%条件下制备微胶囊,所制备的微胶囊性质见图1。在一定范围内,包埋率随海藻酸钠浓度的加大而增大,海藻酸钠浓度3%时,包埋率达到最大。海藻酸钠继续增大时,包埋率降低。这是由于海藻酸钠浓度高时,溶液黏度增大,益生菌不易分散;海藻酸钠浓度低时,形成的凝胶颗粒小,机械强度低,不能有效包埋菌体,影响包埋效果。因此,以海藻酸钠浓度3%作为后续试验条件。
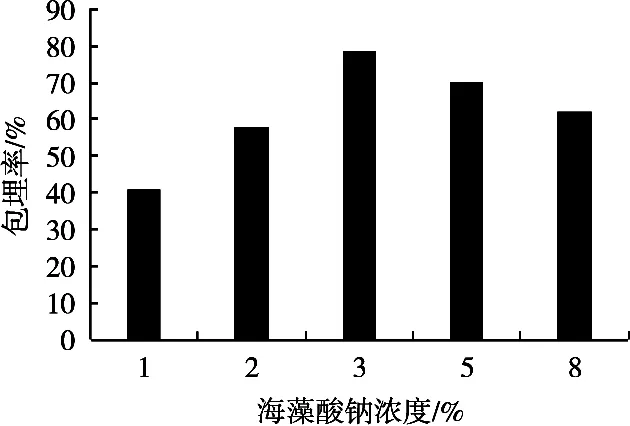
图1 海藻酸钠浓度对微胶囊包埋率的影响
2.1.2 乳清蛋白浓度对益生菌微胶囊的影响
保持海藻酸钠浓度3%、氯化钙浓度2%,乳清蛋白浓度3%,5%,8%,10%和12%条件下制备微胶囊,所制备的微胶囊性质见图2。乳清蛋白浓度10%时,微胶囊所包埋的菌落数最多,包埋的效果最好。乳清蛋白浓度小于10%时,随着乳清蛋白浓度的升高,包埋率也增大;海藻酸钠浓度大于10%时,包埋率反而降低。可能由于,随着乳清蛋白浓度的增大,乳清蛋白与海藻酸钠结合越来越紧密,对包埋物质扩散的抑制作用增强,包埋率增加。乳清蛋白浓度增大到12%,对减少包埋过程中的损失减少,对包埋率影响较弱。
2.1.3 氯化钙浓度对益生菌微胶囊的影响
试验中,保持海藻酸钠浓度3%、乳清蛋白浓度10%,在氯化钙浓度1%,2%,3%,5%和8%条件下制备微胶囊,所制备的微胶囊性质见图3。氯化钙浓度小于2%时,随着氯化钙浓度的升高,包埋率也增大,氯化钙浓度2%时,包埋率达到最大值。
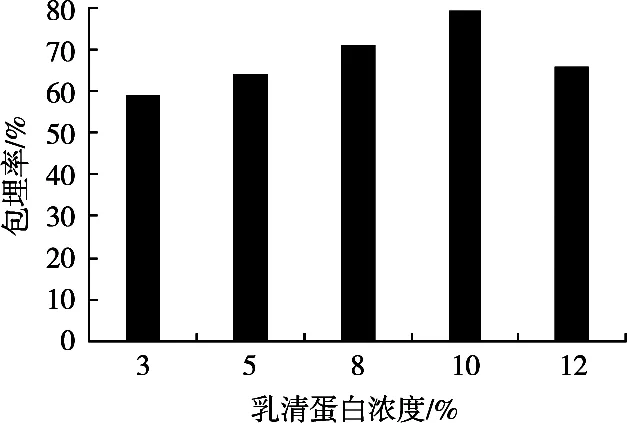
图2 乳清蛋白浓度对微胶囊包埋率的影响
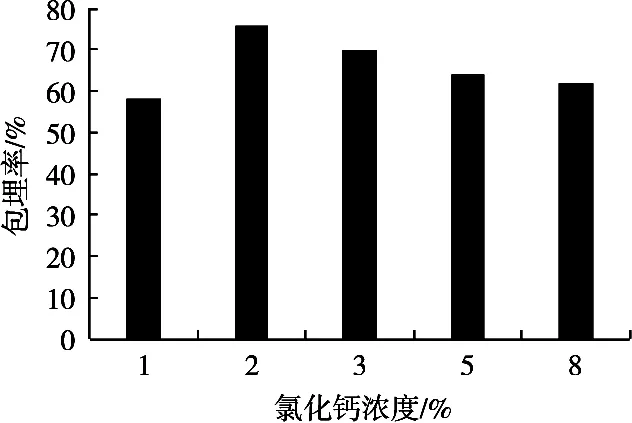
图3 氯化钙浓度对微胶囊包埋率的影响
2.1.4 搅拌速率对益生菌微胶囊的影响
试验中,在海藻酸钠浓度3%、乳清蛋白浓度10%、氯化钙浓度2%,搅拌速度200,400,600,800和1 000 r/min条件下制备微胶囊,所制备的微胶囊性质见图4。搅拌速率的不同,菌体的包埋率也不尽相同,搅拌速率800 r/min时的包埋率最大,搅拌速率200 r/min时的包埋率最小。在不改变其他试验工艺条件下,搅拌速度的逐渐增加会导致微胶囊的包埋率出现先升高后降低的情况。搅拌速度800 r/min时,包埋率为78%,与其他试验组有明显差异性。
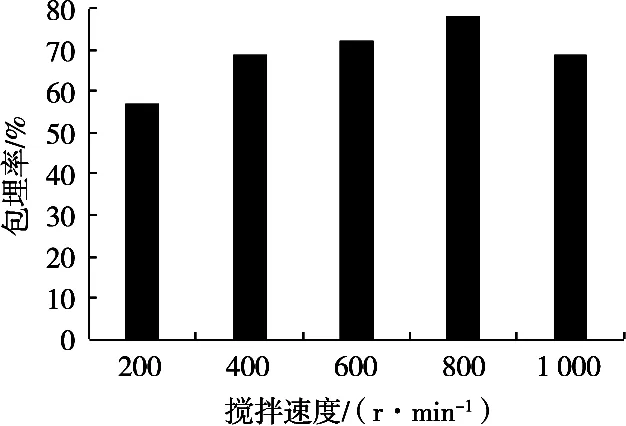
图4 搅拌速率对微胶囊包埋率的影响
2.2 正交优化
以单因素试验中获得的最适条件为基础,进行正交试验,考察海藻酸钠、乳清蛋白、氯化钙浓度和搅拌速度等参数对益生菌微胶囊包埋效果的影响,所得结果如表3所示。
单因素分析规律是试验因素对指标的影响呈正相关,极差顺序比较依次为:海藻酸钠浓度(A)>乳清蛋白浓度(B)>氯化钙浓度(C)>搅拌速度(D)。所以正交试验下得出的海藻酸钠浓度对益生菌微胶囊的包埋率影响最大,为最重要的影响因素,其次是乳清蛋白,然后是氯化钙,最后是搅拌速度。理论上的最佳组合为A2B3C1D3。即海藻酸钠浓度3%,乳清蛋白浓度10%,氯化钙浓度2%,搅拌速度800 r/min。
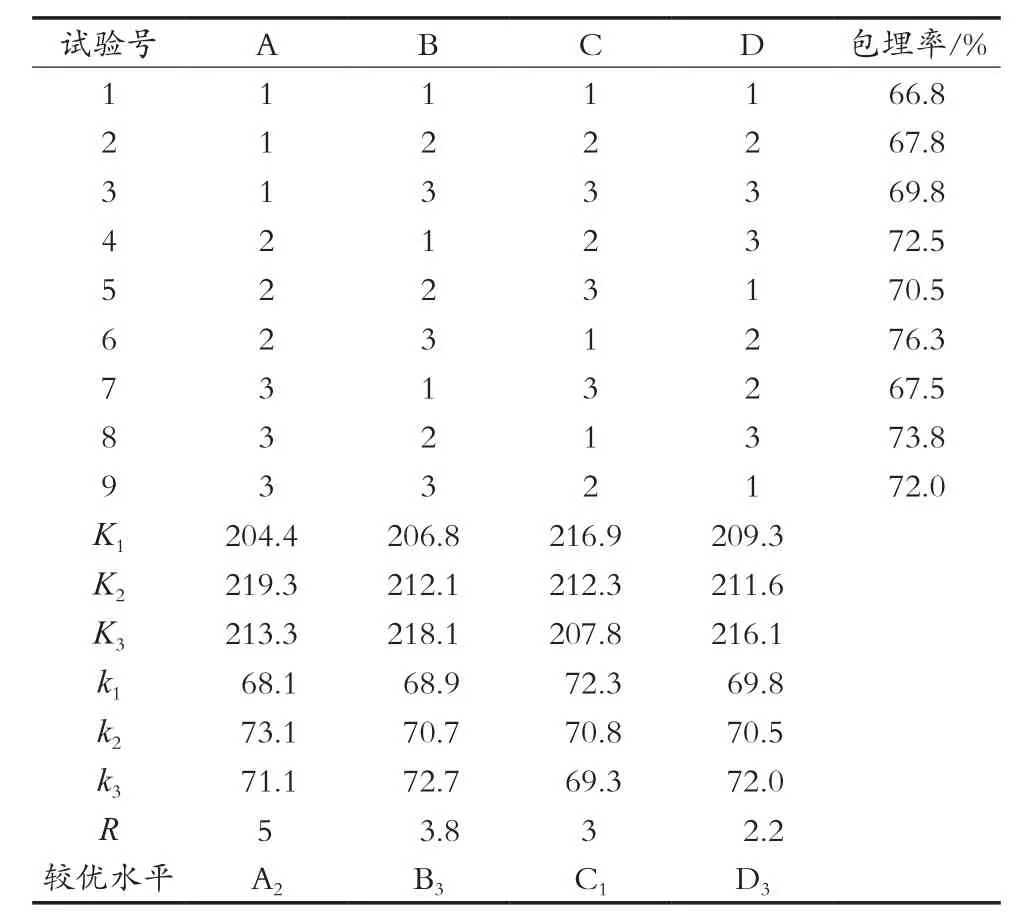
表2 正交试验结果表
2.3 两歧双歧杆菌益生菌微胶囊在模拟胃液中的存活率
未经包埋的两歧双歧杆菌在模拟胃液中150 min基本全部死亡,两歧双歧杆菌对外界环境敏感,胃液中的低酸环境使得未经处理的两歧双歧杆菌细胞难以存活。相比于未经包埋的两歧双歧杆菌,双层包埋能够显著地提高益生菌在模拟胃液中的存活率。双层包埋的两歧双歧杆菌在经过150 min的人工胃液处理后,存活率达到70%以上,说明双层包埋对保护两歧双歧杆菌耐胃酸效果较好。
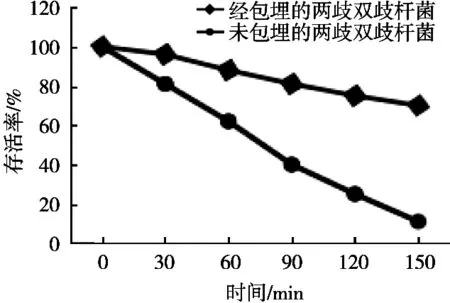
图5 微胶囊在模拟胃液中的存活情况
2.4 益生菌微胶囊在模拟肠液中的释放性
随着微胶囊在人工肠液处理的时间延长,微胶囊包埋的两歧双歧杆菌会连续释放,其在人工肠液处理中处理60 min之后,菌体的存活率变化不大,在9 log CFU/mL左右,表明试验的微胶囊肠液溶性较好,60 min之后,两歧双歧杆菌就会被连续地释放出来,为胶囊能靶向地产生益生效果铺垫基础。
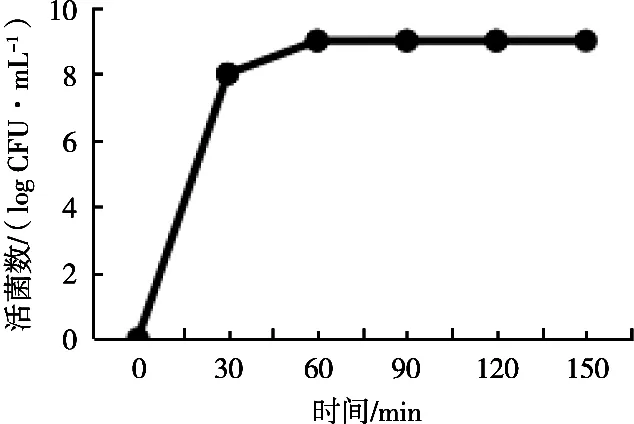
图6 微胶囊在模拟肠液中的释放情况
2.5 益生菌微胶囊产品储藏稳定性
将益生菌微胶囊置于4 ℃条件下进行保藏,每隔7 d取样计活菌数,经微胶囊技术包埋的两歧双歧杆菌和未包埋的两歧双歧杆菌活菌数会随着储藏时间的延长而呈现下降趋势。由于经过微胶囊化处理,两歧双歧杆菌外面包覆一层高分子囊膜,使其与外界环境隔离,增强了对不良环境的抵抗力,在储藏过程中不易失去活性,故菌体存活率较高,胶囊的贮存稳定性较好。微胶囊技术明显地提高两歧双歧杆菌的储藏稳定性。
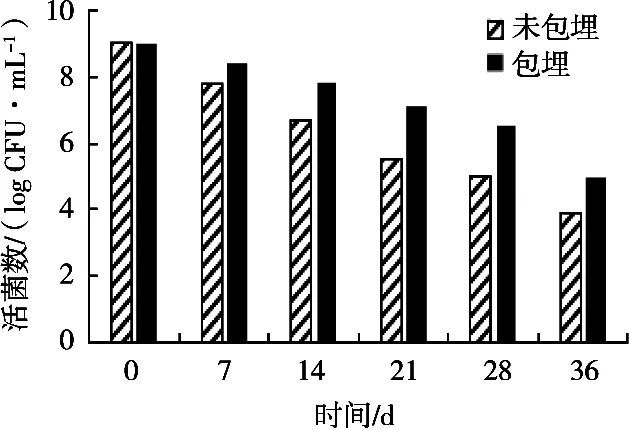
图7 益生菌微胶囊4 ℃的储藏试验
3 结论
研究利用海藻酸钠和乳清蛋白复合包埋技术,能够高效地包埋益生菌。以包埋率为指标,通过优化制备条件,海藻酸钠浓度3%,乳清蛋白浓度10%,氯化钙浓度2%,搅拌速度800 r/min,在此条件下包埋率达到78.0%±2.0%。制备的微胶囊在胃液中具有良好耐酸性,在肠液中具有良好释放性,并且具有贮存稳定性,有助于解决益生菌不耐胃酸与不易保存的问题。试验结果不仅可以提高益生菌在应用过程中的菌体存活率,而且为益生菌微胶囊的工艺优化提供理论和实践依据。

