藜麦酵素的制备工艺及活性
雨田*,胡一晨,彭镰心,邹亮,赵钢,孙佑玲
1. 成都大学医学院(护理学院)(成都 610106);2. 成都大学农业农村部杂粮加工重点实验室(成都 610106);3. 成都大学药学与生物工程学院(成都 610106)
藜麦(Chenopodium quinoaWilld.)为苋科藜属植物[1],营养成分丰富,是古印加人的传统粮食作物。藜麦具有一些谷类作物特性,但它不含麸质,适合对麸质过敏人群食用[2]。此外,大量研究表明,藜麦含有较多多酚、黄酮、皂苷、多糖、多肽、蜕皮激素等活性成分,还含有丰富膳食纤维、维生素、必需氨基酸、矿物质(K、P、Mg、Ca、Zn、Fe)等营养物质[1]。藜麦具有降血糖、降血脂、抑制肥胖等保健作用,特别适于“三高”、肥胖和孕婴人群长期食用。
酵素是酶的旧称,起源于日本,在中文词典中称为“植物之酶的提取物”或“植物酶提取之精华”[3],是一类具有催化作用的特殊的复杂蛋白质。食用酵素是一种或多种新鲜蔬菜、瓜果、药食同源药材、可食用有益菌等原料通过发酵过程而产生功能性发酵产品,且其中含有丰富的酶、矿物质、次生代谢产物、维生素等多种营养成分。研究表明,微生物酵素富含多酚、有机酸、氨基酸、维生素、多糖、矿物质等营养成分[4]。此外,有研究表明发酵原料经微生物发酵成酵素后,发酵酶液中含有多种功效酶,主要包括超氧化物歧化酶、蛋白酶、淀粉酶、脂肪酶等,从理论上证明酵素具有减肥功效[5]。
随着人们保健意识不断增强,以及对绿色食品需求的增加,藜麦相关产品的市场越来越广阔。因此,以藜麦为原料,将其与活性酵母液共同发酵制成藜麦酵素,以脂肪酶活力及DPPH自由基清除率为考察指标,采用单因素结合正交试验进行筛选,以期获得藜麦酵素的最佳制备工艺,为藜麦相关产品开发提供参考。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
藜麦(山东老乡生态农业有限公司);玉米油(山东三星玉米产业科技有限公司);高活性干酵母(安琪酵母股份有限公司);聚乙烯醇(1788型,克拉玛尔试剂公司);磷酸二氢钾(成都化学试剂厂);氢氧化钠(成都市科龙化工试剂厂);酚酞、邻苯二酸氢钾(天津市北辰方正试剂厂);甲醇、无水乙醇(成都市科隆化学品有限公司);维生素C(S1300-25 g,上海源叶生物科技有限公司);1, 1-二苯基-2-三硝基苯肼(DPPH,B25609-20 mg,上海源叶生物科技有限公司)。
1.1.2 主要仪器与设备
集热式恒温加热磁力搅拌器(DF-101S,郑州汇成科工贸有限公司);数显恒温水浴锅(HH-S,江苏正基仪器有限公司);电子天平(JD2000-2,沈阳龙腾电子有限公司);手提式压力蒸汽灭菌器(XFS-208CB,浙江新丰医疗器械有限公司);优普系列超纯水器(UPT-Ⅱ-10T,成都超纯科技有限公司);电子调温万用炉(DK-98-Ⅱ,天津天泰仪器有限公司);电热恒温培养箱(DHP-500,北京市永光明医疗仪器厂);隔水式恒温培养箱(GHP-9080,上海齐欣科学仪器有限公司);电热恒温培养箱(DHP-400,北京中兴伟业仪器有限公司);可见分光光度计(722型,上海莱帕德科学仪器有限公司)。
1.2 方法
1.2.1 单因素试验方法
1.2.1.1 加水量考察方法
称取50 g藜麦5份,精密称定,分别置于5个500 mL烧杯中,按加水量2,3,4,5和6倍,分别往其中加入100.00,150.00,200.00,250.00和300.00 mL纯化水,121 ℃高压蒸汽灭菌25 min,取出后冷却至40℃以下,分别与3.00 mL活化酵母液混匀,盖上保鲜膜,放入37 ℃恒温培养箱中分别培养12 h,4层纱布过滤,所得滤液即为藜麦酵素原液,用碱滴定法测定其脂肪酶活力。
1.2.1.2 发酵时间考察方法
称取50 g藜麦5份,精密称定,分别置于5个500 mL烧杯中,按藜麦与水1∶4(g/mL)的比例,分别往其中加入200.00 mL纯化水,121 ℃高压蒸汽灭菌25 min,取出后冷却至40 ℃以下,分别与3.00 mL活化酵母液混匀,盖上保鲜膜,放入37 ℃恒温培养箱中分别培养12,24,36,48和60 h,4层纱布过滤,所得滤液即为藜麦酵素原液,用碱滴定法测定其脂肪酶活力。
1.2.1.3 发酵温度考察方法
称取50 g藜麦5份,精密称定,分别置于5个500 mL烧杯中,按藜麦与水1∶4(g/mL)的比例,分别往其中加入200.00 mL纯化水,121 ℃高压蒸汽灭菌25 min,取出后冷却至40 ℃以下,分别与3.00 mL活化酵母液混匀,盖上保鲜膜,分别放入28,31,34,37和40 ℃恒温培养箱中培养12 h,4层纱布过滤,得藜麦酵素原液,用碱滴定法测定其脂肪酶活力。
1.2.1.4 接种量考察方法
称取50 g藜麦5份,精密称定,分别置于5个500 mL烧杯中,按藜麦与水1∶4(g/mL)的比例,分别往其中加入200.00 mL纯化水,121 ℃高压蒸汽灭菌25 min,取出后冷却至40 ℃以下,分别与5.00,10.00,15.00,20.00和25.00 mL活化酵母液混匀接种(即接种量分别为10%,20%,30%,40%和50%),盖上保鲜膜,放入37 ℃恒温培养箱中分别培养12 h,4层纱布过滤,所得滤液即为藜麦酵素原液,用碱滴定法测定其脂肪酶活力。
1.2.2 正交试验方法
根据前期预试验,并参考相关文献,选择对发酵过程影响最重要的3个因素,即接种量、发酵时间及发酵温度,在单因素试验结果的基础上,设计L9(33)正交试验,进一步筛选最佳发酵条件(见表1)。

表1 正交试验因素水平表
1.2.3 脂肪酶活力测定方法
脂肪酶活力测定参考文献[6]。计算藜麦酵素的脂肪酶活力。
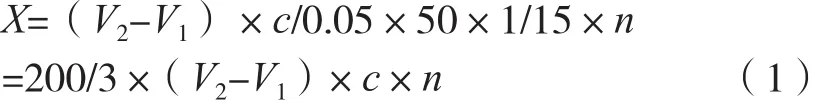
式中:X为样品的酶活力,U/mL;V2为滴定样品B或C时消耗氢氧化钠标准溶液体积,mL;V1为滴定空白瓶A时消耗氢氧化钠标准溶液体积,mL;n为酵素原液的稀释倍数;c为制备的氢氧化钠滴定液的浓度,mol/L;0.05为氢氧化钠标准溶液浓度换算系数;50为0.05 mol/L氢氧化钠溶液1.00 mL相当于脂肪酸50 μmol;1/15为反应时15 min,以1 min计。
1.2.4 DPPH自由基清除率测定方法
DPPH自由基清除率测定根据文献[7-8]。计算DPPH自由基清除率。
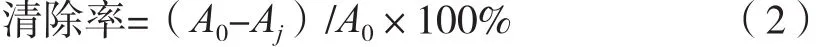
式中:A0为空白组中DPPH溶液和甲醇混合液的吸光度;Aj为试验组(阳性对照组)中藜麦酵素工作液(维生素C溶液)和DPPH混合液的吸光度。
2 结果与分析
2.1 单因素试验结果
由图1可知,加水量在2~4倍之间时,藜麦酵素脂肪酶活力随加水量增多而上升;加水量为4倍时,其脂肪酶活力达到最大值,为63.36 U/mL;但随着加水量继续上升,脂肪酶活力开始下降。藜麦酵素脂肪酶活力随着加水量上升呈现先上升后下降趋势,可能是由于水分较少时,混合物发酵不完全,产生的脂肪酶较少,而当水分过多时,生成的脂肪酶被稀释,浓度较低。因此,最适宜加水量为4倍。
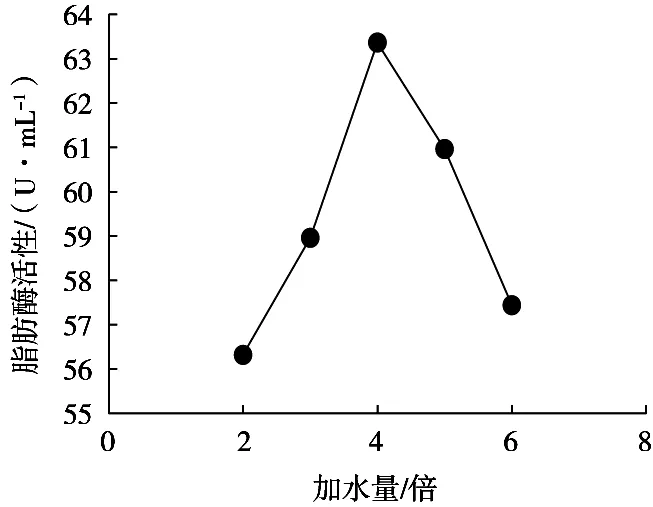
图1 加水量对藜麦酵素脂肪酶活性的影响
2.1.1 发酵时间的考察结果
由图2可知,发酵时间少于36 h,藜麦酵素脂肪酶活力随时间延长而上升,发酵时间36 h时,其脂肪酶活力达到最大值,为74.36 U/mL,但36 h后继续发酵,脂肪酶活力随时间的延长反而呈下降趋势。藜麦酵素脂肪酶活力随着发酵时间增长呈现先上升后下降趋势,可能与发酵过程中酵母菌产生脂肪酶较多,但藜麦中脂肪含量下降有关。因此,最适宜发酵时间为36 h。
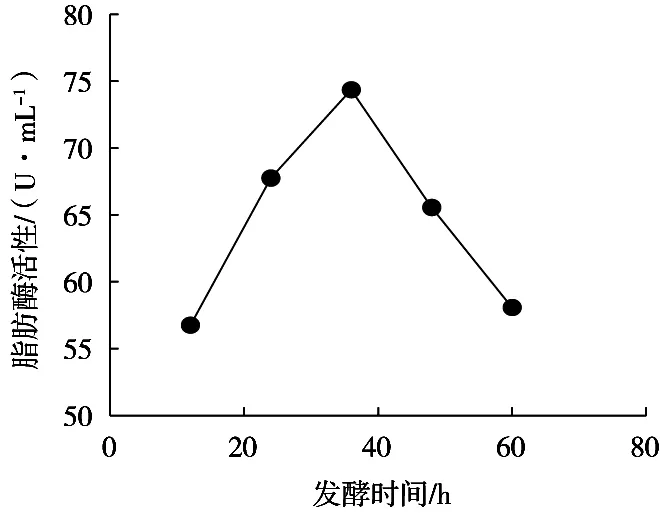
图2 发酵时间对脂肪酶活力的影响
2.1.2 发酵温度考察结果
由图3可知,发酵温度达37 ℃前,藜麦酵素脂肪酶活力随温度升高而上升,发酵温度37 ℃时,其脂肪酶活力达到最大值,为52.80 U/mL,但随着温度继续升高,脂肪酶活力反而呈下降趋势。藜麦酵素的脂肪酶活力随着发酵温度升高呈现先上升后下降趋势,分析其原因可能是温度较低时,酵母菌生长受到抑制,温度过高则引起部分酵母菌失活,因此,最适宜发酵温度为37 ℃。
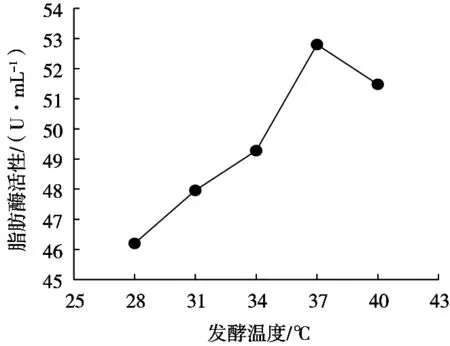
图3 发酵温度对脂肪酶活力的影响
2.1.3 接种量的考察结果
由图4可知,接种量10%~30%时,藜麦酵素脂肪酶活力随接种量增多而上升,接种量30%时,其脂肪酶活力达到最大值,为69.52 U/mL,但随着接种量增加到40%~50%时,脂肪酶活力反而开始下降。藜麦酵素脂肪酶活力随着接种量增大呈现先上升后下降趋势,说明较低浓度酵母菌在一定时间内可使发酵液中脂肪酶活性明显增强,但浓度过高会减少脂肪酶生成,因此,最适宜接种量为30%。
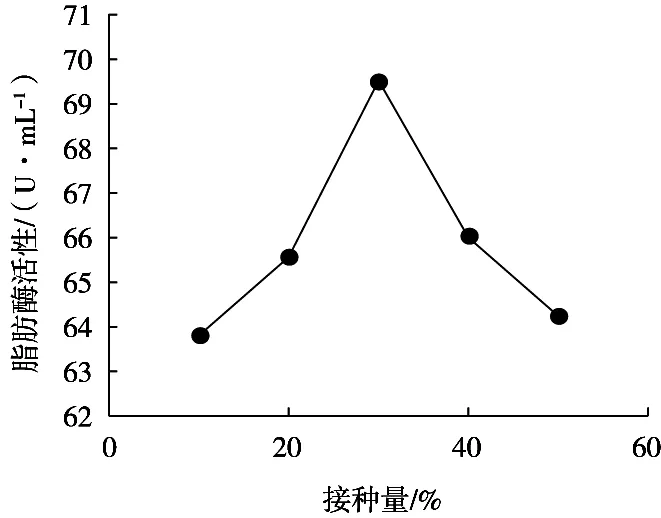
图4 接种量对脂肪酶活力的影响
2.2 正交试验结果
选择脂肪酶活力和DPPH自由基清除率2项指标进行加权评分,综合评分=脂肪酶活力×0.6+DPPH自由基清除率×0.4。正交试验结果及综合评分见表2。
方差分析见表3。由正交试验综合评分及方差分析结果可知,3个因素的影响程度各不相同,比较所得p值可知,发酵时间对制备藜麦酵素的综合影响具有显著性(p<0.05),发酵温度和发酵时间对综合评分的影响均无显著性差异。由此可知,发酵时间应选最佳水平,发酵温度和接种量根据实际情况进行选择。确定藜麦酵素最佳发酵条件组合为A3B2C1,即:发酵时间48 h、发酵温度37 ℃、接种量20%。
2.3 验证试验结果
按照2.2所得的最佳工艺制备藜麦酵素,进行3次平行试验,测定其脂肪酶活力和DPPH自由基清除能力,并计算其相对标准偏差(RSD),试验结果如表4所示。
结果表明,3次验证试验的综合评分平均为72.12分,RSD值为2.36%,证明藜麦酵素的最佳制备工艺稳定可行,按照该工艺发酵制得的藜麦酵素有较好的脂肪酶活性和DPPH自由基清除能力。
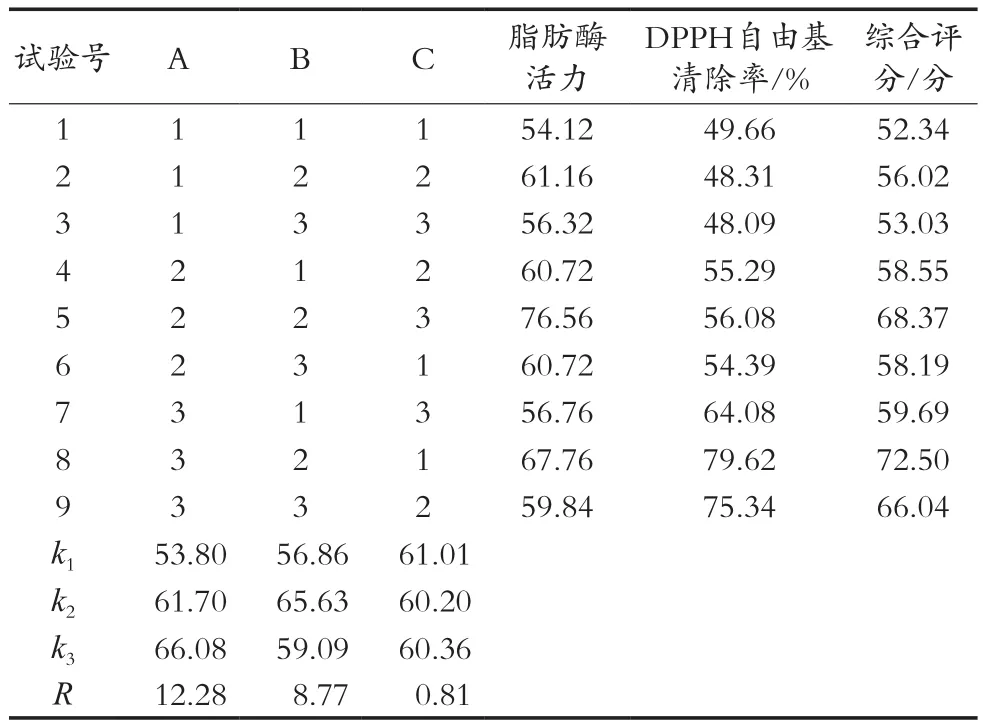
表2 正交试验结果
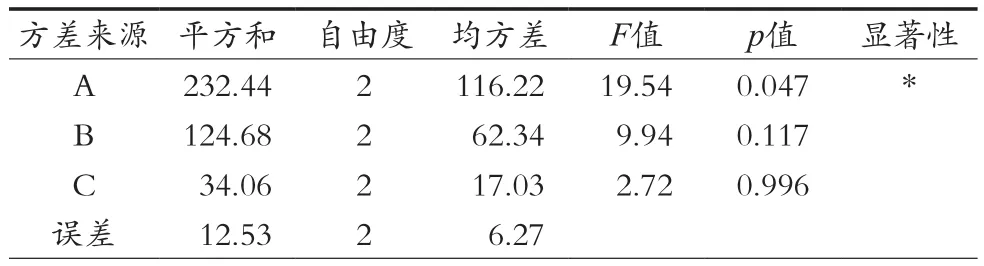
表3 正交试验方差分析表
2.4 还原能力对比试验结果
以维生素C为阳性对照,按照1.2.4的方法操作,分别测定最佳工艺制备的藜麦酵素与维生素C的DPPH自由基清除率,比较二者还原能力。结果如图5和图6所示。
结果表明,藜麦酵素清除DPPH自由基的拟合线性方程为y=0.066 8x-0.946,R=0.999 0,DPPH自由基清除率与藜麦酵素工作液的量呈良好线性关系;维生素C工作液清除DPPH自由基的拟合线性方程为y=0.244 9x-3.456,R=0.996 7,DPPH自由基清除率与维生素C工作液的量呈良好的线性关系。经计算可知,清除率50%时,21.65 μL藜麦酵素液与16.15 μL质量浓度为1 mg/mL的维生素C溶液的抗氧化能力相当,即藜麦酵素液还原力相当于维生素C溶液的75%。表明藜麦酵素具有良好抗氧化能力。
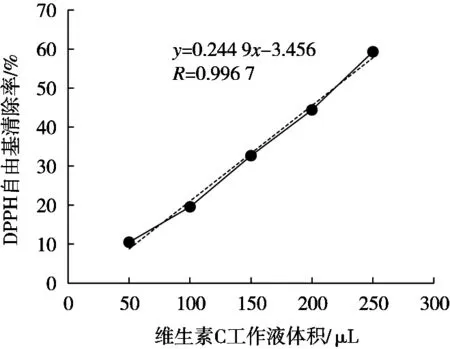
图6 维生素C清除DPPH自由基结果
3 结论与讨论
粮谷类酵素经发酵制成酵素后,不仅保留原材料自身含有的营养物质,还增加其中有些功能性成分含量,产生新的生物活性成分,增强其可食用性和保健功能。试验以藜麦为主要原料,以脂肪酶活力和DPPH自由基清除率为考察指标,通过单因素试验粗选藜麦酵素的发酵条件,并采用正交试验对其进行优化。
通过单因素结合正交试验,筛选出藜麦酵素最佳发酵条件为:发酵时间48 h、发酵温度37 ℃、接种量20%。按此工艺制备而成的藜麦酵素的脂肪酶活力可达67.76 U/mL,DPPH自由基清除率可达79.62%。还原能力对比试验表明,清除率50%时,藜麦酵素液还原力相当于质量浓度为1 mg/mL维生素C溶液的75%。证明按照试验所得最佳工艺制备的藜麦酵素具有良好脂肪酶活性和抗氧化能力。
在我国,由藜麦发酵制备的产品尚为数不多,相关技术研究有待深入。试验结果为藜麦发酵产品的相关研究提供更多参考依据,丰富藜麦产品市场,推动藜麦产业可持续发展。

