成都地区体检人群幽门螺旋杆菌感染与骨转换标志物相关性分析
麦涛 刘琳 王加强 苏杨
1. 四川省医学科学院 四川省人民医院检验科,四川 成都 610072 2. 西藏自治区人民政府驻成都办事处医院检验科, 四川 成都 610041
骨质疏松症是全球性的公共健康问题之一,其并发症脆性骨折可使患者致残,并严重影响患者的生活质量。骨质疏松症的具体病因目前尚未完全明确,一般认为与内分泌、遗传、废用、疾病、生活习惯、环境等密切相关[1-2]。目前,有少量研究关于骨质疏松症与患者体内的幽门螺旋杆菌(helicobacter pylori,HP)感染相关性的研究[3-5],其中部分报道认为两者之间不存在相关性[6]。因此,有必要在大样本基础上深入分析其与骨质疏松症的关系。
骨代谢标志物(bone metabolic marker,BMM)是指能反映骨骼组织代谢状态的物质,这些物质包括了通常所指的骨代谢调节激素(血钙、血磷、PTH等)和骨转换标志物(bone turnover marker,BTM)。笔者对我院1484例健康体检者就HP感染与其骨转换标志物即总I型胶原氨基端延肽(total N-terminal procollagen I propeptides,TPINP)、β-胶原降解产物(C-terminal Telopeptides of Type I collagen, β-CTx)和骨钙素(N end of osteocalcin,N-MID)进行回顾性分析,探讨在HP感染健康人群中两者的相关性,以期为骨质疏松症的预防和医疗干预提供依据。
1 材料和方法
1.1研究对象
来自 2017年 1 月至 2018 年 9 月四川省人民医院成年体检者1484名。其中男性854名,年龄20~87岁,平均年龄(46.1±9.3)岁;女性630名,年龄24~81岁,平均年龄(46.8±9.4)岁。排除标准:患有严重心脏、肝肾疾病、血液系统疾病、自身免疫性疾病或其他慢性严重感染性疾病。鉴于所调研的骨代谢指标存在性别差异,根据HP感染情况(血清HP抗体筛查)[3],将研究对象分为男性HP(+)组、男性HP(-)组、女性HP(+)组、女性HP(-)组。划分依据见表1。
1.2方法与仪器
1.2.1血清样本采集:清晨空腹状态下采集静脉血5 mL,采集时间为上午8点至11点。静脉血样本采集后室温静置1 h,3 000 r/min离心5 min,获得血清样本。样本检测、定标和质控过程严格按照实验室流程进行,检测结果稳定。
1.2.2骨转换相关指标:检测T-PINP、N-MID、β-CTx等指标的仪器为 Cobas6000e601全自动电化学发光免疫分析仪(德国罗氏诊断有限公司),T-PINP、N-MID和β-CTx试剂盒(德国罗氏诊断有限公司),按试剂商提供的标准操作程序,采用电化学发光法进行检测,检测原理采用夹心法。
1.2.3血清HP特异性IgG抗体的检测:采用北京贝尔生物工程有限公司生产的 HP抗体胶体金试剂进行,操作步骤严格按试剂商提供的标准操作程序进行。
1.3统计学处理
采用 SPSS 19.0统计软件进行统计分析,呈正态分布的计量资料采用均数±标准差表示,骨代谢指标采用单变量双因素(HP、性别)方差分析,各年龄段人数分布资料采用卡方分析,检验标准采用α=0.05,P<0.05认为差异有统计学意义。
2 结果
2.1一般性资料分析
对研究对象年龄构成的均衡性进行χ2检验分析,结果表明,男性组及女性组年龄段构成差异无统计学意义。另外,普通人群中男性组与女性组中,HP感染率均高,χ2检验分析结果表明不存在性别的影响。详见表1、表2。
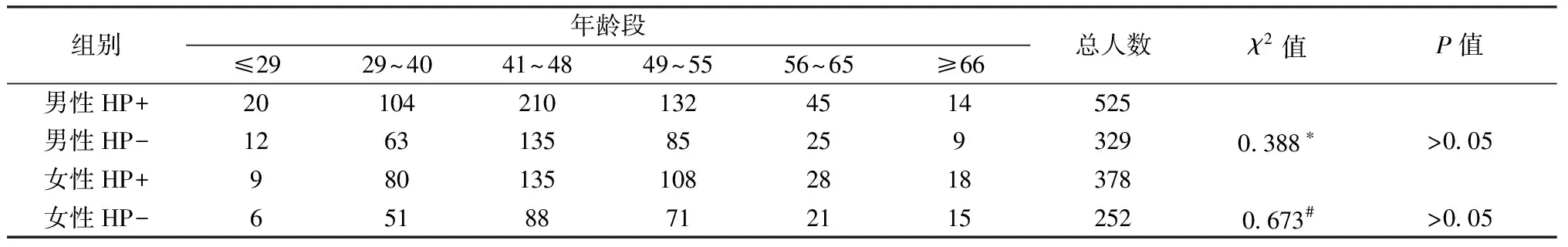
表1 研究对象各组年龄构成(n)Table 1 Age composition of each group of the study subjects
注: HP+男性组与HP-男性组比较,*P>0.05;#HP+女性组与HP-女性组比较,#P>0.05。
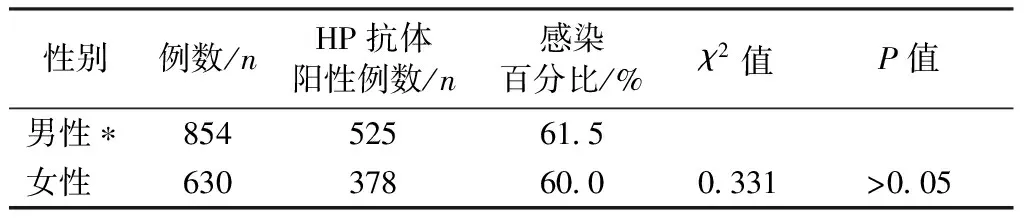
表2 体检人群HP感染情况Table 2 HP infection in the healthy individuals
注:男性组与女性组比较,*P>0.05。
2.2骨转换指标分析
结果表明在骨形成标志物T-PINP、N-MID,男性均小于女性,但方差分析结果表明为性别之间的差异不具有统计学意义。骨吸收标志物β-CTx则表现为男性大于女性,差异具有统计学意义。HP感染组与非感染组之间的T-PINP、N-MID和β-CTx均值大致相等,差异不具有统计学意义。
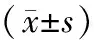
表3 各组骨代谢标志物及血清钙状况Table 3 Bone turnover markers and plasma calcium in each group
注:性别因素影响,*P>0.05;HP感染因素影响,#P>0.05。
3 讨论
前期研究表明,成都地区人群中HP感染率为52%~55.58%[7],但现阶段我们的调研结果显示感染率为60%~61.5%,说明成都地区近十年来HP的感染率还处于缓慢上升阶段。HP感染与人群生活方式、卫生习惯有关[8],因此,需要深化群众对幽门螺杆菌相关知识的了解,改变不良生活习惯,注重饮食卫生,从而降低HP感染率。
目前的研究表明,HP感染既与胃肠疾病如慢性萎缩性胃炎等相关,也与生活方式相关疾病如骨质疏松症也存在密切的相关性。但幽门螺杆菌感染所致炎症是否会导致这些疾病,仍存在争议[9]。骨质疏松症是多因素共同导致的增龄性疾病,病理表现主要为骨量减少、骨微结构受损、骨脆性增加、易骨折等。部分消化系统疾病如慢性胃炎与骨质疏松症之间有着密切关系,其原因在于这些疾病多伴有消化不良症状,患者易出现营养失衡,导致蛋白质及钙磷镁等摄入减少,最终导致骨量减少,发生骨质疏松[10]。
骨代谢标志物是反映骨骼细胞活性与骨基质形成或吸收代谢水平的生化产物。目前发现的具有较高灵敏度和特异性的标志物为骨形成标志物T-PINP、N-MID及骨吸收标志物β-CTx[11]等。临床通过检测其血或尿中浓度水平,了解骨组织新陈代谢的情况,早期诊断代谢性骨病、预测骨量丢失、骨折和监测药物疗效[11-13]。
慢性萎缩性胃炎(chronic atrophic gastritis,CAG)系指胃黏膜上皮反复受损所致慢性胃部疾病。现已证实HP感染是CAG的危险因素[14],而且患者多伴有骨质异常甚至骨质疏松[15]。其可能机制是HP感染刺激患者各种炎症因子的产生,影响胃或全身的炎症反应,从而导致局部或全身骨质疏松[16]。Mizuno等[3]利用血清学方法评估HP感染与CAG存在是否可作为患者发生骨质疏松的预测因子。发现HP感染并发CAG均显著增加患者骨小梁密度降低的风险。因此,他们认为HP感染并发CAG,可以用于CAG患者并发骨质疏松症的风险评估。
但也有学者认为,HP感染与患者骨质疏松症不存在显著性关联。Chen等[17]在对社区人群使用骨折风险评估工具分析HP感染、脂联素、瘦素和10年骨折风险之间的关联时发现HP感染无法预测任何一种性别的10年骨折风险。Chinda等[18]分析日本体检妇女中HP感染与骨质减少、雌激素水平、钙摄入量和几种生活方式因素之间的关系,多元分析结果显示,日本妇女骨质减少与雌激素水平的降低及不良生活方式相关,与HP感染无关。Ozdem等[19]研究发现,儿童HP阳性组与HP阴性组比较,其血清骨代谢标志物水平差异没有统计学意义。在国内,我们首次大样本、性别年龄均衡的分析HP感染无症状人群及非感染者的骨转换标志物水平,借此探讨HP感染与患者骨质疏松症的关联情况。检测结果显示,血清β-CTx骨吸收标志物在性别之间表现出差异,这可能与女性体内雌激素的影响有关[18]。但在血清中骨形成指标TPINP和N-MID,虽然男性小于女性,统计分析结果却表明性别或HP感染均不存在显著性影响。这一发现也证实HP感染引起的炎症反应所致患骨质疏松症机制假说可能是不成立的[20]。因此在无症状人群长期的HP感染过程中,是否会增加骨质疏松的风险,还需要进一步深入研究。

