甲状旁腺激素联合降钙素对大鼠骨质疏松性骨折骨生长因子的影响
鲍根强 肖春来 张国辉 李华 赵晓亮 王泉
哈励逊国际和平医院手足外科,河北 衡水 053000
骨质疏松症(osteoporosis,OP)是以骨量骨密度降低,骨组织微结构退化,骨强度下降,骨组织脆性增加,骨折危险性增大为特点的全身性骨骼疾病[1]。骨质疏松性骨折(osteoporotic fracture,OPF)作为其最严重的并发症,OP不仅增加了患者发生骨折的风险,也使得骨折愈合更加困难[2]。目前,临床治疗骨质疏松的药物主要包括激素调节药物、加速骨形成药物、促进骨矿化药物等,这些药物对治疗OP有一定的疗效,但也伴随严重的不良反应[3]。而甲状旁腺素联合降钙素防治OP以其安全、不良反应小等特点,在治疗上有较大优势。骨折修复愈合需要相关骨生长因子的参与和调节。因此,本研究探讨甲状旁腺素联合降钙素对骨质疏松性骨折骨生长因子及骨折愈合的影响,为临床药物治疗OPF提供理论依据。
1 材料和方法
1.1实验试剂与材料
SPF级健康雌性SD大鼠75只,3月龄,体重(320±30)g,订购于北京中国医学科学院实验动物研究所(合格证号SCXK京2017-002)。重组人甲状旁腺素(1-34)(100 μg/支,批号:J201708072,美国Sigma公司),鲑降钙素注射液(密盖息)(50 IU/支,批号:1609045,瑞士诺华制药有限公司),柜式X线照片机购置于美国美国Hologic公司,双能X线骨密度测定仪购于美国GE公司,ELISA检测试剂盒订购于武汉云克隆科技股份有限公司,兔抗鼠骨形态发生蛋白-2(bone morphogenetic protein-2,BMP-2)、转化生长因子-β(transforming growth factor-β,TGF-β)、胰岛素生长因子-1(insulin like growth factor-1,IGF-1)、血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)多克隆抗体均购于武汉博士德生物有限公司。
1.2方法
1.2.1实验分组与药物干预
实验按随机数字法分为:假手术组、去势组、甲状旁腺素组、降钙素组、联合用药组,假手术组仅切除部分脂肪组织,其他3组均行双侧卵巢切除术。4周后各组均行右侧股骨干闭合性骨折髓内固定术。于术后第2 d分别给予不同药物干预,假手术组、去势组:皮下注射0.9% NaCl 5 mL/kg,1次/d;甲状旁腺素组:皮下注射PTH(1-34)50 μg/kg,1次/d;降钙素组:皮下注射降钙素5~10 IU/kg,1次/d;联合用药组:皮下注射PTH(1-34)50 μg/kg,1次/d,皮下注射降钙素5~10 IU/kg,1次/d,连续用药8周。SD大鼠饲养SPF级屏障环境。
1.2.2构建去卵巢大鼠骨质疏松骨折模型
参照骆阳等[4]构建去卵巢大鼠骨质疏松性骨折模型与内固定方法。各组大鼠均分笼饲养,标准饲料,自由饮水,照明、通风、温度、湿度等饲养环境条件均相同。
1.2.3组织标本处理
摄片后10%水合氯醛麻醉,采取急性大失血法处死大鼠,打开胸腔,左心室采血3~5 mL,3 000 r/min,离心15 min,收取上层血清0.5~1 mL,-20 ℃保存备用。剥离取出右股骨,依次分离软组织,拔出髓内克氏针,保护骨痂组织。截取骨折端长约1~2 cm股骨痂,0.9% NaCl冲洗后于10%甲醛溶液固定,10%硝酸脱钙6周,乙醇梯度脱水,二甲苯透明,石蜡包埋,制作5 μm连续组织切片,切片60 ℃烤箱4 h,取出室温保存备用。
1.2.4放射性(X线)检查
术后6周各组选取15只SD大鼠进行X线摄片,观察各组大鼠骨折端骨痂生长和骨折线模糊情况。放射学评估采用Warden等[5]的X线评分方法,依据骨折断端表现进行骨折愈合评分。
1.2.5骨痂骨密度(BMD)和矿物含量(BMC)测定
取出待测右股骨骨痂,在LUNAR双能X线吸收扫描仪扫测股骨痂,采用小物体扫描模式,以分辨率1.0 mm×1.0 mm,扫描速度60 mm/s,扫描宽度5.0 cm的参数值,以2.0 mm×2.0 mm为中心区域,检测骨痂BMD和BMC值。
1.2.6血清生化指标水平测定
采用ELISA试剂盒检测血清BMP-2、VEGF、TGF-β、IGF-1水平,按照试剂盒说明书步骤进行操作。
1.2.7HE染色
参照HE染色法实验步骤进行操作[4],光镜下观察染色并采集图片。随机选取5个视野,计数新生血管数,取平均值。
1.2.8免疫组织化学染色法
参照免疫组织化学染色法实验步骤进行操作[6],光学显微镜观察并采集图片。Image-Pro Plus 6.0图像分析软件分析,免疫组织化学染色结果采用平均光密度值(MOD)表示。
1.3统计学处理
2 结果
2.1各组骨折愈合及评分
假手术组骨折线模糊不清,骨折端有明显骨痂包绕生长,连接紧密,骨密度增高,已达到临床愈合;去势组骨折线依然清晰可见,少量骨痂生长,未连接,骨折愈合欠佳;甲状旁腺素和降钙素组骨折线部分模糊,骨痂部分生长,部分连接紧密,骨痂塑形改造期;联合用药组骨折线模糊或消失,骨折端有连续性骨痂包绕贯穿,大量骨性骨痂形成,开始重建塑形,骨折处髓腔再通。假手术组、去势组、甲状旁腺素组、降钙素组、联合用药组骨折愈合评分分别为:4.788±0.225、2.840±0.134、3.927±0.152、3.862±0.160、4.431±0.175。去势组较假手术组骨折愈合评分显著降低(P<0.05),甲状旁腺素组、降钙素组、联合用药组均较去势组骨折愈合评分升高,其中以联合用药组升高最显著(P<0.05)。见图1。
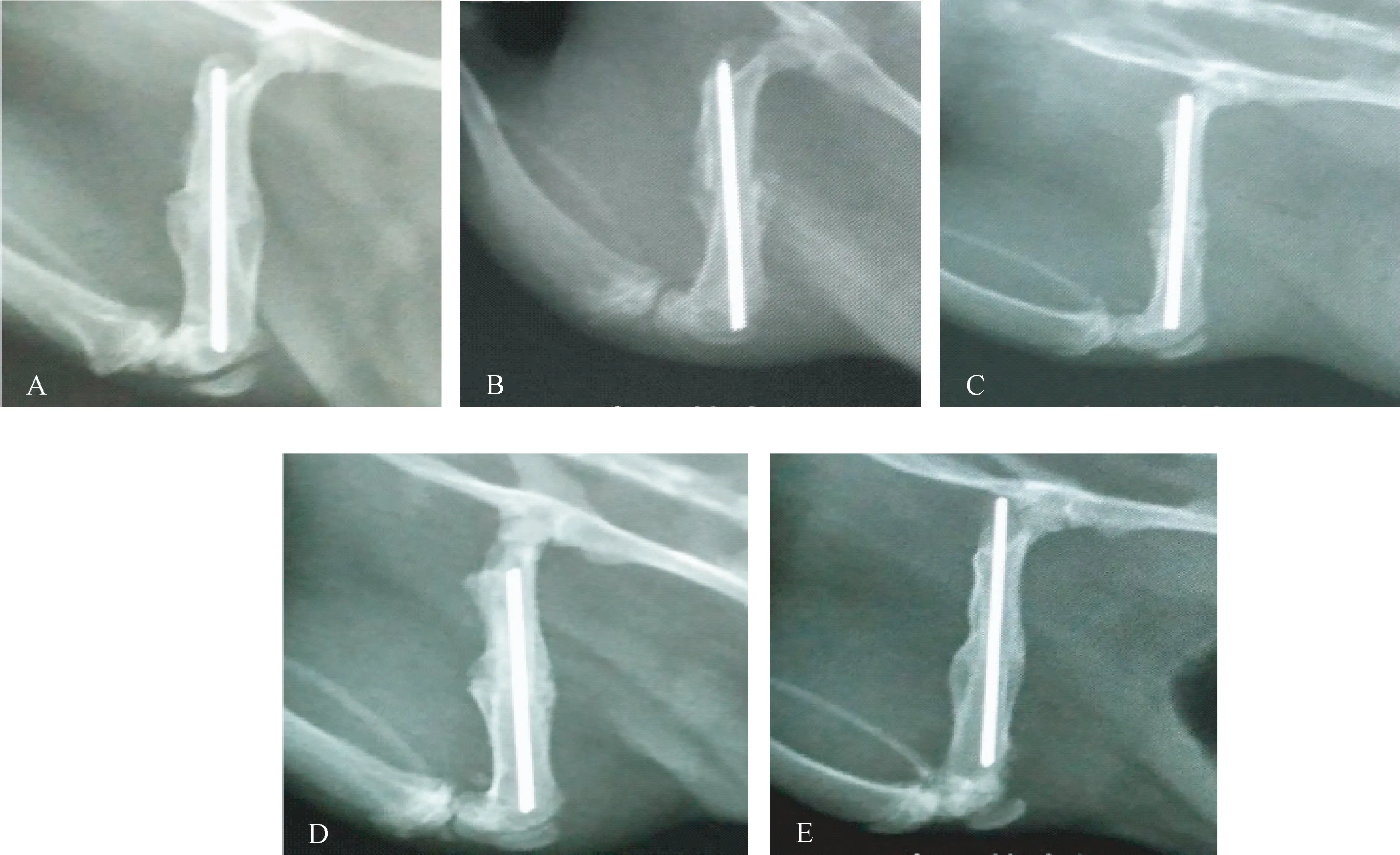
图1 X线观察骨折愈合情况注:A 假手术组;B 去势组;C 甲状旁腺素组;D 降钙素组;E 联合用药组Fig.1 X-ray observation of fracture healing
2.2各组骨痂BMD和BMC
去势组较假手术组股骨BMD和BMC显著降低(P<0.05),甲状旁腺组、降钙素组、联合用药组均较去势组股骨BMD和BMC增高,其中尤以联合用药组增高最显著(P<0.05)。见表1。
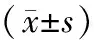
组别nBMD/(g/cm2)BMC/(g)假手术组 150.215±0.0451.143±0.036去势组 150.127±0.020∗0.564±0.023∗甲状旁腺素组150.172±0.0270.980±0.025降钙素组 150.166±0.0310.953±0.026联合用药组 150.195±0.046#1.127±0.030#
注:与假手术组比较,*P<0.05;与去势组比较,#P<0.05。
2.3各组血清生化指标水平
去势组较假手术组血清BMP-2、VEGF、TGF-β、IGF-1水平均显著降低(P<0.05),甲状旁腺素组、降钙素组、联合用药组均较去势组血清BMP-2、VEGF、TGF-β、IGF-1水平升高,其中以联合用药组升高最显著(P<0.05)。见表2。
2.4各组骨痂组织学观察
假手术组骨痂区大量骨小梁形成,生长旺盛,排列致密有序,交错成网状,成骨细胞数量较多,形成致密板层状骨,周围见骨髓腔再通。去势组骨痂区骨小梁明显减少,生长稀疏,间隙增宽不连续,排列紊乱,大量间充质干细胞及纤维软骨细胞,成骨细胞、新生微小血管少见。甲状旁腺素组和降钙素组骨痂区骨小梁较前增多,排列较规则,小梁周围血管生成增多,成熟骨细胞及成骨细胞较前增多。联合用药组骨小梁多,生长旺盛,交错网状,排列致密有序,较多成熟的骨细胞及成骨细胞,局部见编织骨。
2.5各组蛋白表达
BMP-2主要表达于成骨细胞胞浆,VEGF主要表达于成骨细胞质及少量成熟软骨细胞内,TGF-β主要表达于软骨细胞、成骨细胞以及间充质细胞,
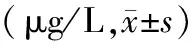
表2 各组血清BMP-2、VEGF、TGF-β、IGF-1水平比较Table 2 Comparison of serum BMP-2, VEGF, TGF-β and IGF-1 levels in each group (μg/L,)
注:与假手术组比较,*P<0.05;与去势组比较,#P<0.05。
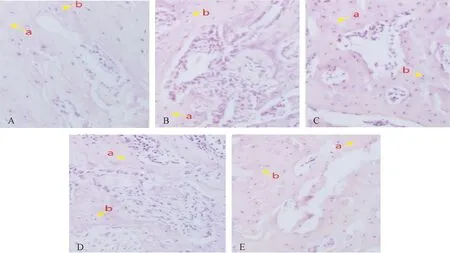
图2 HE染色观察骨痂的形态结构变化(×200)注:A 假手术组;B 去势组;C 甲状旁腺素组;D 降钙素组;E 联合用药组;a 骨小梁,b 软骨细胞Fig.2 Morphological changes of bone callus was observed by HE staining (×200)
IGF-I主要表达于成纤维细胞、软骨细胞以及成骨细胞。去势组较假手术组BMP-2、VEGF、TGF-β、IGF-1蛋白表达显著降低(P<0.05),甲状旁腺素组、降钙素组、联合用药组均较去势组BMP-2、VEGF、TGF-β、IGF-1蛋白表达升高,其中以联合用药组升高最显著(P<0.05)。见表3。
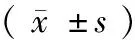
表3 各组骨痂组织BMP-2、VEGF、TGF-β、IGF-1表达比较Table 3 Comparison of BMP-2, VEGF, TGF-β and IGF-1 expression in osteophytes of each group ()
注:与假手术组比较,*P<0.05;与去势组比较,#P<0.05。
3 讨论
OPF修复愈合是一个极其复杂有序的骨组织再生过程,涉及多种细胞和细胞因子参与调控,骨生长因子是指具有刺激骨细胞生长活性的因子,在骨折愈合过程中起重要调节和促进作用,细胞因子通过影响骨细胞的分化、增殖和成熟,刺激骨和软骨形成,调节骨质重建,参与骨折愈合的全过程[7]。
甲状旁腺激素(PTH)是骨代谢过程中调节钙磷代谢的重要调节因子,PTH(1-34)不仅刺激软骨细胞增殖分化以及软骨和纤维性骨痂形成,而且还能刺激前成骨细胞增殖、产生碱性磷酸酶及骨基质蛋白,促进骨形成,使纤维性骨痂转化为骨性骨痂[8]。同时,它也可以提高骨痂的生物机械性能,增加软骨钙化,加速骨折愈合[9]。降钙素(calcitonin,CT)是调节骨代谢的重要激素,CT能抑制破骨细胞的活性和减少破骨细胞的数量,从而抑制骨组织的自溶和吸收,减少骨骼中钙和骨基质的流失,抑制骨转化,防止骨量丢失,提高骨密度[10]。此外研究表明CT不仅能作用于成骨细胞,刺激成骨细胞增殖和分化,而且还可阻止成骨细胞的凋亡,促进骨小梁的改建,促进骨折愈合[11]。本研究表明去势组较假手术组骨折愈合评分、股骨BMD和BMC均显著降低(P<0.05),甲状旁腺素组、降钙素组、联合用药组均较去势组骨折愈合评分、股骨BMD和BMC均升高,以联合用药组升高最显著(P<0.05)。去势组骨痂骨小梁明显减少,生长稀疏,排列紊乱,成骨细胞、新生微小血管少见。联合用药组骨小梁多,生长旺盛,排列致密有序,较多成熟的骨细胞及成骨细胞。同样,刘海蔚等[12]研究表明PTH(1-34)联合降钙素能明显增加腰椎BMD,升高骨转换指标。金成春等[13]研究表明甲状旁腺素联合鲑鱼降钙素治疗老年骨质疏松合并Garden I股骨颈骨折是一种安全、疗效更好的方法。
骨形态发生蛋白(bone morphogenetic protein,BMP)是骨折愈合的关键性细胞因子之一,是转化生长因子-β(TGF-β)家族中的一组多功能细胞因子,具有诱导未分化间充质细胞增殖、分化成软骨细胞和成骨细胞,介导软骨、骨形成[14]。其中BMP-2的作用尤为显著,BMP-2具有显著促进间充质细胞转化为骨细胞的作用,促进骨折愈合。IGF-1是骨骼细胞分泌的重要生长因子,参与骨细胞生长、分化以及代谢的调节。IGF-1促成骨细胞及成软骨细胞的分化和增殖,可刺激胶原合成促进骨基质形成[15]。VEGF作为机体内促进血管生长最主要的生长因子,在骨折修复过程中起着重要的的作用,此外VEGF通过对骨原细胞有直接作用,刺激成骨细胞分化,促进骨形成[16]。TGF-β属于TGF超家族,TGF-β可刺激骨膜间充质细胞增殖、分化,促进成骨和成软骨细胞增生,刺激Ⅰ型胶原合成,诱导膜内成骨及软骨内成骨过程,TGF-β还可促进骨痂形成并提高骨痂强度[17]。此外TGF-β还可促进分化的成骨细胞聚集活化,从而加速骨的修复和再生。本研究表明去势组较假手术组血清BMP-2、VEGF、TGF-β、IGF-1水平和骨痂BMP-2、VEGF、TGF-β、IGF-1蛋白表达均显著降低(P<0.05),甲状旁腺素组、降钙素组、联合用药组均较去势组血清水平和骨痂蛋白表达均升高,其中以联合用药组升高最显著(P<0.05)。
综上所述,甲状旁腺素联合降钙素通过介导增加骨生长因子(BMP-2、VEGF、TGF-β、IGF-1)的表达,提高去卵巢大鼠骨质疏松性骨折骨密度和矿物含量,改善骨组织形态学,进而加快骨折愈合。骨折修复愈合是一个极其复杂的过程,涉及多种细胞和细胞因子的相互作用,甲状旁腺素联合降钙素在骨质疏松性骨折愈合过程中起重要调节和促进作用,但其作用机制以及各细胞因子间的相互作用关系尚未完全阐明。因此,进一步明确其介导生长因子对骨细胞增殖、分化的作用和机制,尤其是各生长因子之间的相互作用是我们今后十分值得深入研究的课题。

