骨质疏松动物骨组织及血清柠檬酸含量变化的研究
王业杨 陈洪栋 王明森 黄伟斌 秦育滨 李焕彬 徐汪洋 周治来 张辉*
1. 广东省第二人民医院脊柱外科,广东 广州 510317 2. 广东省第二人民医院普外一科,广东 广州 510317 3. 普宁市中医医院骨科,广东 普宁 515300 4. 普宁市中医医院检验科,广东 普宁 515300
1941年,Dickens等首次发现骨组织含有较高浓度的柠檬酸[1],随后的很多报道证实骨组织与柠檬酸的关系[2-3]。骨组织中(及牙质)柠檬酸含量约为20~100 μmol/g。相对于软组织来讲,即为约5~25 μmol/g骨湿重。而一般软组织中仅含有0.1~0.5 μmol/g(湿重)柠檬酸。因此,骨组织中柠檬酸的含量约是软骨组织的10~20倍(前列腺组织例外)[3-5]。柠檬酸占骨总成分的1.6%左右,骨有机成分的5%,机体80%的柠檬酸存在于骨组织中[6-7]。这些信息提示我们柠檬酸是骨组织不可或缺的成分,在正常骨发育及骨维持中应该有非常重要的功能/结构作用。由年龄增长或激素缺失引发的骨量丢失是原发性骨质疏松的主要病因。骨质疏松导致骨强度下降,致使骨折在骨质疏松患者中尤其常见,特别是老年人及绝经后女性[8-9]。基于柠檬酸在骨结构及功能中作用的研究,本研究拟对骨质疏松动物模型中骨组织与血清柠檬酸水平变化进行检测,对这些问题的深入探讨对揭示柠檬酸在骨质疏松及早发现及预防中有重要的临床意义。
1 材料和方法
1.1实验材料
造模所用小/大鼠均购买于南方医科大学动物实验中心。动物饲养房:温度(22±1)℃,湿度59%~61%,每天光照与黑暗时间各12 h,普通饮食,自由进水。动物实验符合南方医科大学动物委员会伦理学标准。
柠檬酸检测试剂盒,去蛋白质试剂盒购自Biovision,TRAP染色试剂盒、维甲酸(retinoic acid)购自Sigma,血清生化分析试剂片购自北京世贸远东科学仪器有限公司。骨钙素抗体购自Abcam公司。
1.2实验方法
1.2.1骨质疏松动物模型的构建
激素缺失诱导小鼠骨质疏松模型的构建[10]:SPF级Balb/c小鼠,健康,雌性未孕,4~6周,体重为18~20 g。实验分为两组:正常对照组(Sham组),手术模型组(OVX组)。小鼠经3%戊巴比妥钠(40 mg/kg)腹腔麻醉后仰卧,腹部脱毛。在无菌条件下于腹股沟水平沿腹中线剪开皮肤及肌层,暴露腹腔。手术组分离子宫并摘除卵巢。对照组仅摘除卵巢周围1 g左右脂肪组织,而保留卵巢,其余操作均与手术组相同。清理伤口、缝合皮肤及基层,待小鼠清醒后,将其放回洁净笼具后放回饲养室继续饲养3个月,定期观察小鼠状态及死亡情况,每周测量体重。
小鼠老年骨质疏松模型建立:实验组小鼠为健康Balb/c雄鼠,自然饲养至20月龄(aged)。对照组小鼠选用6月龄 Balb/c雄鼠(adult)。
维甲酸(RA)诱导大鼠骨质疏松模型的建立[11]:清洁级SD大鼠,3.5月龄(200~250 g),健康,20只,雌雄各半。随机分为模型组和对照组,每组各10只,雌雄各半。维甲酸组(RA)大鼠每天给予维甲酸灌胃,持续灌胃14 d(70 mg/kg)。维甲酸溶液使用5%的硝酸纤维素钠配置。对照组给予5%硝酸纤维素钠的灌胃处理14 d(CON)。每周测一次体重变化。
1.2.2实验小鼠标本的收集和骨参数检测
各组小鼠在取材前一天使用micro CT活体检测骨组织参数、骨密度[12]。将各组小鼠/大鼠麻醉,称重,心脏穿刺采血。全血于室温静置2 h后,于6 000 r/min离心10 min,收集上层血清,保存至-80 ℃,备用。取小鼠下肢(股骨和胫骨),分别进行柠檬酸水平检测与骨组织石蜡切片制备。用于柠檬酸水平检测时,尽量剔除肌肉及筋膜组织,PBS冲洗3次,去除骨髓。将骨浸泡于氯仿:乙醇(1∶1)混合物中1 h,除去多余脂肪组织。去肉及去脂肪的骨组织样本于液氮研磨成粉末。取50 mg骨组织粉末加入2 mL HCl(1.0 mol/L),60 ℃水浴1 h。这一步骤可以溶解骨组织中的羟磷灰石(HA),使柠檬酸释放至溶液中。逐滴加入KOH(0.5 mol/L)使上述溶液pH=5。1 200g离心5 min,使胶原蛋白沉淀在离心管底部。上清转移至新的离心管,进行柠檬酸水平测定或者4 ℃保存备用。
用于切片制备时,简单剔出肌肉组织,保持关节完整,于4%多聚甲醛固定24 h,进行后续脱钙,包埋等。
1.2.3血清生化分析
血清生化分析使用Catalyst Dx®化学分析仪完成。血清中碱性磷酸酶(ALKP)、磷酸盐(PHOS)、钙(Ca)、钠(Na)、钾(K)以及氯(Cl)的含量使用相应的试剂片按照厂家说明进行检测。
1.2.4柠檬酸水平检测
血清样本由于蛋白质含量较高,在进行柠檬酸含量检测前需要去除血清样本蛋白质。该操作使用去蛋白试剂盒,参照说明书进行。去除蛋白质的血清及骨组织柠檬酸水平检测按照试剂盒说明书进行检测。
1.2.5苏木素&伊红(HE)染色
骨组织切片常规脱蜡水化后,苏木素溶液染色1 min,流水冲洗5 min;切片浸入1%盐酸酒精溶液分化10 s,流水冲洗至在光学显微镜下观察细胞核呈蓝色为止;醇溶伊红溶液染色2 min;常规步骤脱水透明、封片;于显微镜下观察。
1.2.6抗酒石酸酸性磷酸酶(TRAP)
根据试剂盒说明书配置TRAP染色液(现用现配)及固定液,将固定液及适量去离子水置于37 ℃预热。切片常规脱蜡水化后,固定液固定组织30 s,去离子水冲洗;将染色液滴于样品上,并于37 ℃避光孵育1 h。染色完毕后,用去离子水冲洗。甲基绿复染30 s,去离子水冲洗,封片保存。于显微镜下观察骨小梁表面粘附的破骨细胞数量变化。
1.2.7免疫组织化学染色(IHC)
骨组织石蜡切片常规脱蜡水化后,去离子水洗3次,5 min/次。将切片置于0.01 mol/L枸橼酸盐溶液(pH=6.0),于60 °C水浴过夜孵育(12 h),进行抗原修复。次日取出切片,自然冷却至室温。PBS洗3次,5 min/次。使用3% 过氧化氢溶液,室温避光孵育10 min。PBS洗3次,5 min/次。滴加5%正常山羊血清于37 ℃敷箱孵育1 h。甩去封闭液,滴加骨钙素一抗溶液(1∶100),于4 ℃过夜孵育。PBS洗3次,5 min/次。滴加辣根过氧化物酶标记的二抗溶液,37 ℃孵育1 h。PBS洗3次,5 min/次。滴加现配的DAB显色液,于显微镜下观察染色状态,及时终止。自来水冲洗5 min。苏木素染液染色1 min。1%盐酸酒精分化10 s,水洗5 min。常规脱水透明,用中性树脂封片后观察骨小梁表面成骨细胞数量变化。
1.3统计学处理
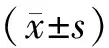
2 结果
2.1雌激素缺失诱导的骨质疏松小鼠骨组织中柠檬酸水平下降
6周龄小鼠在去卵巢手术后继续饲养3个月(OVX组),子宫由于雌激素的缺失严重萎缩(图1 A),与对照组相比(Sham组),体重显著升高(图1B)。micro-CT对股骨远端进行扫描分析,显示OVX组骨密度显著降低,骨小梁数量及厚度均显著减少,骨小梁分离度显著增加,BV/TV显著减少,皮质骨的内外径大小也显著降低(P<0.05,图1C-D),说明激素水平下降引起的骨质疏松小鼠模型构建成功。
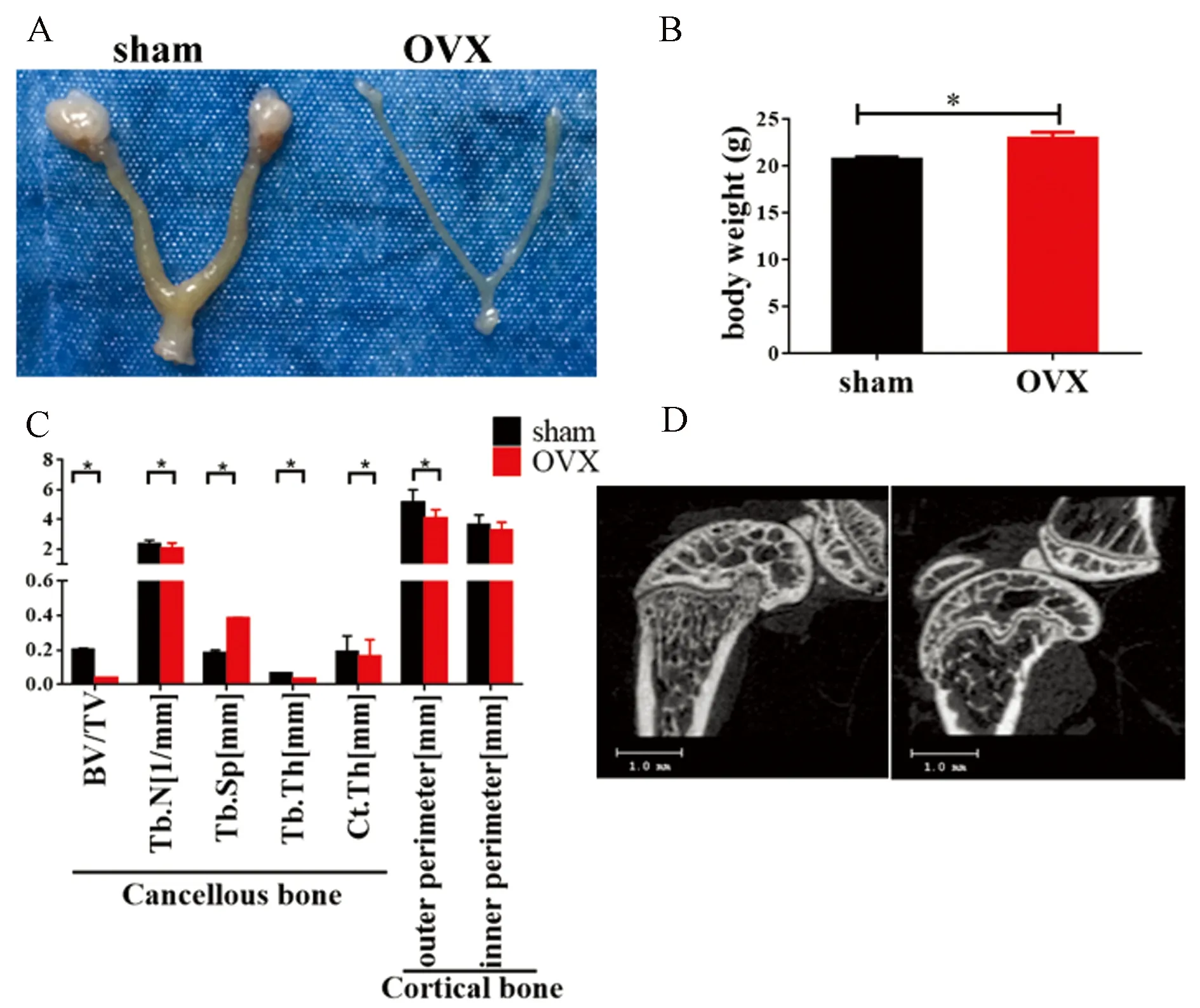
图1 去卵巢骨质疏松模型小鼠的构建成功注:A 6周龄雌性小鼠去卵巢手术后继续饲养,3个月后,去卵巢小鼠子宫出现萎缩;B体重显著增加; C 去卵巢小鼠的BV/TV,骨小梁数量,骨小梁厚度,皮质骨的厚度等均显著下降,而骨小梁分离度显著增加;D micro-CT二维重建股骨远端图片。与对照组相比,*P<0.05。Fig.1 Ovariectomy (OVX) mice showed phenotypes of osteoporosis
对OVX组及Sham组小鼠下肢骨组织切片进行染色,HE染色结果显示OVX组小鼠骨髓腔中脂滴数量增加,与文献报道一致[10]。而骨小梁数量显著减少,与micro CT结果一致(图2 A)。TRAP染色阳性的破骨细胞以及OCN染色阳性的成骨细胞数量均显著增加,说明OVX组小鼠呈现明显增加的骨吸收及骨形成(图2B-C)。
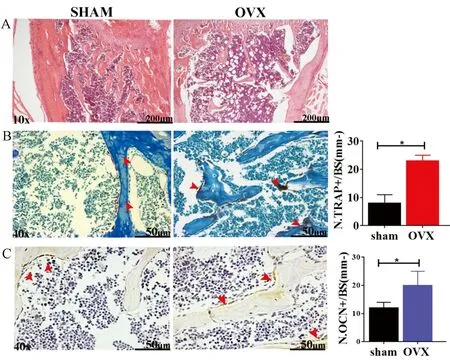
图2 去卵巢小鼠骨小梁表面成骨细胞与破骨细胞数量均增加注:A HE结果显示OVX小鼠骨小梁减少,骨髓腔脂滴增多; B TRAP结果显示OVX小鼠破骨细胞数量显著增多; C IHC结果显示OVX小鼠OCN阳性的成骨细胞数量显著增加。与对照组比较,*P<0.05;红色箭头 破骨/成骨细胞;N.TRAP+/ N.OCN+ 骨小梁表面破骨/成骨细胞数量。Fig.2 The number of osteoblasts and osteoclasts on trabecular surface of OXV mice significantly increased
上述结果结合OVX小鼠及对照小鼠骨密度差异(图3 A),确定OVX小鼠骨质疏松模型成功建立。随后对两组小鼠下肢骨组织中柠檬酸水平进行检测,发现与Sham组相比,OVX组小鼠每克骨组织中柠檬酸的水平显著降低(图3B,P<0.05)。
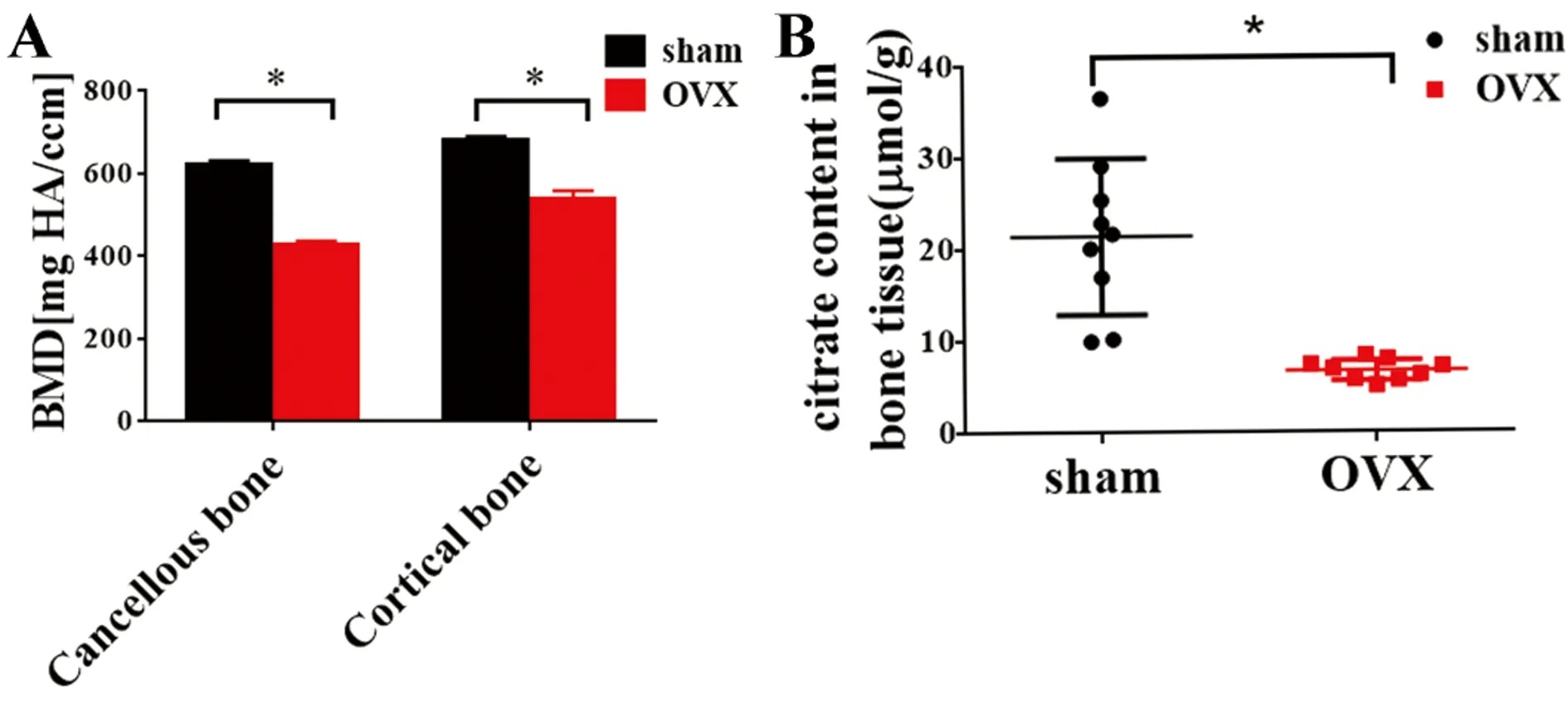
图3 去卵巢骨质疏松小鼠骨组织中柠檬酸水平下降注:A 小鼠去卵巢3个月后,骨密度显著下降;B OVX小鼠骨组织柠檬酸含量显著低于对照小鼠,*P<0.05。Fig.3 OVX mice showed significantly reduced citric acid content in bone tissue
2.2药物诱导的骨质疏松大鼠骨组织中柠檬酸水平下降
使用维甲酸灌胃的方法构建了药物诱导的SD大鼠骨质疏松模型。micro-CT分析结果显示,维甲酸灌胃14 d后,大鼠股骨及胫骨皮质骨和松质骨的骨密度相比对照组显著降低,大鼠出现明显骨量丢失(图4 A)。这些骨量丢失大鼠每克骨组织中柠檬酸的水平相比对照组也显著减少(图4B)。
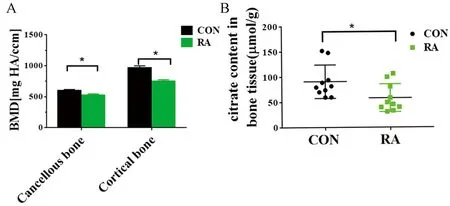
图4 维甲酸诱导的骨质疏松大鼠骨组织中柠檬酸水平均显著降低注:A 3.5月龄SD大鼠,维甲酸灌胃14 d,维甲酸组(RA)比对照组(CON)骨密度显著下降;B RA组骨中柠檬酸水平显著低于CON组,*P<0.05。Fig.4 Citric acid content in bone is reduced in retinoic acid (RA)-induced osteoporotic rats
2.3老年骨质疏松小鼠骨组织中柠檬酸水平下降
Micro CT分析结果显示与6月龄成年健康小鼠相比,20月龄的自然衰老组小鼠骨密度显著降低,骨小梁基本消失,骨小梁分离度显著增加,BV/TV显著减少,皮质骨的内外径大小也显著降低(P<0.05,图5 A-B)。HE染色结果与μCT 二维重建结果一致,老年鼠骨小梁基本消失(图5C)。老年小鼠TRAP染色阳性破骨细胞数量(图5D)及OCN染色阳性成骨细胞(图5E)的数量均显著低于年轻小鼠,说明老年小鼠的骨形成和骨吸收能力均下降。
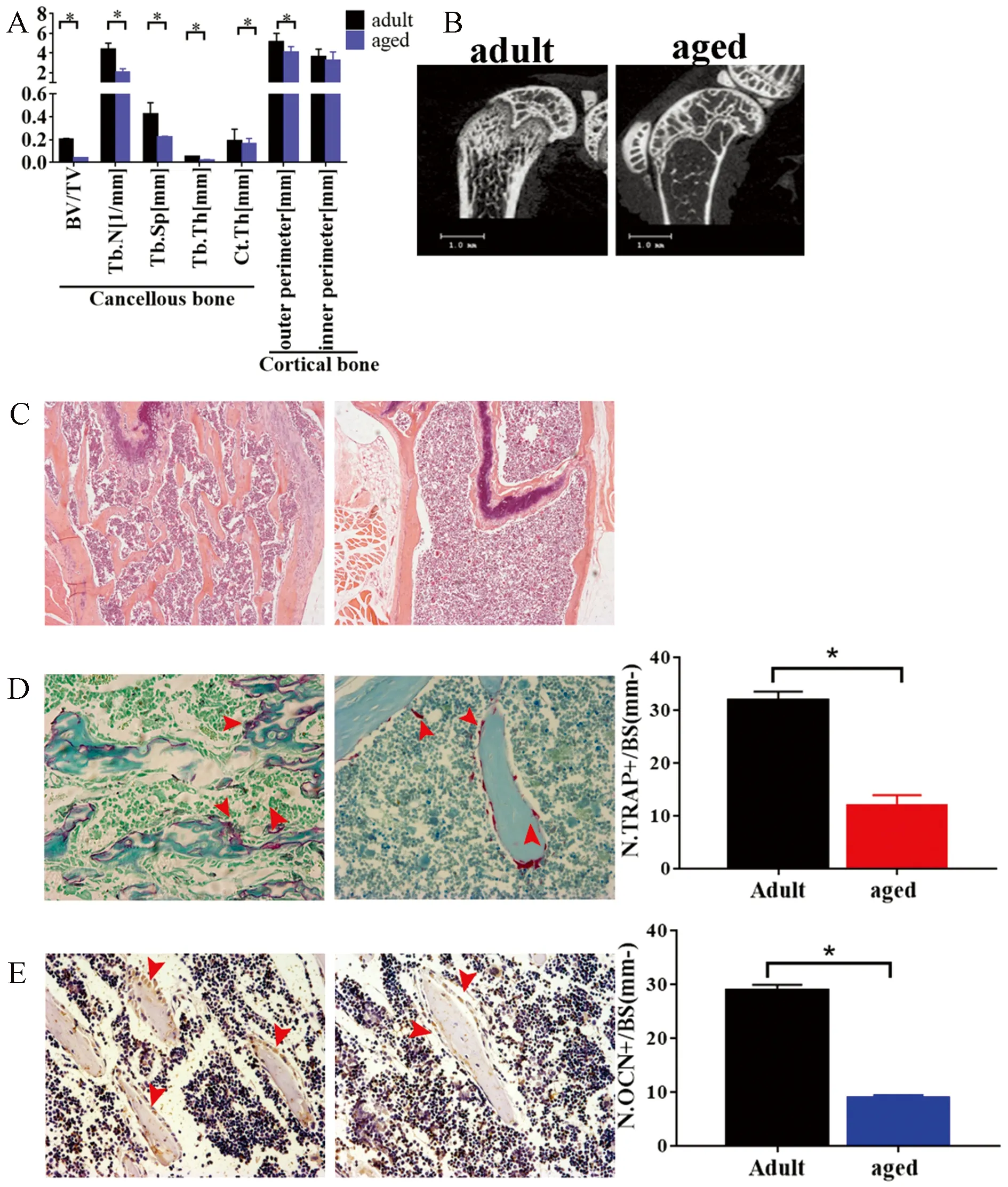
图5 20月龄老年小鼠出现增龄性骨质疏松注:A 自然衰老的20月龄与6月龄年轻小鼠的下肢骨的骨参数变化;B micro CT二维重建老年小鼠与年轻小鼠的股骨远端比较; C 骨组织切片HE染色检测破骨细胞数量(红色箭头); D 骨组织切片TRAP染色检测破骨细胞数量(红色箭头); E IHC染色检测OCN阳性成骨细胞数量(红色箭头)。N.TRAP+/N.OCN+:骨小梁表面破骨/成骨细胞数量,*P<0.05。Fig.5 Aged mice (20 months old) showed significant osteoporosis
与OVX骨质疏松小鼠及RA骨质疏松大鼠结果类似,单位重量老年骨质疏松鼠骨组织中柠檬酸水平也明显低于正常对照小鼠,说明骨中柠檬酸水平随着增龄性骨量丢失的发生而下降(图6)。
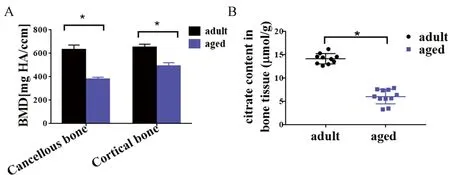
图6 老年骨质疏松鼠骨组织中柠檬酸含量显著降低注:A 自然衰老的20月龄老年鼠及6月龄健康成年鼠下肢骨使用microCT测量骨密度;B 老年鼠单位重量骨组织中柠檬酸含量较年轻鼠显著降低;*P<0.05。Fig.6 Citric acid content in aged mice was significantly reduced compared with adult mice
2.4骨质疏松小鼠及大鼠血浆中柠檬酸水平显著下降
与Sham组相比,OVX组小鼠血清中Ca、Na、K、Cl及 Phos水平没有明显变化,而 ALKP水平显著升高。与Sham组相比,同样体积的OVX小鼠血清中柠檬酸水平显著降低。而老年骨质疏松小鼠及RA骨质疏松大鼠血清中柠檬酸水平均显著低于相应的对照组。这些结果表明骨质疏松的大/小鼠血清柠檬酸水平也下降(图7)。
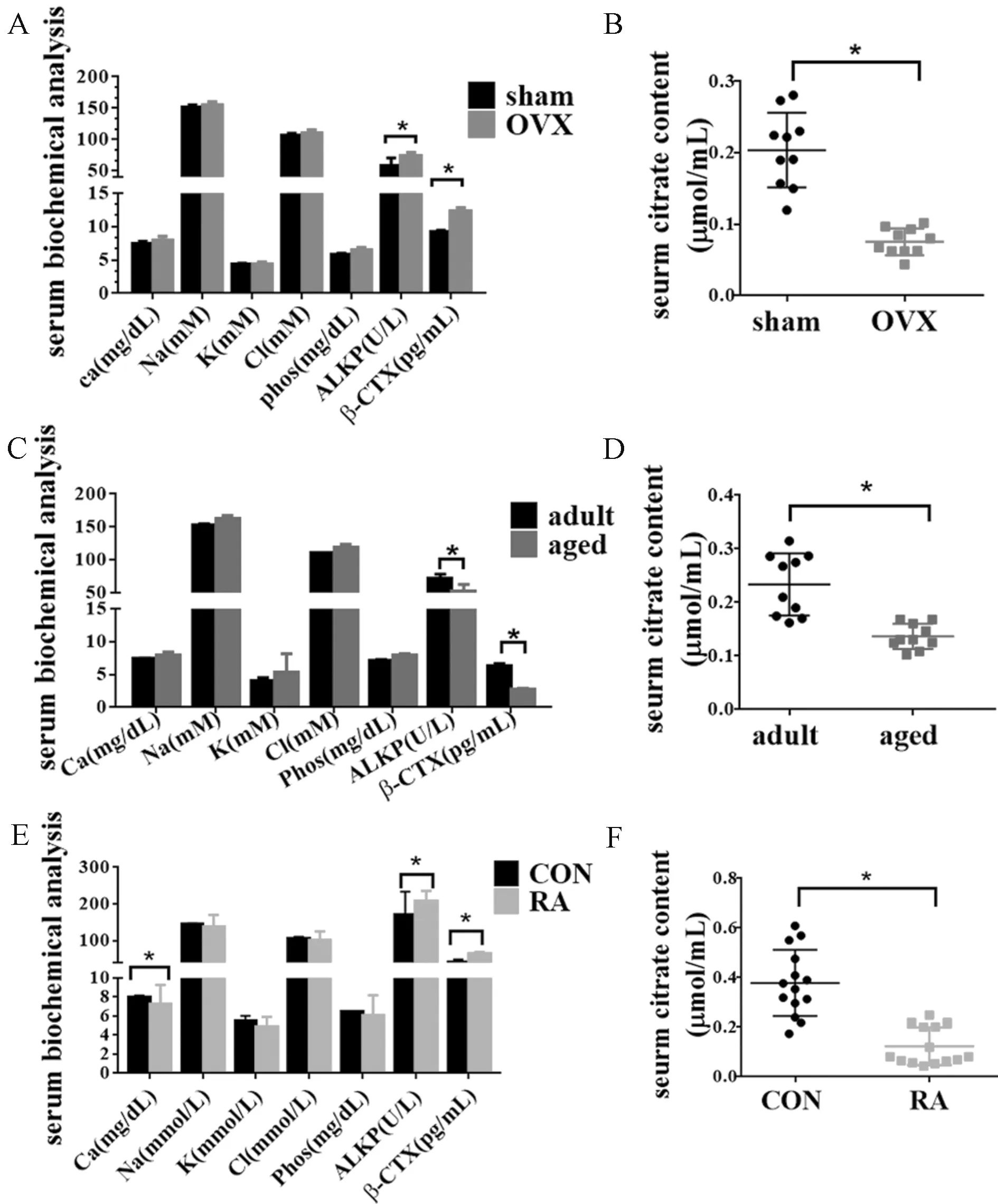
图7 骨质疏松的小鼠/大鼠血清柠檬酸水平均下降注:A OVX骨质疏松小鼠血清生化分析;B 老年小鼠血清生化分析;C 维甲酸诱导的骨质疏松大鼠血清生化分析。B、D、F 骨质疏松大/小鼠单位体积血清中柠檬酸水平显著低于对照组,*P<0.05。Fig.7 Serum citric acid concentration of osteoporotic mice and rats was decreased compared to controls
3 讨论
虽然柠檬酸在骨组织中含量很高这一观点早已提出[1,3,13],但骨中柠檬酸的来源及柠檬酸在骨发育、维持及骨病理性疾病中的作用尚没有明确报道。本研究中,我们发现在发生骨质疏松的骨组织中,柠檬酸水平显著下降。在发生骨量丢失的动物模型中,柠檬酸水平显著低于正常组。本研究将骨中柠檬酸与骨质疏松相联系,提示骨中柠檬酸可能在维持血液循环柠檬酸稳态中有重要作用。血清柠檬酸水平变化可能是年龄相关或激素缺失诱导的骨量丢失的一个标志。
骨强度由骨组织的两个特性决定:骨组织成分和骨结构(骨强度和骨质量)[14-16]。自1941年Dickens首次报道骨中高水平的柠檬酸,骨中柠檬酸的作用已经吸引了大量研究者的关注[2,17-18]。但由于研究方法及技术的限制,在很长一段时间,对骨中柠檬酸的研究相对较为停滞。直至Schmidt-Rohr及其团队使用多核磁共振(NMR)及距离测量分析了骨微结构表面的柠檬酸[7]。作为羟基磷灰石-胶原蛋白复合物的约束连接成分,柠檬酸占骨组织有机成分湿重的5.5%。Davies等[19]提出骨中柠檬酸参与形成骨的结构,水化层的柠檬酸在矿化片层之间形成桥梁,这一结构能合理解释一些已知的骨矿物结构特征。因此,骨中的柠檬酸不是增加钙溶解度的溶剂,而是磷灰石纳米晶体的一个强有力的结合成分,柠檬酸的结合赋予骨组织重要的生物力学性能和界面相容性,如骨稳定性,强度和抗骨折能力[3,20]。
在本研究中,我们成功构建了不同的骨质疏松大/小鼠模型,包括增龄性骨质疏松小鼠模型,维甲酸诱导大鼠骨质疏松模型及激素缺失诱导的骨质疏松小鼠模型,而发生骨质疏松的骨组织中柠檬酸水平均下降。骨质疏松发生时,骨形成(成骨细胞)与骨吸收(破骨细胞)之间的平衡被打破,同时骨髓间充质干细胞向成骨细胞的分化发生变化,而更有利于脂肪细胞的分化[21]。一方面,骨形成与骨吸收之间的失衡可能会减少成骨细胞柠檬酸的合成,另一方面,骨髓间充质干细胞向脂肪细胞的分化可能需要更多的柠檬酸作为细胞乙酰辅酶的来源用于脂肪酸的生物合成。这些与骨质疏松相关的病理条件可能导致骨质疏松骨中柠檬酸的产生下降,使参与骨结构的柠檬酸减少。骨质疏松性骨矿物的结晶度和生物力学性质也因此发生变化[20],降低了骨强度和骨质量,使骨质疏松人群易发脆性骨折。虽然骨质疏松发生中柠檬酸不足的作用尚待进一步探索研究,本研究显示骨中柠檬酸不足或减少与骨质疏松性有关。因此血清柠檬酸有可能是检测骨量丢失相关疾病的标志分子,如增龄性及绝经后骨质疏松,为这些疾病的预防和早期诊断提供新的依据。

