超声血流向量成像联合二维组织追踪技术评价心房颤动患者左心房心肌功能及血流能量损耗
刘 娟,尹立雪,*,孟庆国,徐 芸,王斯佳,严霜霜
(1.西南医科大学临床医学院,四川 泸州 646000; 2.四川省医学科学院 四川省人民医院超声医学研究所超声心脏电生理学与生物力学四川省重点实验室,四川 成都 610072)
心房颤动(atrial fibrillation, AF)是临床最常见的心律失常之一,可导致血栓栓塞、卒中和心力衰竭等严重并发症[1]。研究[2]发现AF可降低左心房内血流速度和涡旋强度,加重血液瘀滞状态;左心房内血流动力学受损是AF患者血栓形成及卒中发生的独立预测因子。采用血流向量成像技术(vector flow mapping, VFM)观测心腔内能量损耗(energy loss, EL),联合二维组织追踪(two-dimensional tissue tracking, 2DTT)技术同步定量评估不同类型AF患者左心房流固力学功能状态,有可能更客观地定量评估心腔内血流空间的弥散程度,反映心腔内血液流动状态[3]。本研究应用VFM联合2DTT技术同步评价不同类型AF患者左心房心肌功能改变及EL。
1 资料与方法
1.1 一般资料 选取2018年6月—2019年2月四川省人民医院经心电图诊断的75例AF患者。其中持续性AF(continuous AF, CAF)45例(CAF组),男30例,女15例,年龄37~79岁,平均(64.7±11.2)岁;阵发性AF(paroxysmal AF, PAF) 30例(PAF组),男12例,女18例,年龄36~80岁,平均(63.4±13.5)岁。合并高血压33例,糖尿病5例,脑梗死8例。根据2010年欧洲心脏病协会《房颤管理指南》分类标准,将7天内自行转复为窦性心律者定义为PAF,连续发作>7天且需药物或电复律转复为窦性心律者为CAF。纳入标准:动态心电图检查提示为窦性心律的PAF患者及AF心律的CAF患者。排除图像质量不佳、高血压控制不良(血压>140/90 mmHg)、糖尿病血糖控制不良(空腹血糖>7.0 mmol/L)、罹患甲状腺功能异常、心肌梗死、严重瓣膜反流或狭窄等影响心脏结构及功能疾病者。选取同期年龄、性别相匹配的41名健康志愿者为对照组,男22名,女19名,年龄37~76岁,平均(61.3±8.3)岁。本研究通过院伦理委员会批准,受试者均签署知情同意书。
1.2 仪器与方法 采用Aloka Prosound F75型彩色多普勒超声诊断仪,UST-52105相控阵探头,频率1.0~5.0 MHz,配备DAS-RSI工作站。于胸骨旁左心室长轴切面测量收缩末期左心房前后径(left atrial diameter, LAD),左心室舒张末期内径(left ventricular end-diastolic diameter, LVDD)。于心尖四腔心切面采用PW/TDI模式,同时获取二尖瓣口E峰血流速度(E)、二尖瓣口A峰血流速度(A)和二尖瓣环运动速度e、a,并计算E/A、E/e。采用Simpson双平面法测量左心室射血分数(left ventricular ejection fraction, LVEF),左心房最大容积(left atrial maximum volume, LAVmax)、左心房收缩前容积(left atrial preliminary systole volume, LAVpre)及左心房最小容积(left atrial minimum volume, LAVmin),经体表面积(body surface area, BSA)标化后获得相应左心房最大容积指数(left atrial maximum volume index, LAVImax)、左心房收缩前容积指数(left atrial preliminary systole volume index, LAVIpre)及左心房最小容积指数(left atrial minimum volume index, LAVImin);计算左心房整体射血量(left atrial total stroke volume, LASVt)、左心房被动射血量(left atrial passive stroke volume, LASVp)、左心房主动射血量(left atrial active stroke volume, LASVa)、左心房整体排空分数(left atrial total emptying fraction, LATEF)、左心房被动排空分数(left atrial passive emptying fraction, LAPEF)及左心房主动排空分数(left atrial active emptying fraction, LAAEF)。启动VFM模式,采集并储存至少5个心动周期标准心尖四腔心切面二维图像及左心房彩色血流图像,血流帧频≥20帧/秒。除CAF外,对其他受试者均在窦性心律下采集图像。测值均取3个心动周期平均值。
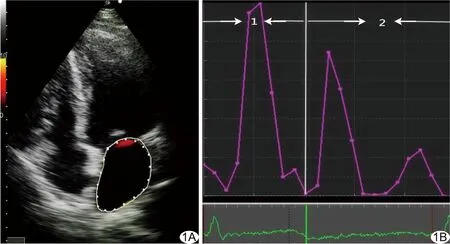
图1 左心房EL分析 A.LAEL测量图; B.LA的EL在一个完整心动周期中的变化,将心动周期分为收缩期和舒张期 (1:收缩期,2:舒张期)
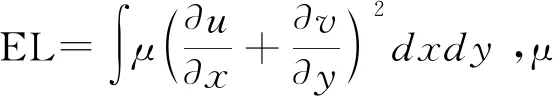
2DTT分析:于DAS-RSI工作站对心尖四腔心切面二维图像进行分析,测量左心房心肌力学参数,计算左心房收缩期峰值应变(left atrial systolic peak strain, SLAs)及应变率(left atrial systolic peak strain rate, SRLAs)、左心房舒张早期峰值应变(left atrial early diastolic peak strain, SLAed)及应变率(left atrial early diastolic peak strain rate, SRLAed)和左心房舒张晚期峰值应变(left atrial late diastolic peak strain, SLAac)及应变率(left atrial late diastolic peak strain rate, SRLAac)。
1.3 统计学分析 采用SPSS 22.0统计分析软件。对所有连续性计量资料进行正态性及方差齐性检验,符合正态分布的计量资料以±s表示,2组间比较采用独立样本t检验,满足方差齐性的3组间比较采用单因素方差分析;不符合正态分布或不满足方差齐性的计量资料比较采用秩和检验,并以中位数(上下四分位数)表示;分别分析EL-S、EL-D与左心房结构及心肌功能参数的相关性,满足双变量正态分布者采用Pearson相关分析,否则采用Spearman相关分析;分类资料间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
CAF组无法准确测得LAVIpre、LASVp、LASVa、LAPEF、LAAEF、A、a、SLAed、SLAac、SRLAed及SRLAac。CAF组心率快于其余2组(P均<0.001),3组间其他临床指标差异均无统计学意义(P均>0.05),见表1。
2.1 常规超声心动图参数 3组间LVDD、LASVt差异均无统计学意义(P均>0.05),LASVp、A、E/A在PAF组及对照组间差异无统计学意义(P均>0.05),CAF组LVEF低于PAF组及对照组(P均<0.05),但3组均在正常范围内。CAF组和PAF组LAD、LAVImax、LAVImin、E/e均高于对照组(P均<0.01),而LATEF均低于对照组(P均<0.05),CAF组LAD、LAVImax、LAVImin均高于PAF组(P均<0.05)。CAF组E高于PAF组及对照组(P均<0.05)。PAF组LAVIpre、LASVa均高于对照组(P均<0.05),而LAPEF、LAAEF、e、a均低于对照组(P均<0.05)。见表2。
2.2 左心房EL及心肌力学参数 CAF组、PAF组EL-S、EL-D、SLAs、SRLAs和PAF组SLAed、SLAac、SRLAed、SRLAac均低于对照组(P均<0.05),且CAF组SLAs、SRLAs均低于PAF组(P均<0.01),CAF组EL-S、EL-D均低于 PAF组,但2组间差异并无统计学意义(P均>0.05)。见表3、4。
2.3 相关性分析 各组EL-S与LATEF、SLAs、SRLAs均呈正相关(r=0.26、0.33、0.19,P均<0.05),与LAD、LAVImax、LAVImin均呈负相关(r=-0.34、-0.25、-0.29,P均<0.01);EL-D与LATEF、SLAs、SRLAs均呈正相关(r=0.30、0.38、0.25,P均<0.01),与LAD 、LAVImax、LAVImin均呈负相关(r=-0.46、-0.36、-0.37,P均<0.01)。
表1 3组临床资料比较(±s)
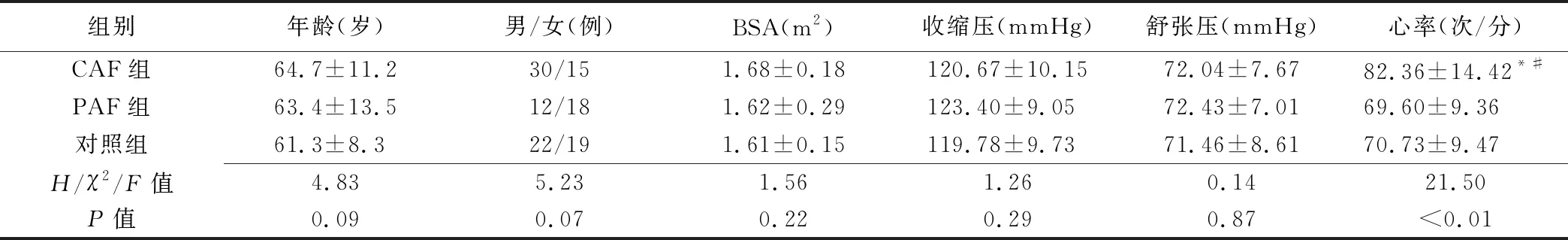
表1 3组临床资料比较(±s)
组别年龄(岁)男/女(例)BSA(m2)收缩压(mmHg)舒张压(mmHg)心率(次/分)CAF组64.7±11.230/151.68±0.18120.67±10.1572.04±7.6782.36±14.42*#PAF组63.4±13.512/181.62±0.29123.40±9.0572.43±7.0169.60±9.36对照组61.3±8.322/191.61±0.15119.78±9.7371.46±8.6170.73±9.47H/χ2/F值4.835.231.561.260.1421.50P值0.090.070.220.290.87<0.01
注:*:与对照组比较P<0.01;#:与PAF组比较P<0.01
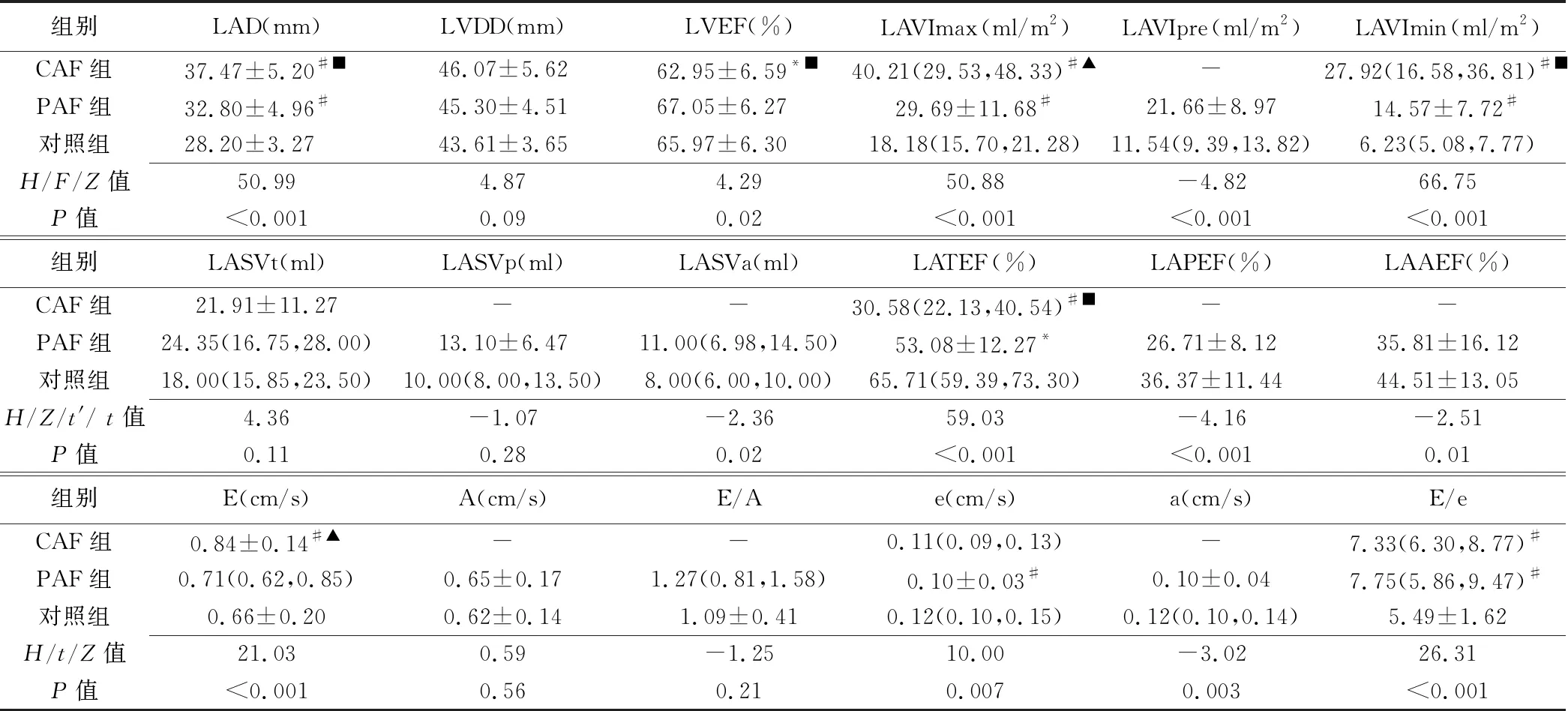
表2 3组常规超声心动图参数比较
注:*:与对照组比较P<0.05;#:与对照组比较P<0.01;▲:与PAF组比较P<0.05;■:与PAF组比较P<0.01

表3 3组左心房心肌力学参数比较
注:*:与对照组比较P<0.01;#:与PAF组比较P<0.01

表4 3组左心房EL比较[J/(m·s)]
注:*:与对照组比较P<0.05, #:与对照组比较P<0.01
3 讨论
AF是左心房及左心耳血栓形成的常见原因之一,也是导致心源性卒中的重要因素[5],为进展性疾病,常始于心房容量负荷增加及结构重构,导致心腔扩大及心肌间质纤维化,心腔内血液流动效能减低,使血流处于瘀滞状态,进而可致血栓形成。
VFM联合2DTT技术不具有角度依赖性,能测量与声束方向垂直的血流速度,全面评价心腔内血液流场分布信息。VFM观测不同疾病心腔内EL与MRI结果具有良好相关性[6]。EL主要发生在心腔内血液摩擦将动能转化为热能的过程中,可用于评价糖尿病、高血压、AF患者左心房功能,其评估AF患者左心房内血液流动和停滞状态的可行性已得到证实[3,7-8]。
由于难以采集PAF患者AF状态下的图像,本研究参照文献[7],将纳入标准规定为动态心电图检查提示为窦性心律的PAF患者及AF心律的CAF患者,结果显示AF患者左心房容积明显增大,左心房收缩功能降低,可能是由于AF患者心室率不规则,心房失去主动收缩功能,心房血液进入心室过程受阻,导致血液淤滞于左心房内,使左心房容量负荷增加,左心房进行性扩大;长期AF可使心肌间质纤维化,心房重构,导致心房顺应性及收缩功能降低,且与PAF相比,CAF纤维化程度更严重,因而左心房被动扩张及功能减低更明显,与KUPPAHALLY等[2,9]的结果相符。
组织多普勒测量参数E/e简单、可重复,是能无创评价左心室舒张功能的可靠指标,且相对不受心脏节律的影响。E、e能克服舒张功能的影响,在一定程度上反映左心房压力[10]。本研究CAF组和PAF组E/e均高于对照组,提示AF患者左心室舒张功能降低,且心房压力升高,可能与其房室收缩不同步导致左心室充盈压增高、顺应性降低有关,与林明杰等[11]的结果一致;而PAF组E/A与对照组差异无统计学意义,原因可能在于A波易受左心房、左心室压力及舒张功能影响,用于评估左心房功能价值非常有限[2]。
心肌功能重构早于结构重构,而左心房应变参数能较左心房容积参数及排空分数更早反映左心房功能改变[12]。本研究中AF患者所有左心房心肌力学参数均较健康人减低,提示其左心房机械功能已显著受损。CAF患者由于失去心房主动收缩功能而无法准确测得SLAed、SLAac、SRLAed、SRLAac,其发作频率增加及持续时间延长使左心房纤维化程度更明显,心肌纤维排列更紊乱,应变值降低更显著。
EL是血流动力学参数,反映心腔内血流空间弥散能力,并代表血液流动效能。左心房内EL可反映左心房血流动能,EL越低,血液流动效能也越低[7]。本研究中AF患者整个收缩期和舒张期左心房EL均显著低于健康人,可能与其左心房内血流动力学受损导致左心房内平均血流速度降低有关:左心房内血流速度减低可加重心房内血液瘀滞状态,增加血栓形成风险[13-14],与LIN等[7]的结果相符。既往研究[15]认为CAF左心房内血流速度较PAF减低更明显。本研究中CAF组EL虽低于PAF组,但差异无统计学意义,可能是CAF使心房处于持续颤动状态,血流之间产生摩擦碰撞,血流方向不断发生改变,在一定程度上增加了左心房内EL[5],与血液瘀滞导致的EL降低相互抵消所致。
本研究中EL-S、EL-d与左心房结构参数(LAD、LAVImax、LAVImin)呈负相关,提示EL与左心房大小存在相关性,而左心房大小和形态可能是影响AF患者血栓栓塞风险的额外参数[2],推测AF患者EL降低可能对心房内血栓形成风险具有一定预测价值,有待观察;EL-S及EL-D均与LATEF、SLAs、SRLAs呈正相关,提示左心房功能受心肌力学与流场间相互作用的影响。
本研究的局限性:① VFM基于二维层面流场分析,与三维空间流场状态存在差异;②未分析病程、药物使用、PAF患者AF心律状态等对左心房EL的影响;③样本量较小。
综上所述,AF可导致左心房EL及心肌功能受损,CAF患者左心房血流动力学受损更明显。VFM技术能定量评价不同类型AF患者左心房EL,为观察AF患者心腔内流固力学变化提供了一种新的方法,有可能为临床早期预测AF患者血栓形成风险提供更多信息。

