呋喃西林代谢物单克隆抗体的制备及免疫学特性鉴定
徐冬梅 李亚英 耿海波 李玉静
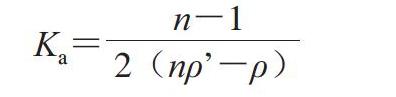
摘 要:为建立呋喃西林代谢物氨基脲(semicarbazide,SEM)的免疫学检测方法,采用碳化二亚胺法成功合成人工免疫抗原SEM-牛血清白蛋白(bovine serum albumen,BSA)(SEM-BSA),并用该抗原免疫BALB/c小鼠,采用聚乙二醇介导的细胞融合技术制备SEM的单克隆抗体(SEM mAb),采用辛酸-硫酸铵沉淀法纯化单抗,并对其效价、敏感性、特异性和亲和力等免疫学特性进行鉴定。结果表明:成功制备SEM单克隆抗体SEM-3D9,抗体效价达到1∶5×106,敏感性半抑制质量浓度为0.42 μg/L,亚型为IgG1,亲和常数Ka=2.1×108 L/mol,与呋喃唑酮代谢物2-NP-3-氨基-2-恶唑酮、呋喃它酮代谢物2-NP-5-甲基吗啉-3-氨基-2-唑烷基酮类似物的交叉反应率(cross reaction,CR)均小于0.01%,与呋喃妥因代谢物2-NP-1-氨基-2-乙内酰的CR为0.016 8%,特异性良好。
关键词:呋喃西林代谢物;氨基脲;细胞融合;单克隆抗体;免疫学特性
Abstract: In order to establish an immunological method for the detection of the furacillin metabolite semicarbazide (SEM), a conjugate of SEM with bovine serum albumin (BSA) was synthesized by the carbodiimide method and was used as an immunogen to immunize BALB/c mice for the preparation of a monoclonal antibody against SEM (SEM mAb) by polyethylene glycol (PEG)-mediated cell fusion. SEM mAb was purified by caprylic acid-ammonium sulfate precipitation. Finally, the immunological characteristics of the monoclonal antibody including titer, sensitivity, specificity and affinity were identified. The results showed that the monoclonal antibody SEM-3D9 was successfully prepared. The serum titer of immunized mice was 1:5 × 106, the sensitivity IC50 was 0.42 μg/L, and the antibody belonged to IgG1 subtype with an affinity constant Ka of 2.1 × 108 L/mol. Its cross-reaction rate with 2-NP-3-amino-2-oxazolidinone and 2-nitrophenyl-5-morpholine-methyl-3-amino-2-oxazolidinone analogues was less than 0.01%, and its cross-reaction rate with 2-nitrophenyl-1-aminohydantoin was 0.016 8%, indicating good specificity.
Keywords: furacillin metabolite; semicarbazide; cell fusion; monoclonal antibody; immunological characteristics
DOI:10.7506/rlyj1001-8123-20191029-253
中圖分类号:TS251.7 文献标志码:A 文章编号:1001-8123(2020)03-0058-05
呋喃西林是一种硝基呋喃类药物,可抑制或杀灭多种革兰氏菌以及某些真菌和原虫,主要用于预防和治疗肠道细菌感染,在畜牧、水产养殖中得到广泛应用[1],该类药物及其代谢物属于硝基杂环类化合物,具有细胞诱变性和动物致癌毒性[2],已引起临床高度重视,欧盟、日本和美国[3]等大部分国家和地区已禁止呋喃西林等4 种硝基呋喃类药物在肉类食品中的残留,我国在2002年也将该类抗生素列为食源性动物禁止使用药物[4]。在4 种硝基呋喃类药物中,呋喃西林类药物残留量最多[5],毒性也最大[6]。在畜禽养殖过程中呋喃西林类药物中毒事件时有报道[7-8]。呋喃西林在动物体内会被迅速代谢[9],不易检测,其代谢产物氨基脲(semicarbazide,SEM)能与细胞内蛋白长期结合,存留较长时间[10-12],因此,通常将其代谢产物作为呋喃西林类药物残留检测的标识物[13]。
目前,呋喃西林代谢物的检测方法主要有紫外分光光度法[14-15]、高效液相色谱(high performance liquid chromatography,HPLC)、液相色谱-质谱联用(liquid chromatography-mass spectrometry,LC-MS)和液相色谱-串联质谱(LC-MS/MS)等仪器方法,以及以酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)、胶体金免疫层析为主的免疫学分析方法[16-17]。传统紫外分光光度法检测灵敏度低,不能满足微量代谢物检测要求。HPLC、LC-MS等方法能随时进行精确检测[18-19],灵敏、准确,主要作为确证方法,目前已出台多项标准,如GB/T 18932.24—2005《蜂蜜中呋喃它酮、呋喃西林、呋喃妥因和呋喃唑酮代谢物残留量的测定方法 液相色谱-串联质谱法》规定了蜂蜜中呋喃西林代谢物残留量的LC-MS/MS测定方法,SN/T 3648—2013《饲料中呋喃唑酮、呋喃妥因、呋喃它酮、呋喃西林含量的检测方法 液相色谱法》规定了饲料中呋喃西林含量的HPLC检测方法,GB/T 22987—2008《牛奶和奶粉中呋喃它酮、呋喃西林、呋喃妥因和呋喃唑酮代谢物残留量的测定 液相色谱-串联质谱法》规定了牛乳和乳粉中呋喃西林代谢物残留量的LC-MS/MS检测方法,但该方法仪器设备昂贵、操作繁琐、检测成本高,不适合现场批量检测,严重影响了使用此方法进行非法添加检测的监管和风险预警。免疫学分析方法[20-21]具有快速、灵敏、准确、方便、检测成本低、分析容量大等优点,可以实现对目标物进行现场批量快速定性及定量分析,已成为目前最有效的初筛技术手段[22-25]。
目前,国内外学者已开展了呋喃西林代谢物免疫学分析方法研究,但受抗体质量的限制,方法的检测灵敏度和特异性还有待提高,如吴鹏等[26]建立动物性食品中呋喃西林代谢物间接竞争ELISA法,该试剂盒标准曲线的半抑制质量浓度(half inhibitory concentration,IC50)为0.267 7 μg/L;赵承彪[27]制备了抗呋喃西林多克隆抗体,抗体的敏感性IC50为10.5 μg/L。本研究采用碳化二亚胺法[28-29]合成SEM人工抗原,制备其高特异、灵敏的单克隆抗体,并对抗体的免疫学特性进行鉴定,为呋喃西林代谢物免疫学检测方法的建立提供参考。
1 材料与方法
1.1 材料与试剂
骨髓瘤SP2/0细胞 本研究室保存;BALB/c小鼠 河北医科大学实验动物中心。
PEG4000、盐酸氨基脲(SEM·HCl)、牛血清白蛋白(bovine serum albumen,BSA)、卵清白蛋白(ovalbumin,OVA) 生工生物工程(上海)股份有限公司;免疫球蛋白(immunoglobulin,Ig)亚型试剂盒 Sigma-Aldrich(上海)贸易有限公司;HAT选择性培养基 美国Gibico公司;弗氏完全与不完全佐剂 Pierce生物技术公司;SEM与对羧基苯甲醛的衍生物(CPSEM)、SEM-BSA、SEM-OVA 本研究室自制;N-羟基琥珀酰亚胺 北京百灵威科技有限公司;1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐 梯希爱(上海)化成工业发展有限公司;邻醛基苯甲酸、对醛基苯甲酸 阿拉丁试剂(上海)有限公司;N,N-二甲基甲酰胺 上海麦克林生物化学有限公司;辣根过氧化物酶标记羊抗小鼠IgG 北京中杉金桥生物科技有限公司。
1.2 仪器与设备
Milli-Qingegrallo超纯水系统 德国密理博公司;BS 124S电子天平 赛多利斯科学仪器(北京)有限公司;NanoDrop 2000紫外扫描仪、Micro17超速离心机、Wellwash AC洗板机 赛默飞世尔科技(中国)有限公司;MCO-15AC二氧化碳培养箱 日本Sanyo公司;SW-CJ-1F净化工作台 苏州净化设备有限公司;IX51倒置显微镜 Olympus(中国)有限公司;MS105DU电子分析天平 梅特勒-托利多国际贸易(上海)有限公司;YDS-65-216液氮罐 成都金凤液氮容器有限公司;Avanti JXN-26高速冷冻离心机 德国Beckman Coulter公司;DK-S24電热恒温水浴锅 上海精宏设备有限公司;Varioskan LUX酶标仪 美国Bio-Tek仪器有限公司。
1.3 方法
1.3.1 SEM人工抗原的合成与鉴定
抗原合成采用碳化二亚胺法,鉴定采用紫外分光光度法和十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electropheresis,SDS-PAGE)法[30],并采用朗伯-比尔定律计算偶联比[31-32]。
1.3.2 动物免疫
用生理盐水将免疫原CPSEM-BSA稀释,与等体积弗氏不完全佐剂混匀后颈背部免疫BALB/c小鼠,免疫剂量为40 μg/只,免疫4 次,每次间隔2 周。第4次免疫1 周后取血,用间接ELISA法测定抗血清效价,竞争ELISA法测定抗血清是否敏感,最终选取效价高、敏感性好的免疫小鼠进行细胞融合。
1.3.3 杂交瘤细胞的制备
选择敏感性好且血清效价高的小鼠进行腹腔加强免疫,3 d后用于细胞融合。采用间接和竞争ELISA法检测融合细胞上清的抗体效价和对呋喃西林代谢物的抑制率,采用有限稀释方法将阳性孔克隆化,直至成功建立单一分泌单克隆抗体的杂交瘤细胞株为止,将杂交瘤细胞株保存于-20 ℃待用。
1.3.4 单克隆抗体的制备与纯化
采用小鼠体内诱生腹水的方法获取单克隆抗体。将筛选得到的能稳定分泌SEM抗体的杂交瘤细胞(细胞数约为106 个/mL)注射到石蜡油致敏的BALB/c小鼠腹腔,每只注射1 mL,7~10 d后取腹水。腹水采用辛酸-硫酸铵方法纯化,并采用考马斯亮蓝法对纯化的抗体质量浓度进行测定[33]。
1.3.5 单克隆抗体抗效价测定
参照李春生等[34]的方法,采用间接ELISA法测定抗体效价。
1.3.6 单克隆抗体敏感性测定
将呋喃西林代谢物衍生物的标准品母液用磷酸盐缓冲液(phosphate buffered saline,PBS)稀释成质量浓度分别为8.1、2.7、0.9、0.3、0.1 μg/L,采用间接竞争ELISA法检测SEM抗体敏感性,以IC50表示[35]。
1.3.7 单克隆抗体免疫球蛋白亚型鉴定
使用单克隆抗体亚型试剂盒测定抗体亚型。
1.3.8 单克隆抗体亲和常数(Ka)测定
采用间接ELISA法[36]测定Ka,按下式计算。
式中:ρ为当抗原质量浓度为a时,吸光度最高值的50%所对应的抗体质量浓度/(μg/mL);ρ为当抗原质量浓度为b时,吸光度最高值的50%所对应的抗体质量浓度/(μg/mL);a=nb;n为稀释倍数。
1.4 数据处理
采用Statistica统计软件进行数据处理,采用Origin制图软件绘制标准曲线。
2 结果与分析
2.1 单克隆抗体的获取
4 免后,3 只小鼠抗血清经测定,效价均达到1∶105以上,敏感性IC50小于7 ng/mL。其中SEM-3号小鼠抗血清效价为1∶2×105,敏感性IC50小于1.5 ng/mL,选择该小鼠加强免疫后用于细胞融合。融合5 板,融合率达到88.7%,阳性克隆率达到19.6%,经亚克隆,筛选得到1 株能够稳定分泌SEM抗体的细胞株,命名为3D9。扩大培养后,采用小鼠体内诱生腹水的方法制备腹水,腹水经辛酸-硫酸铵法纯化后得到抗SEM单克隆抗体,命名为SEM-3D9,经测定抗体质量浓度为8.6 mg/mL。
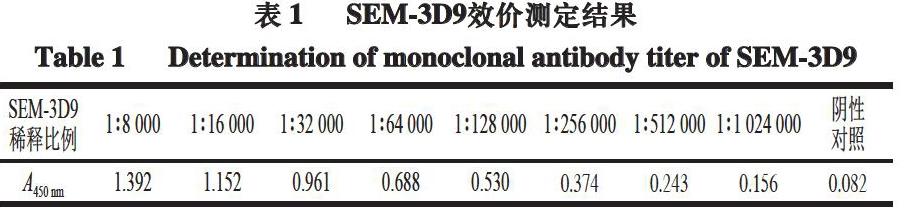
2.2 SEM-3D9效价测定结果
P为待测阳性对照孔A450 nm)作为效价测定结果。由表1可知,当SEM-3D9稀释比例为1∶512 000时,P/N为3.38,确定SEM-3D9的效价为1∶5×106。
2.3 SEM-3D9敏感性測定结果
用间接竞争ELISA法测定SEM-3D9对不同质量浓度呋喃西林代谢物2-NP-二硝基苯甲醛酸脲(2-NP-benzaldehydesemicarbazone,NPSEM)的标准抑制曲线。以B/B0(%)(B为不同质量浓度标准溶液的A450 nm,B0为零浓度标准溶液的A450 nm)为纵坐标,以标准溶液质量浓度的对数(lg ρNPSEM)为横坐标,绘制标准抑制曲线,进行回归分析,并计算IC50。结果表明,标准溶液质量浓度0.1~8.1 μg/L范围内线性关系良好,标准曲线方程为y=-0.335 1x+0.384 2(R2=0.992 7),IC50为0.42 μg/L。
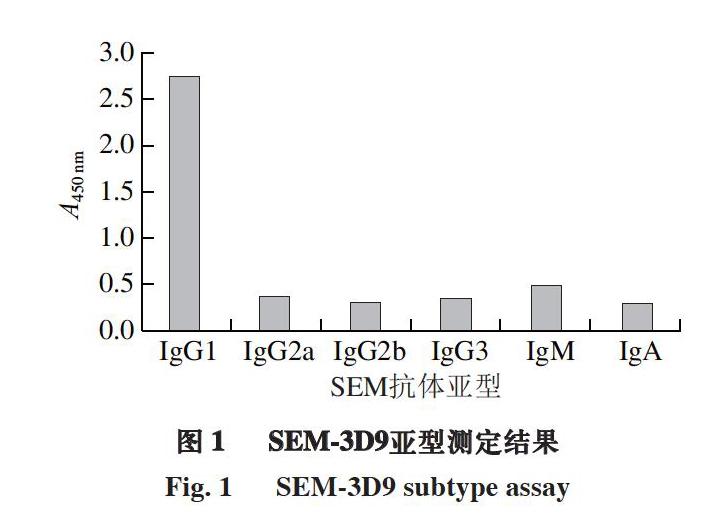
2.4 SEM-3D9亚型测定结果
杂交瘤细胞株分泌的单克隆抗体与不同亚型的免疫球蛋白反应后显色有明显差异。由图1可知,SEM-3D9与IgG1抗体反应的A450 nm最高,与IgG2a、IgG2b、IgG3、IgM和IgA反应的A450 nm小于0.5,为阴性,因此SEM-3D9单克隆抗体亚型为IgG1。
2.5 SEM-3D9 Ka测定结果
以SEM-3D9质量浓度对数为横坐标,A450 nm为纵坐标绘制“S”型曲线。由图2可知,SEM-3D9的Ka为2.1×108 L/mol。
2.6 SEM-3D9特异性测定结果
通过将SEM-3D9与NPSEM、呋喃唑酮代谢物2-NP-3-氨基-2-恶唑酮(2-nitrophenyl-3-amino-2-oxazolidinone,NPAOZ)、呋喃它酮代谢物2-NP-5-甲基吗啉-3-氨基-2-唑烷基酮(2-nitrophenyl-5-morpholine-methyl-3-amino-2-oxazolidinone,NPAMOZ)、呋喃妥因代谢物2-NP-1-氨基-2-乙内酰(2-nitrophenyl-1-aminohydantoin,NPAHD)分别进行交叉反应,检测SEM-3D9的特异性。计算交叉反应率(cross reaction ratio,CR),表示为SEM-3D9的IC50与各结构类似物的IC50比值。
由表2可知,SEM-3D9与NPAOZ、NPAMOZ的CR均小于0.01%,与NPAHD的CR为0.016 8%,特异性良好。
3 结 论
使用SEM-BSA作为抗原,免疫BALB/c小鼠,获得分泌抗SEM特异性抗体的融合细胞,筛选出1 株效果较好的细胞株3D9。通过小鼠体内诱生腹水,采用辛酸-硫酸铵方法进行纯化,得到单克隆抗体SEM-3D9。免疫学特性测定结果表明,SEM-3D9效价为1∶5×106,亚型为IgG1,Ka为2.1×108 L/mol,敏感性IC50为0.42 μg/L,与NPAOZ、NPAMOZ类似物的CR均小于0.01%,与NPAHD的CR为0.016 8%,特异性良好。本研究得到的高特异性、高灵敏度的SEM单克隆抗体为SEM代谢物残留免疫检测方法的建立提供了参考。
参考文献:
[1] NOUWS J F M, LAURENSEN J. Postmortal degradation of furazolidone and furaltadone in edible tissues of calves[J]. Tijdschrift voor diergeneeskunde, 1991, 116(7): 359-362. DOI:10.1080/01652176.
1990.9694243.
[2] ALI B H. Pharmacological therapeutic and toxicological properties of furazolidone: some recent research[J]. Veterinary Research Communications, 1999, 23(6): 343-360. DOI:10.1023/a:1006333608012.
[3] 晓林. FDA: 进口动物食品禁用11 种药物[J]. 中国家禽, 2002, 24(14): 47. DOI:10.3969/j.issn.1004-6364.2002.14.027.
[4] 中华人民共和国农业部. 动物性食品中兽药最高残留限量[EB/OL].
[2002-12-24] (2019-10-28). http://www.moa.gov.cn/gk/tzgg_1/gg/200302/t20030226_59300.htm.
[5] VASS M, HRUSKA K, FRANEK M. Nitrofuran antibiotics: a review on the application, prohibition and residual analysis[J]. Veterinarni Medicina, 2008, 53(9): 469-500. DOI:10.1111/j.1865-1682.2008.01041.x.
[6] 王习达, 陈辉, 左健忠, 等. 水产品中硝基呋喃类药物残留的检测与控制[J]. 现代农业科技, 2007(18): 152-153. DOI:10.3969/j.issn.1007-5739.2007.18.120.
[7] 叶培芝. 慎防呋喃西林中毒[J]. 福建农业, 2002, 2(1): 19.
[8] 林锏锐, 唐媛媛, 詹海毅, 等. 2013—2018年湛江进出口水产品兽药残留结果分析[J]. 检验检疫学刊, 2019, 3(1): 1-4.
[9] MCCRACKEN R J, JOHN B W, CHRIS R, et al. Determination of furazolidone in porcine tissue using thermospray liquid chromatographymass spectrometry and a study of the pharmacokinetics and stability of its residues[J]. Analyst, 1995, 120(9): 2347-2351. DOI:10.1039/AN9952002347.
[10] 劉永涛, 艾晓辉, 索纹纹, 等. 呋喃唑酮代谢物AOZ在斑点叉尾体内组织分布与消除规律研究[J]. 淡水渔业, 2012, 42(5): 38-44. DOI:10.3969/j.issn.1000-6907.2012.05.008.
[11] WICKRAMANAYAKE P U, TRAN T C. Simultaneous separation of nitrofuran antibiotics and their metabolites by using micellar electrokinetic capillary chromatography[J]. Electrophoresis, 2006, 27(20): 4069-4077. DOI:10.1002/elps.200600105.
[12] HOOGENBOOM L A P, TOMASSINI O, OORSPRONG M B M, et al. Use of pig hepatocytes to study the inhibition of monoamine oxidase by furazolidone[J]. Food and Chemical Toxicology, 1991, 29(3): 185-191. DOI:10.1016/0278-6915(91)90036-7.
[13] MCCRACKENN R J, KENNEDY D G. Detection, accumulation and distribution of nitrofuran residues in egg yolk, albumen and shell[J]. Food Additives and Contaminants, 2007, 24(1): 26-33. DOI:10.1080/02652030600967214.
[14] 欧翠华, 陈江飞, 胡毅坚, 等. 紫外分光光度法测定呋喃西林氧化锌搽剂中主药的含量[J]. 中国药房, 2007, 18(31): 2461-2462. DOI:10.3969/j.issn.1001-0408.2007.31.028.
[15] 吴诚, 曹淼, 张丽平, 等. 高效液相色谱法和紫外分光光度法测定呋喃西林含量的比较研究[J]. 中国药业, 2015(4): 34-36.
[16] 李斌. 呋喃西林代谢物SEM单克隆抗体的制备及其荧光定量检测试纸条的研究[D]. 广州: 华南理工大学, 2017: 44-67.
[17] 桂文龙, 苏治国, 徐婷婷. HPLC-MS/MS检测猪肉中4 种硝基呋喃类代谢物残留[J]. 江苏农业科学, 2018, 46(23): 220-223. DOI:10.15889/j.issn.1002-1302.2018.23.0540.
[18] RADOVNIKOVIC A, MOLONEY M, BYRNE P. Detection of banned nitrofran metabolites in animal plasma samples using UHPLC-MS/MS[J]. Journal of Chromatography B, 2011, 879(2): 159-166. DOI:10.1016/j.jchromb.2010.11.036.
[19] HORMAZ?BAL V, NORMAN ASP T. Determination of the metabolites of nitrofuran antibiotics in meat by liquid chromatography-mass spectrometry[J]. Journal of Liquid Chromatography and Related Technologies, 2004, 27(17): 2759-2770. DOI:10.1081/JLC-200029335.
[20] 中华人民共和国江苏出入境检验检疫局, 中华人民共和国常州出入境检验检疫局, 中华人民共和国山东出入境检验检疫局, 等.
出口动物源食品中硝基呋喃代谢物残留量的测定 酶联免疫吸附法: SN/T 3380—2012[S]. 北京: 中国标准出版社, 2012.
[21] 中华人民共和国商务部. 动物组织中呋喃唑酮代谢物残留的测定 酶联免疫吸附法: SB/T 10927—2012[S]. 北京: 中国标准出版社, 2013.
[22] 罗杰, 李健. 呋喃唑酮间接竞争ELISA(ciELISA)检测法的建立[J]. 中国海洋大学学报(自然科学版), 2005, 35(2): 213-218. DOI:10.3969/j.issn.1672-5174.2005.02.008.
[23] 任海涛, 沈玉栋, 徐振林, 等. 呋喃西林代谢物多克隆抗体制备及酶联免疫吸附分析方法[J]. 食品工业科技, 2012, 33(5): 330-333; 379.
[24] 常文保, 张柏林, 慈云祥. 药物免疫分析及其进展[J]. 分析化学, 1994, 11(1): 1167-1175.
[25] 李兴霞, 王国霞, 潘家荣. 免疫分析新方法在食品安全检测中的应用[J]. 生物技术通报, 2006(1): 42-45. DOI:10.3969/j.issn.1002-5464.2006.01.011.
[26] 吴鹏, 万宇平, 陶光灿, 等. 呋喃西林代谢物酶联免疫检测方法的建立[J]. 安徽农业科学, 2013, 41(5): 1969-1971. DOI:10.3969/j.issn.0517-6611.2013.05.034.
[27] 赵承彪. 加替沙星、呋喃西林在食品中残留的酶联免疫檢测法的研究[D]. 济南: 山东大学, 2008: 48-52.
[28] CLIQUET P, COX E, VAN DORPE C, et al. Generation of class-selective monoclonal antibodies against the penicillin group[J]. Journal of Agricultural and Food Chemistry, 2001, 49(7): 3349-3355. DOI:10.1021/jf001428k.
[29] 李君华, 吴萌, 程华, 等. 西马特罗单克隆抗体的制备及免疫学特性鉴定[J]. 畜牧与兽医, 2016, 48(3): 123-126.
[30] KAMPS-HOLTZAPPLE C, CARLIN R J, SHEFFIELD C, et al. Analysis of hapten-carrier protein conjugates by nondenaturing gel electrophoresis[J]. Journal of Immunological Methods, 1993, 164(2): 245-253. DOI:10.1016/0022-1759(93)90317-Z.
[31] 杨利国, 胡少昶, 魏平华, 等. 酶免疫测定技术[M]. 南京: 南京大学出版社, 1998: 252-258.
[32] 吕会田, 乐加昌, 陈存社. 克伦特罗小分子半抗原偶联比率的测定方法研究[J]. 中国饲料, 2005, 26(7): 33-35. DOI:10.3969/j.issn.1001-991X.2005.03.018.
[33] LI Junhua, LI Chunsheng, WU Meng, et al. Development of an ultrasensitive immunochromatographic assay (ICA) strip for the rapid detection of phenylethanolamine a in urine and pork samples[J]. Journal of Food Science, 2015, 80(4): T894-T899. DOI:10.1111/1750-3841.12814.
[34] 李春生, 刘静静, 杜顺丰, 等. 呋喃唑酮代谢物单克隆抗体和胶体金免疫层析试纸条的研制[J]. 现代食品科技, 2017, 33(6): 1-6.
[35] LI Chunsheng, LI Yujing, ZHANG Yan, et al. Preparation of an anti-formoterol monoclonal antibody for indirect competitive ELISA detection of formoterol in urine and pork samples[J]. Analytical Methods, 2018, 10(5): 548-553. DOI:10.1039/c7ay02562a.
[36] BEATTY J D, BEATTY B G, VLAHOS W G. Measurement of monoclonal antibody affinity by non-competitive enzyme immunoassay[J]. Journal of Immunological Methods, 1983, 100(1/2): 173-179. DOI:10.1016/0022-1759(87)90187-6.

