艾滋病合并肺孢子菌肺炎101例临床分析
尹 恒,阮 军,寇国先,杨成彬
(1. 绵阳市中心医院肾病科,四川 绵阳 621000; 2. 绵阳市中心医院感染科,四川 绵阳 621000; 3. 凉山州布拖县人民医院感染科,四川 布拖 615350)

1 资料与方法
1.1 资料来源 回顾性分析2016年6月—2019年6月凉山州布拖县人民医院感染科收治住院的101例AIDS合并PJP患者的临床资料,包括一般情况(性别、年龄与传播途径)、临床表现、胸部影像学改变、实验室检查及诊治与转归情况。
1.2 诊断标准 AIDS和PJP参照2018年我国制定的《艾滋病诊疗指南》中的诊断标准[3],所有患者均经免疫印记法确诊为HIV-1型。PJP诊断标准:(1)亚急性起病,呼吸困难逐渐加重,伴有发热、干咳、胸闷,症状逐渐加重,严重者发生呼吸窘迫;(2)肺部阳性体征少,或可闻及少量散在的干湿啰音;(3)胸部X线检查可见双肺从肺门开始的弥漫性网状结节样间质浸润,肺部CT显示双肺毛玻璃状改变;(4)血气分析提示低氧血症,严重病例动脉血氧分压(PaO2)明显降低,常在60 mmHg以下;(5)血乳酸脱氢酶(LDH)>500 U/L;(6)确诊依靠病原学检查如痰或支气管肺泡灌洗或肺组织活检等发现肺孢子菌的包囊或滋养体。
1.3 统计方法 本研究应用SPSS 17.0软件进行数据资料分析。
2 结果
2.1 一般情况 101例AIDS合并PJP患者均为成年彝族人,其中男性79例,占78.2%,女性22例,占21.8%,年龄为19~47岁,平均(36.7±7.5)岁,已婚87例,占86.1%,未婚14例,占13.9%。人类免疫缺陷病毒(HIV)感染途径:经异性性接触传播者73例,占72.3%,经静脉注射毒品传播者25例,占24.7%,其他不详3例,占3.0%。
2.2 临床表现 101例AIDS合并PJP患者病程为2~4周,均有呼吸系统损伤表现,其中首发症状为进行性呼吸困难占68.3%,发热占16.8%,咳嗽伴或不伴咯痰占14.9%。合并其他肺部感染(细菌或结核)占33.7%,其中合并细菌性肺炎占20.8%,合并肺结核占12.9%。查体肺部听诊可闻及干湿啰音患者占37.6%,且主要以闻及干啰音为主;此外其他常见体征还有消瘦(体重下降>10%)占40.6%,浅表淋巴结肿大占13.9%等。见表1。
表1 101例AIDS合并PJP患者的临床特征
Table 1 Clinical characteristics of 101 patients with AIDS combined with PJP
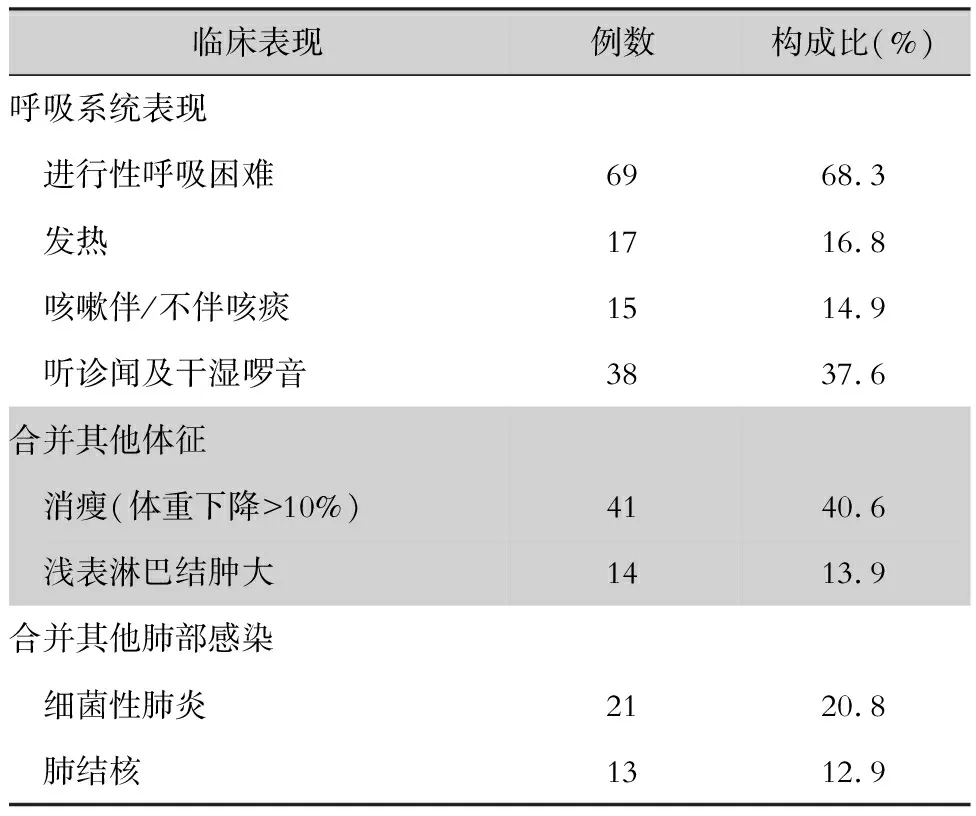
临床表现例数构成比(%)呼吸系统表现 进行性呼吸困难6968.3 发热1716.8 咳嗽伴/不伴咳痰1514.9 听诊闻及干湿啰音3837.6 合并其他体征 消瘦(体重下降>10%)4140.6 浅表淋巴结肿大1413.9 合并其他肺部感染 细菌性肺炎2120.8 肺结核1312.9
2.3 胸部影像学 101例AIDS合并PJP患者胸部CT影像学表现多种多样,最常见与最具特点的CT表现为双肺弥漫分布的磨玻璃影(ground-glass opacity, GGO)改变及其进展所致的实变影,部分区域小叶间隔增厚,GGO的范围常以肺门为中心向外周肺组织扩展。其中68例患者可见双肺弥漫或局限分布的GGO,向心性,边缘模糊,部分可见肺气囊征象;17例患者可见双肺对称分布的大小不等实变影或斑片影;16例患者可见双肺下叶分布的网织结节改变,正常肺组织与病变可形成马赛克征象或碎石征象。
2.4 实验室检查 101例AIDS合并PJP患者动脉血气分析结果均提示低氧血症,即PaO2<60 mmHg;其中重度低氧血症者(PaO2/FiO2≤100 mmHg)占17.8%。CD4+T淋巴细胞计数检测结果为15~212个/μL,平均(112.7±19.4)个/μL;其中39例计数≤100个/μL,占38.6%。血LDH检测结果为268~1 039 U/L,平均(527.4±85.7)U/L。肝功能中丙氨酸氨基转移酶(ALT)或天门冬氨酸氨基转移酶(AST)升高(ALT或AST≥2倍正常值上限)占18.8%;清蛋白(ALB)降低(≤30 g/L)47例,占46.5%。外周血中白细胞计数(WBC)升高(≥10×109/L)占32.7%,血小板(PLT)减少(≤50×109/L)占13.9%,中度贫血(血红蛋白<90 g/L)占25.7%。所有患者痰均未发现确诊的肺孢子菌包囊或滋养体;经口排痰查结核分枝杆菌涂片阳性7例,Xpert MTB/RIF痰液检测结果阳性9例,痰细菌培养结果阳性(肺炎链球菌或肺炎克雷伯菌)14例,痰假丝酵母菌属培养结果阳性16例。见表2。
2.5 诊治与转归 101例AIDS合并PJP患者中以PJP收入院67例,占66.3%;以肺部细菌感染收入院23例,占22.8%;以肺结核收入院11例,占10.9%。所有患者均予以吸氧等对症治疗,并积极予以SMZ/TMP病原治疗及早期联合糖皮质激素抗炎治疗,疗程21 d。所有患者尽早进行抗反转录病毒治疗,通常在抗PJP治疗的2周内进行。经积极治疗后大部分患者预后良好,其中病情好转出院者73例,占72.3%;自动放弃治疗者12例,占11.9%;死亡者16例,占15.8%。
表2 101例AIDS合并PJP实验室检查结果
Table 2 Laboratory examination results of 101 patients with AIDS combined with PJP
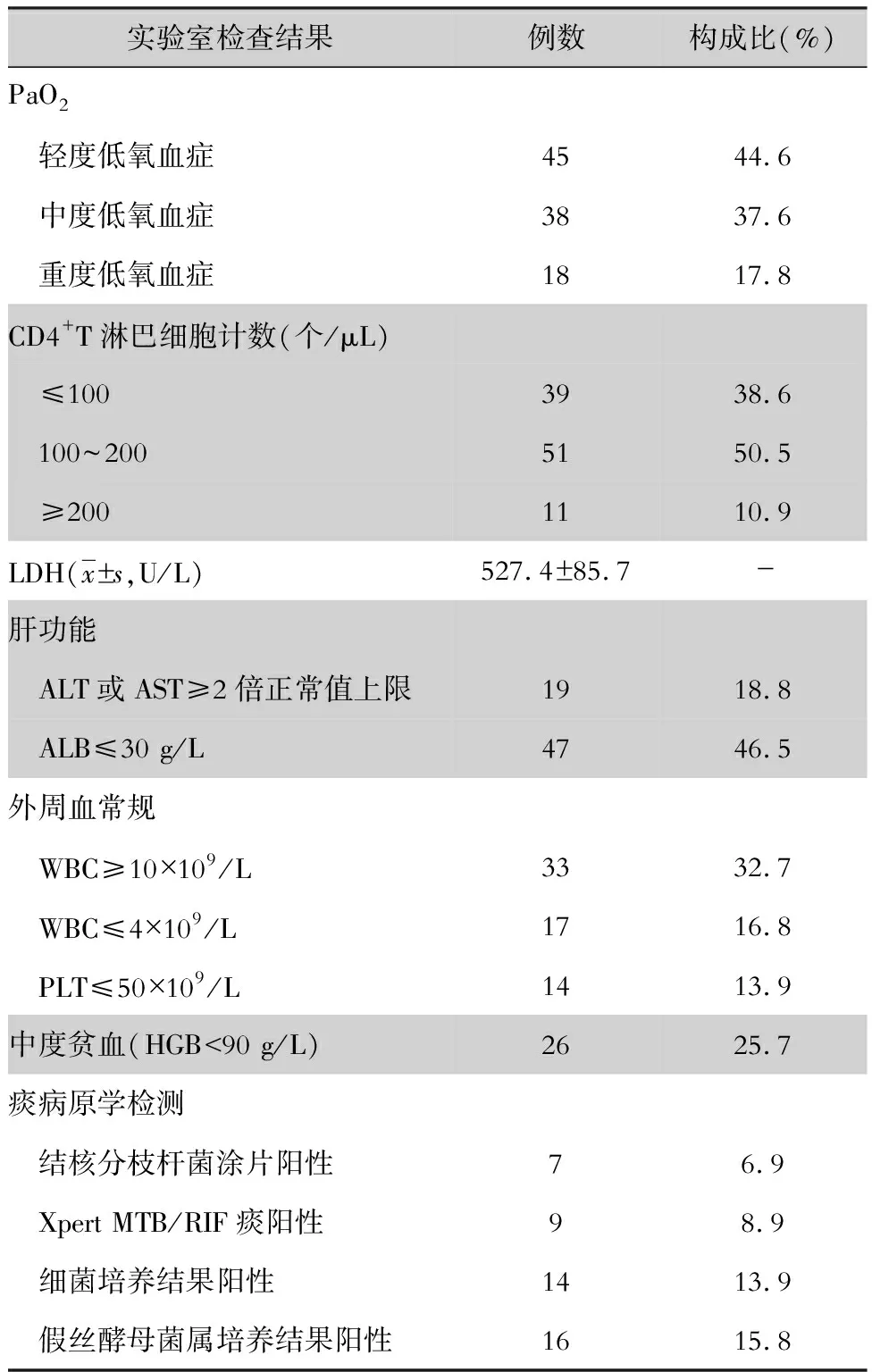
实验室检查结果例数构成比(%)PaO2 轻度低氧血症4544.6 中度低氧血症3837.6 重度低氧血症1817.8CD4+T淋巴细胞计数(个/μL) ≤1003938.6 100~2005150.5 ≥2001110.9LDH(x±s,U/L)527.4±85.7-肝功能 ALT或AST≥2倍正常值上限1918.8 ALB≤30 g/L4746.5外周血常规 WBC≥10×109/L3332.7 WBC≤4×109/L1716.8 PLT≤50×109/L1413.9中度贫血(HGB<90 g/L)2625.7痰病原学检测 结核分枝杆菌涂片阳性76.9 Xpert MTB/RIF痰阳性98.9 细菌培养结果阳性1413.9 假丝酵母菌属培养结果阳性1615.8
3 讨论
AIDS是HIV侵犯人体免疫系统后导致免疫系统功能进行性下降产生各种机会性感染和肿瘤发生的综合征,是累及全身多器官系统的疾病[4]。截至2017年底,我国现存活HIV/AIDS患者约75万例,当年新发感染者约13万例,死亡约3万例[5]。PJP是AIDS患者肺部最严重和最常见的机会性感染,容易引起呼吸衰竭而成为AIDS患者死亡的主要原因,因此,早期及时诊断和有效治疗PJP对AIDS患者的预后至关重要。
本研究对101例AIDS合并PJP患者的资料分析如下:(1)患者多为中青年男性,以经济及医疗条件落后的农村地区多见,经异性性接触成为本地区HIV感染和传播的主要途径。(2)临床首发症状主要表现为进行性呼吸困难,或伴有发热、咳嗽、咯痰等;而全身体征表现不显著,部分患者感染中毒症状与其他肺部感染症状难以区别。(3)肺部CT影像学表现多样且具有一定特异性,多数患者CT表现为双肺弥漫分布的GGO改变及其进展所致的实变影,部分区域小叶间隔增厚,GGO的范围常以肺门为中心向外周肺组织扩展,且部分合并其他肺部感染(细菌或结核)表现,与既往研究[6]结果基本一致。(4)所有患者CD4+T淋巴细胞计数明显降低,可能与患者治疗依从性差导致细胞免疫功能严重受损有关。此外患者呼吸衰竭多表现为Ⅰ型呼吸衰竭与肺换气功能障碍,主要是由于肺孢子菌损伤肺泡上皮细胞继发肺间质疾病所致。(5)肝生化结果显示患者ALB下降明显,提示患者预后不良,这主要是由于AIDS患者机体免疫力低下,多合并不同程度的营养不良所致。(6)外周血象异常主要表现为WBC计数升高,可能是HIV侵犯骨髓后导致的粒系活跃现象,而AIDS患者体内的促红细胞生成素抗体可引起促红细胞生成素减少进而导致贫血[7],此外,HIV也可与巨核细胞CD4受体结合导致巨核细胞破坏引起PLT降低。(7)经口排痰查肺孢子菌包囊或滋养体阳性率极低,但有研究[8]报道以支气管肺泡灌洗液镜检阳性率较高。此外,近年来随着分子生物学技术的发展,聚合酶链反应(PCR)技术已逐渐应用于PJP的辅助诊断[9],同时结合血清1,3-β-D葡聚糖检测(G试验)能更好地区分定植与感染[10],且其阳性结果明显早于临床症状和影像学异常,更有助于PJP的早期诊断[11]。AIDS合并PJP临床上诊治较困难,病死率高,在对症支持治疗基础上,选择有效的抗PJP药物是治疗的关键[12]。本组患者死亡16例,自动放弃治疗12例,说明早期加强患者抗病毒治疗依从性教育与规范有效诊治PJP是影响AIDS患者预后的重要因素。此外,AIDS晚期患者容易合并多种机会性感染(如肺结核等),且临床表现不典型,进而增加临床诊治困难[13-14]。本组患者CD4+T淋巴细胞计数普遍较低,说明患者免疫功能受损严重,容易合并机会性感染,可能引起临床漏诊或误诊。
近年来,随着抗反转录病毒药物治疗的发展与患者服药依从性教育的加强,AIDS的治疗覆盖率与有效率均有所提高,但以PJP为代表的机会性感染依然是AIDS患者住院与死亡的主要原因之一,对社会经济造成极大的负担。当前综合内科治疗是降低病死率的关键措施,主要包括抗病原体治疗、辅助性治疗、呼吸支持治疗及联合抗病毒治疗四个方面[15]。目前指南推荐SMZ/TMP治疗AIDS合并PJP剂量为TMP 15~20 mg/kg/d,SMZ 75~100 mg/kg/d,分3~4次给药,疗程为21 d,必要时可适当延长疗程[3]。而对于CD4+T淋巴细胞计数明显降低的AIDS患者需要予以SMZ/TMP药物预防治疗。但SMZ/TMP容易引起严重的不良反应,且不断有耐药现象出现,而以1,3-β-D葡聚糖为靶点的棘白菌素类抗真菌药物可能成为PJP治疗的一种新可能[16]。研究[17]表明,早期辅助性使用糖皮质激素可以减轻PJP患者肺部炎症水肿,改善呼吸症状及降低早期病死率。故AIDS合并PJP的综合治疗虽然取得了明显进展,但仍有许多问题尚不明确,如棘白菌素类药物治疗PJP还缺乏大型前瞻性研究,机械通气治疗PJP尚无循证医学证据,这些都需要进一步研究论证。
综上所述,AIDS合并PJP患者临床表现多样且缺乏特异性,尤其是来自高流行区的患者,临床医生应高度警惕HIV感染,尽早进行 HIV 抗体检测。对于AIDS合并PJP确诊患者,要做到早诊断、早治疗,进而提高患者的生活质量与延长患者的生存期。

