25羟维生素D缺乏与血脂异常及超重/肥胖的关系
鞠香丽,裴冬梅
(中国医科大学附属盛京医院 体检中心,辽宁 沈阳,110001)
25羟维生素D[25(OH)D]是一种类固醇激素,除了钙摄取和骨代谢[1]的经典功能外,25(OH)D还参与细胞增殖与分化,并具有免疫调节、抗炎功能和抗氧化功能[2-4]。近年来,研究[5-7]发现25(OH)D缺乏与各种不良事件有关,包括高血压、心血管疾病、慢性阻塞性肺疾病、中风、糖尿病和癌症。本研究探讨25(OH)D水平与血脂异常、超重/肥胖等关系,现报告如下。
1 资料与方法
1.1 一般资料
检索2017年9月—2019年8月在本院体检中心检测25(OH)D的体检人群的数据,收集血脂、身高、体质量等相关数据。共纳入2 677例,其中男1 491例(55.70%),女1 186例(44.30%),平均年龄(50.77±10.78)岁,平均25(OH)D水平为(18.40±8.51) ng/mL,女性25(OH)D均值为(16.78±8.61) ng/mL,男性25(OH)D均值为(19.69±8.20) ng/mL。
1.2 方法
由专业护士按照规范的标准进行检查,均采用同一台超声波体检机测量身高、体质量,身高数据精准至0.01 m,体质量数据精准至0.1 kg。测量仪器为SK-CK90型,计算体质量指数(BMI),将BMI 24.0~<28.0 kg/m2定义为超重,BMI≥28.0 kg/m2定义为肥胖。
采集空腹肘静脉血,使用酶联免疫法(ELISA)检测血清25(OH)D水平,将25(OH)D>30 ng/mL定义为25(OH)D正常,25(OH)D>20~30 ng/mL定义为25(OH)D不足,25(OH)D≤20 ng/mL定义为25(OH)D缺乏。全自动生化分析仪检测患者甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、载脂蛋白A1(ApoA1)、载脂蛋白B(ApoB)等水平。
1.3 统计学方法
2 结 果
2.1 不同季节人群25(OH)D水平及营养状态分布情况
25(OH)D检测结果显示,25(OH)D缺乏患者比率为66.23%(1 773/2 677),25(OH)D不足患者比率为25.03%(670/2 677),25(OH)D正常患者比率为8.74%(234/2 677)。按患者纳入季节分为春季组(n=810,时间3、4、5月)、夏季组(n=561,时间6、7、8月)、秋季组(n=759,时间9、10、11月)、冬季组(n=547,时间12、1、2月)。夏季组25(OH)D水平最高为19.92 ng/mL(14.93,25.84),其次为秋季组17.54 ng/mL(12.92,22.92)和春季组15.95 ng/mL(12.50,21.42),冬季组25(OH)D水平最低为13.61 ng/mL(10.37,18.75),组间两两比较,差异有统计学意义(P<0.01)。冬季组25(OH)D缺乏率最高为78.61%,夏季组25(OH)D缺乏率最低为51.34%;夏季组25(OH)D正常率最高为13.55%,显著高于春季组、秋季组、冬季组(P<0.01),见表1。

表1 不同季节组25(OH)D营养状态分布比较[n(%)]
与冬季组比较,**P<0.01;与夏季组比较,##P<0.01。
2.2 不同25(OH)D水平组生化指标比较
25(OH)D正常组、25(OH)D不足组、25(OH)D缺乏组的BMI、TG呈上升趋势,HDL-C、ApoA1呈下降趋势,差异有统计学意义(P<0.05或P<0.01)。见表2。
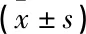
表2 不同25(OH)D水平组生化指标比较
BMI:体质量指数;TG:甘油三酯;TC:总胆固醇;
LDL-C:低密度脂蛋白胆固醇;HDL-C:高密度脂蛋白胆固醇;
ApoA1:载脂蛋白A1;ApoB:载脂蛋白B。
与25(OH)D正常组比较,*P<0.05,**P<0.01;
与25(OH)D不足组比较,##P<0.01。
2.3 25(OH)D水平对血脂指标异常、超重/肥胖发生风险的预测价值
将TG>1.69 mmol/L定义为异常,HDL-C<1.04 mmol/L定义为异常,BMI≥24 kg/m2定义为超重/肥胖。采用二元Logistic 回归模型进行分析,在调整了年龄、性别后发现,与25(OH)D正常者相比,25(OH)D缺乏者TG异常的发生风险显著增高(OR=2.273,95%CI为1.636~3.159,P<0.001),HDL-C异常的发生风险显著增高(OR=2.817,95%CI为1.783~4.464,P<0.001),超重/肥胖的风险显著增高(OR=1.892,95%CI为1.394~2.569,P<0.005)。与25(OH)D正常者相比,25(OH)D不足者TG异常的发生风险显著增高(OR=2.100,95%CI为1.483~2.974,P<0.001),HDL-C异常的发生风险显著增高(OR=2.183,95%CI为1.353~3.534,P<0.001),超重/肥胖的风险显著增高(OR=1.603,95%CI为1.155~2.224,P<0.001)。
3 讨 论
本研究调查了本院健康体检人群2 677例,平均25(OH)D水平为(18.40±8.51) ng/mL,女性25(OH)D均值为(16.78±8.61) ng/mL,男性25(OH)D均值为(19.69±8.20) ng/mL,25(OH)D缺乏率为66.23%,25(OH)D不足率为25.03%,25(OH)D正常率仅8.74%。分析原因为沈阳地处中国北方地区,冬季寒冷,夏季炎热,故冬季衣着厚重、户外活动少,而夏季户外防晒服、防晒霜、遮阳伞的广泛使用以及工作多处于室内,因而暴露在阳光下的有效时间减少,且传统的饮食方式发生改变,导致每日膳食25(OH)D的摄入量减少,加之受空气污染等影响皮肤产生25(OH)D的含量较低[8-9]。
包金晶等[10]调查南京地区人群维生素D水平与季节关系发现,春、夏季25(OH)D水平为(20.28±7.59) ng/mL,明显高于秋、冬季(16.09±7.15) ng/mL,`而春季与夏季、秋季与冬季比较发现人群25(OH) D水平差异无统计学意义(P>0.05)。张松等[11]调查季节对健康青年男性维生素D营养状态的影响发现,冬、春季维生素D水平明显低于夏、秋季,春季水平最低,秋季水平最高。本研究结果显示,夏季组25(OH)D水平最高为19.92 ng/mL,其次为秋季组17.54 ng/mL和春季组15.95 ng/mL,冬季组25(OH)D水平最低为13.61 ng/mL,组间两两比较,差异有统计学意义(P<0.01)。不同季节中,冬季25(OH)D缺乏率最高为78.61%,夏季25(OH)D缺乏率最低为51.34%,春季为70.49%,秋季为63.77%;夏季25(OH)D正常率最高为13.55%,明显高于春季、秋季、冬季。
本研究发现,25(OH)D水平与血脂异常及超重/肥胖相关,25(OH)D正常、不足及缺乏组的 BMI、TG水平呈升高趋势,HDL-C、ApoA1水平呈下降趋势,差异有统计学意义(P<0.05或P<0.01)。Logistic回归分析提示,25(OH)D缺乏组的TG、HDL-C异常发生风险分别为维生素正常组的2.273、2.817倍,25(OH)D缺乏组发生超重/肥胖的风险为维生素正常组的1.892倍。朱道民[12]研究表明,与维生素D非缺乏组相比,维生素D缺乏组TG异常风险(调整后OR=2.48,95%CI为1.21~6.46)和HDL-C异常风险(调整后OR=2.80,95%CI为1.35~4.56)均显著增高。25(OH)D影响血脂异常及超重/肥胖的机制可能为:25(OH)D不仅可以升高脂肪细胞内钙离子水平,提高脂肪酸合成酶的活性,而且还是脂肪细胞分化的重要抑制剂,可抑制三酰甘油的合成,影响血脂代谢及体质量增加[13-15]。维生素D/维生素D受体(VDR)系统参与调节脂肪细胞脂质代谢。在维生素D3的作用下,VDR通过下调许多脂肪形成中发挥关键作用的功能蛋白来阻断前脂肪细胞的分化,因此维生素不足或缺乏可以增加前脂肪细胞与成熟脂肪细胞的分化[16-18]。脂肪细胞分泌的饱腹激素瘦素与身体脂肪量呈正相关[19]。瘦素通过与VDR相互作用对脂肪细胞产生自分泌-旁分泌的脂肪分解作用,通过抑制脂肪生成和刺激脂肪分解来控制脂质代谢[20]。
综上所述,冬季仍是需要补充维生素 D的主要季节,夏季25(OH)D不足及缺乏也应引起重视。25(OH)D缺乏与血脂异常及体质量增加相关,25(OH)D不足导致TG异常、HDL-C异常及超重/肥胖的发生风险增高。

