不同类型幽门螺杆菌感染与儿童过敏性紫癜发病风险、临床表型的关联性研究
王志超,刘金祥
(1.江苏省南通市第二人民医院 儿科,江苏 南通,226002;2.江苏省如皋市人民医院 儿科,江苏 南通,226500)
过敏性紫癜(HSP)是临床上较为常见的血管炎综合征,主要由免疫复合物介导,以小血管炎为主要临床表现,其发病率在小儿免疫性疾病中占首位,且呈现逐年上升的趋势[1]。临床上,HSP以皮肤紫癜、关节症状、胃肠道症状和肾脏损害为主要特征[2]。研究[3]显示,支原体、幽门螺杆菌(Hp)、链球菌等病原菌的感染是引起HSP患儿自身免疫应答改变的主要诱因。研究[4]表明,Hp感染后的免疫反应与HSP发病密切相关。Hp分为Ⅰ型、Ⅱ型和中间型,各类型在HSP发病中的作用不同,因此本研究主要探讨不同类型Hp感染与HSP患儿发病的关系及其与不同临床表型的关联性。
1 资料与方法
1.1 一般资料
选取2017年1月—2019年10月江苏省南通市第二人民医院接受治疗的HSP患儿100例为病例组,其中男65例,女35例;年龄4~14岁;病程5~27 d。其中15例单纯皮肤型,29例伴消化道症状,31例伴有关节受累。同时,选取同期在本院进行体检的100例健康儿童为对照组,其中男67例,女33例;年龄5~14岁。2组性别和年龄差异无统计学意义(P>0.05)。本研究所涉及的儿童及其监护人均知晓该研究方案且签署知情同意书,该研究方案通过本院伦理委员会的批准(批准文号20160625)。HSP的诊断标准:所有HSP患儿均符合2006年欧洲抗风湿联盟及欧洲儿科风湿病学会制定的HSP诊断标准[5]。Hp阳性判断标准:运用胶体金法进行Hp抗体检测,Hp抗体阳性者即为Hp阳性,其中Hp抗体包括免疫球蛋白G(IgG)和免疫球蛋白M(IgM)。当患儿处于急性感染期,抗体类型主要为IgM,当患儿处于恢复期,抗体类型主要为IgG。
1.2 方法
1.2.1 Hp分型检测方法:抽取患儿外周静脉血5 mL,2 500转/min,离心20 min,取上层血清30 μL,运用Hp抗体检测试剂盒(胶体金法)检测患儿的Hp感染状况,之后运用免疫印迹法检测患儿Hp-IgG抗体分型。Hp检测试剂盒和Hp抗体分型检测试剂盒购自苏州海路生物科技有限公司。分型[6]:Ⅰ型,细胞毒素相关基因A蛋白(CagA)和空泡毒素A(VacA)抗体呈阳性;Ⅱ型,CagA和VacA抗体呈阴性,尿素酶A(UreA)和尿素酶B(UreB)抗体至少1项为阳性;中间型,CagA抗体和VacA抗体其中任意1项为阳性。Hp感染阴性:CagA抗体、VacA抗体、UreA抗体以及UreB抗体均为阴性。
1.2.2 肾功能和紫癜性肾炎标志物检测方法:空腹抽取患儿外周静脉血血清待测,2 500转/min,离心20 min。采用全自动生化分析仪和配套试剂盒检测血清中血清肌酐(Scr)和尿素氮(BUN)含量;采用酶联免疫吸附法(ELISA)检测紫癜性肾炎标志物血清胱抑素(CysC)、肿瘤标志物(TM)、血管性血友病因子(vWF)、血管细胞间黏附分子-1(sVCAM-1)、结缔组织生长因子(CTGF)、金属蛋白酶9(MMP9)含量。检测试剂盒购自美国R&D公司,操作严格按照说明书进行。
1.3 统计学分析
本研究所涉及的试验数据均运用SPSS 20.0统计学软件进行统计学分析,其中计量资料运用t检验。采用均数±标准差表示;计数资料运用χ2检验,采用百分比表示;等级资料采用秩和检验。以P<0.05表示差异有统计学意义。
2 结 果
2.1 Hp感染对HSP发病的影响
病例组有35例患儿Hp呈阳性,Hp阳性率为35.00%;对照组有17例患儿Hp阳性,Hp阳性率为17.00%;2组儿童Hp阳性率差异有统计学意义(P<0.05)。
2.2 Hp感染对HSP肾功能的影响
Hp阳性者肾功能Scr、BUN显著高于Hp阴性者(P<0.05);Hp阳性者紫癜性肾炎标志物CysC、TM、vWF、sVCAM-1、CTGF和MMP9水平均显著高于Hp阴性者(P<0.05),见表1。
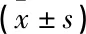
表1 HSP患儿Hp阳性和Hp阴性肾功能以及血清中紫癜性肾炎标志物浓度比较
Scr:肌酐;BUN:尿素氮;CysC:血清胱抑素;
TM:肿瘤标志物;vWF:血管性血友病因子;
sVCAM -1:血管细胞间黏附分子-1;CTGF:结缔组织生长因子;
MMP9:金属蛋白酶9。与Hp阴性者比较,*P<0.05。
2.3 不同类型Hp感染对HSP发病的影响
病例组Hp阳性者35例,Ⅰ型17例,Ⅱ型6例,中间型12例;对照组中,Ⅰ型3例,Ⅱ型12例,中间型2例。病例组I型和中间型感染患儿比例显著高于对照组(P<0.05)。
2.4 不同类型Hp感染对HSP患儿关节症状的影响
病例组31例(Ⅰ型菌株17例,Ⅱ型菌株4例,中间型菌株10例)患儿合并患有关节症状,主要表现为活动受限、肿痛等,无关节症状者4例(Ⅱ型菌株2例,中间型菌株2例)。HSP合并关节症状患儿中,Ⅰ型菌株感染率显著高于无关节症状的患儿(χ2=6.740,P=0.009);中间型菌株感染率和无关节症状患儿感染率差异无统计学意义(χ2=0.890,P=0.347);Ⅱ型菌株感染率显著低于无关节症状的患儿(χ2=4.950,P=0.026)。
2.5 不同类型Hp感染对HSP消化道症状的影响
29例HSP患儿合并消化系统症状,其中17例感染Ⅰ型菌株,2例感染Ⅱ型菌株,10例感染中间型菌株。6例HSP患儿无消化系统症状,其中4例Ⅱ型菌株,2例中间型菌株。HSP合并消化系统症状患儿中,Ⅰ型菌株感染率显著高于无消化系统症状患儿(χ2=7.770,P=0.005);中间型菌株感染率和无消化系统症状患儿感染率差异无统计学意义(χ2=0.090,P=0.766);Ⅱ型菌株感染率显著低于无消化系统症状患儿(χ2=14.990,P<0.001)。
3 讨 论
HSP是临床上较为常见的血管炎综合征,主要由免疫复合物介导,以小血管炎为主要临床表现,主要累及小血管和毛细血管的自身免疫性疾病。HSP疾病进展过程中常累及肾小球,进而影响患儿的肾脏滤过功能,导致代谢产物排泄发生障碍[7]。肾脏损害是HSP病情的严重表现,与HSP预后有关。HSP发病机制尚不清楚,研究[8]表明,HSP发病与机体感染密切相关。Hp是存在于胃黏膜中的革兰氏阴性需氧菌,研究[9-10]表明,Hp感染与HSP存在密切关系。
Hp感染诱发HSP的机制大致如下:机体在Hp及其代谢产物的持续刺激下,产生免疫复合物沉积在患儿的毛细血管基底膜,进而将补体C3活化为C3a、C5a、C3b等过敏毒素,形成膜攻击单位。近些年,随着对Hp的生物学特性、致病机理以及生物分型等研究不断深入,越来越多研究发现,Hp菌株是决定患儿感染预后的重要因素。本研究表明,病例组Hp的阳性率为35.00%;对照组Hp阳性率为17.00%;病例组Hp阳性率显著高于对照组,提示Hp感染参与了HSP发病。
蛋白质的主要代谢产物为Scr和BUN,CysC是机体反映肾小球滤过功能的内源性标志物[11]。本研究表明,HSP患儿中,Hp阳性者肾功能Scr、BUN显著高于Hp阴性者,提示Hp会加重患儿的肾功能损伤。Hp的菌体结构和鞭毛结构及代谢物会刺激多种细胞因子分泌[12]。TM和vMF是糖基化蛋白,当内皮细胞发生损伤,其会释放入患儿的血液中;而VCAM-1是位于内皮细胞表面的黏附分子,介导炎症细胞迁移至内皮细胞进而损伤内皮细胞[13-14]。CTGF和MMP9是反映HSP患儿肾间质纤维化的重要指标[15-16]。本研究结果显示,Hp阳性者TM、vWF、sVCAM-1、CTGF和MMP9水平同样显著高于Hp阴性者,提示Hp会引起HSP患儿内皮功能损伤,使得肾间质发生重构,最终损害机体肾小球的滤过功能。Hp分为Ⅰ型、Ⅱ型和中间型,有研究显示,Hp菌株有不同分型,其致病作用存在巨大差异。Ⅰ型菌株可产生VacA和CagA,会引起上消化组织炎症反应,引起溃疡疾病的发生与发展;Ⅱ型Hp不产生VacA和CagA,且毒性小,仅能够引起轻度慢性浅表性胃炎;中间型表达产生VacA或者CagA,毒力介于两者之间。本研究显示,Hp的不同分型在HSP发病中作用不同,可能为机体感染高毒力菌株从而损伤患儿胃黏膜屏障功能,且产生众多致病因子,进而刺激机体释放细胞因子[10]。
综上所述,HSP的发病及预后可能与Hp感染存在关联,且不同类型Hp感染的致病作用存在差异。Ⅰ型菌株感染与HSP关节和消化道损害有关。

