新型冠状病毒的研究现状与实验室诊断*
靳伟东 综述,张东云,谢凤欣,府伟灵,张 阳 审校
(陆军军医大学第一附属医院检验科,重庆 400038)
自2019年底湖北武汉出现不明原因肺炎以来,中国疾病预防控制中心传染病预防控制所联合多家科研单位先后通过高通量测序获得了新型冠状病毒(SARS-CoV-2)[1]的全基因组序列,并成功分离了我国第1株SARS-CoV-2。这是自2002年严重急性呼吸综合征病毒(SARS-CoV)和2012年中东呼吸综合征病毒(MERS-CoV)暴发以来,冠状病毒再一次大规模感染人类。尽快解析病毒复制及感染宿主的机制对于疫情的防控与治疗性疫苗的研制至关重要。与此同时,及时对疑似患者进行病毒核酸检测和对易感人群进行快速筛查显得尤为重要。在前六版的新型冠状病毒肺炎(COVID-19)诊疗方案中,核酸检测仍是SARS-CoV-2感染的确诊依据,病毒基因测序与实时荧光定量PCR(qPCR)检测为实验室检测中唯一的确诊方法。随着研究的深入,国家卫生健康委员会最新发布的《新型冠状病毒肺炎诊疗方案(试行第七版)》中,新增“将血清SARS-CoV-2特异性免疫球蛋白(Ig)M 和IgG抗体阳性作为病原学诊断标准之一”。本文将围绕SARS-CoV-2分子生物学特征、实验室诊断方法的最新进展及可能影响检测结果及时性、准确性的因素进行述评。
1 SARS-CoV-2的结构特征
冠状病毒(命名时简写为“CoV”)是大型有包膜的正链RNA病毒,于1965年被分离出来,以其在显微镜下可见如日冕般外围的冠状特征而得名,在基因型和血清学上分为四个属,即α,β,γ和δ冠状病毒[2-3]。迄今为止被发现的冠状病毒中(包括此次发现的SARS-CoV-2),只有7种可以使人类感染。其中,HCoV-OC43、SARS-CoV、HCoV-HKU1、MERS-CoV、SARS-CoV-2都属于β属冠状病毒[4-6]。
SARS-CoV-2与2003年的SARS-CoV一样,基本结构为基因组RNA和磷酸化核衣壳蛋白(N蛋白)组成的包膜结构。包膜结构嵌合4种蛋白:刺突糖蛋白(S蛋白)、小包膜糖蛋白(E蛋白)、膜糖蛋白(M蛋白)和血凝素糖蛋白(HE蛋白)。N蛋白被埋在磷脂双层中被两种不同类型的刺突蛋白覆盖,负责营养物质运输的膜蛋白(M蛋白,属于Ⅲ型跨膜糖蛋白)和E蛋白位于病毒包膜的S蛋白之间,见图1。2020年1月6日,研究人员通过电子显微镜解析了SARS-CoV-2的显微结构:SARS-CoV-2病毒颗粒形状并不规则,呈球形或呈多形性,直径75~160 nm,病毒颗粒边缘有形态近似日冕的突起,约9~12 nm,这一形态与冠状病毒科一致。1月16日,上海科技大学饶子和团队率先解析了SARS-CoV-2病毒RNA复制最关键蛋白-3CL水解酶(Mpro)的高分率晶体结构[7]。随后,美国德克萨斯大学奥斯汀分校的研究人员利用冷冻电镜Cryo-EM技术成功解析了SARS-CoV-2刺突蛋白三聚体3.5埃的近原子分辨率结构[8],从生物物理及结构生物学的角度解析了SARS-CoV-2,为相关疫苗的研发工作奠定了基础。
2 SARS-CoV-2的核酸分子特征与遗传变异
在SARS-CoV-2流行之前,21世纪已经暴发了另外两种高致病性冠状病毒,即SARS-CoV和MERS-CoV。这些病毒的暴发是由于人畜共患型冠状病毒越过物种壁垒而导致的[9-10]。研究表明,SARS-CoV-2与SARS-CoV、MERS-CoV在临床表现方面显示出若干相似之处,即都能引起严重的呼吸系统疾病[11]。
2.1SARS-CoV-2全基因组分析 截至目前,国家生物信息中心2019新型冠状病毒信息库(https://bigd.big.ac.cn/ncov)已收录了来自世界各地的283条SARS-CoV-2的完整或部分基因组序列。SARS-CoV-2全基因组包含近30 000个核苷酸碱基,由1a、1ab、S、3a、3b、E、M、6、7a、7b、8b、9b、N和ORF14等14个蛋白编码区域(CDS)构成[12],见图2。对SARS-CoV-2完整基因组进行Blastn搜索显示,GenBank中与SARS-CoV-2最相关的病毒是2个蝙蝠类SARS样冠状病毒:SL-CoVZC45病毒(序列同一性为87.6%,查询覆盖率99%)和SL-CoVZXC21病毒(序列同一性为87.5%,查询覆盖率98%)。SARS-CoV亦起源于蝙蝠SARS样冠状病毒,而与MERS冠状病毒的距离更远。SARS-CoV-2与SL-CoVZC45、SL-CoVZXC21在5个基因编码区域(E、M、7、N和14)中的序列同一性大于90%,在E基因中最高(98.7%),而在S基因中最低,仅为75%左右[13]。

图1 冠状病毒结构模式图
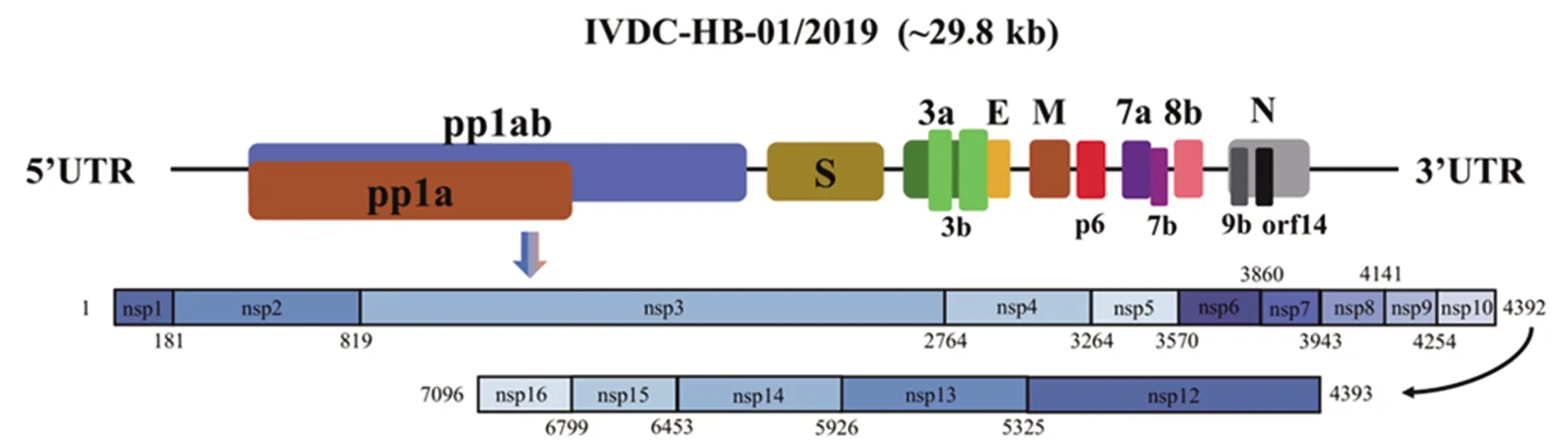
图2 SARS-CoV-2全基因组构成
2.2SARS-CoV-2的分子特征与遗传变异 流行病学调查结果表明,SARS-CoV-2最初的感染病例与接触在动物市场上出售的活体动物有关。XU等[14]通过比较最初分离出来的6株SARS-CoV-2的基因型(序列号分别为:MN908947、EPI_ISL_402119、EPI_ISL_402120、EPI_ISL_402121、EPI_ISL_402123和EPI_ISL_402124),发现这6株病毒的基因型极其保守,同源性>99%。随后,他们又比较了SARS-CoV-2与已知感染人类的SARS-CoV和MERS-CoV的基因组序列。结果显示,SARS-CoV-2基因组与SARS-CoV的基因组具有比MERS-CoV更好的序列同源性[14]。根据冠状病毒的系统发生树,SARS-CoV-2与SARS-CoV的同源性达到79%,而与MERS-CoV的同源性仅为50%[14]。SARS-CoV-2与SARS-CoV之间的序列多样性主要存在于ORF1a和S蛋白基因中。与SARS-CoV和MERS-CoV相比,SARS-CoV-2最显著的遗传特征是其编码更长的S蛋白[13]。研究发现用于冠状病毒物种分类的ORF1ab编码区中的7个保守复制酶结构域在SARS-CoV-2和SARS-CoV之间有94.6%的氨基酸序列一致[15],这意味着两者属于同种类病毒。值得注意的是,TANG等[16]的最新研究发现,SARS-CoV-2已于近期发生了突变,并演化出了L型和S型2个不同的亚型。2个亚型的区别在于病毒RNA基因组的第28 144位点,L型是T碱基(对应亮氨酸),S型是C碱基(对应丝氨酸)。根据基因组数据结果,L型毒株在COVID-19患者人群中占比70%,而S型仅占比30%,推测L型病毒具有比S型更强的传染力。对不同亚型的深入研究,将有助于笔者对COVID-19的差异化治疗和防控。
2.3SARS-CoV-2的溯源分析 在病毒的溯源分析研究中,根据基因测序结果发现SARS-CoV-2与一种蝙蝠冠状病毒RaTG13的全基因组序列相似性达到96.2%,推测RaTG13病毒是SARS-CoV-2的最初起源[17]。进一步研究发现,SARS-CoV-2与RaTG13在S1受体结合域的序列相似性低于75%,表明RaTG13病毒不能直接传染人类,而是通过遗传变异成为SARS-CoV-2最终使人患病。冠状病毒的遗传变异需要有中间宿主,XIAO等[18]解析了从马来亚穿山甲身上分离的一株冠状病毒的基因组序列,发现该病毒与SARS-CoV-2在E、M、N、S区表现出100.0%、 98.2%、96.7%和90.4%的氨基酸同一性,而在受体结构域仅相差1个氨基酸,推测穿山甲可能是SARS-CoV-2的潜在中间宿主。
3 SARS-CoV-2致病的分子机制及潜在的药物靶点
根据病毒的作用机制找到合适的药物作用靶点,已经成为抗SARS-CoV-2药物研究的热点。SARS-CoV-2感染宿主的主要过程包括附着和进入宿主细胞、复制酶的翻译和复制转录复合体的组装、基因复制和转录、结构性蛋白的翻译和病毒粒的组装和释放等。进入宿主细胞是SARS-CoV-2复制周期的首要步骤,主要决定因素是病毒颗粒最外层的S蛋白与细胞表面受体的有效结合。ZHOU等[15]的研究发现,SARS-CoV-2和SARS-CoV类似,可能是通过蛋白受体-血管紧张素转换酶2(ACE2)的靶向识别进入细胞的,SARS-CoV-2的S蛋白上的受体结合域(RBD)与ACE2有很强的结合自由能。因此,针对人类细胞表面受体ACE2 蛋白进行新药研发,竞争性结合ACE2受体,有可能会得到理想的抗病毒效果。同时,S1亚基的RBD也可作为抗COVID-19药物和疫苗研发的重要作用靶点。有研究报道,通过比较分析SARS-CoV-2及其近亲病毒在内的1 000个冠状病毒的S蛋白序列,发现和SARS冠状病毒相比,其S蛋白在S1/S2的酶切位点多出了PRRA 4个氨基酸的插入,从而形成能被人类弗林蛋白酶识别的“RRAR”序列。揭示了SARS-CoV-2 S蛋白中弗林蛋白酶切位点的插入可能是其传染能力增强的1个重要因素,提示弗林蛋白酶可能是抗SARS-CoV-2治疗的新靶点[19]。此外,冠状病毒的非结构蛋白对病毒的复制和组装等过程同样起着非常重要的作用,其中3-胰凝乳样蛋白酶、 木瓜样蛋白酶参与多肽翻译 ,RNA依赖的RNA聚合酶(RdRp)参与病毒复制。因此,这3种蛋白酶也可作为抗病毒药物研发的重要靶点[20-21]。
4 SARS-CoV-2感染的实验室检测
由于该病毒传播速度快,潜伏期较长,因此SARS-CoV-2的实验室检测技术受到人们的广泛关注。目前冠状病毒的检测主要有2个发展趋势:方法的多样性和多种方法互补联合使用。当前针对SARS-CoV-2感染病例的实验室检测主要包括一般血常规检查、呼吸道病原学检查和血清学检查等。
4.1患者常规实验室诊断异常表现 根据国家卫生健康委员会最新公布的《新型冠状病毒肺炎诊疗方案(试行第七版)》,患者以发热、干咳、乏力为主要临床表现。少数患者伴有鼻塞、流涕、咽痛、肌痛和腹泻等症状。重症患者多在发病1周后出现呼吸困难和(或)低氧血症,严重者可快速进展为急性呼吸窘迫综合征、脓毒症休克、难以纠正的代谢性酸中毒和凝血功能障碍及多器官功能衰竭等。
钟南山团队在NEJM杂志上发表的一篇文章详细报道了SARS-CoV-2感染患者的临床特征[22]。该研究发现,与SARS病毒类似,SARS-CoV-2感染患者以发热和咳嗽为主要临床表现,而胃肠道症状并不常见。从血液检查结果来看,有83.2%的患者出现淋巴细胞减少,36.2%的患者血小板减少,33.7%的患者白细胞减少。多数患者的C-反应蛋白水平升高,而较不常见的临床生化特征是丙氨酸氨基转移酶、天门冬氨酸氨基转移酶、肌酸激酶和D-二聚体水平的升高。该研究还指出,重症患者的实验室结果异常(包括淋巴细胞减少和白细胞减少)比非重症患者表现更为突出。针对COVID-19的疾病分型和预后,TAN等[23]提出了一种起病时间-淋巴细胞模型,该模型能够通过外周血淋巴细胞百分比判断COVID-19患者的轻重程度、疾病预后及治疗反应。此外,还有研究指出中性粒细胞/淋巴细胞比值和红细胞分布宽度标准差也有可能是鉴别COVID-19普通型与重型的重要指标。
4.2病原学检测 病毒的病原学检测方法有细胞培养、血清学检测、核酸检测、电镜检测等。与其他方法相比,核酸分子的检测具有快速、灵敏度和特异度高等特点,已成为冠状病毒检测的主流方法[24]。现有的冠状病毒核酸检测方法包括全基因组测序、qPCR法、CRISPR、反转录环介导等温扩增法(RT-LAMP)和实时RT-LAMP等。针对SARS-CoV-2核酸的检测,当前最为普遍适用的方法是qPCR法,即通过对标本中的病毒RNA进行提取、反转录、PCR扩增特定保守序列后,通过荧光等常规方法进行显示。依赖于SARS-CoV-2与SARS-CoV的密切遗传相关性,临床上对SARS-CoV-2的核酸检测所选用的引物设计靶点和SARS-CoV一致,通过扩增RNA依赖性的RdRp基因、E蛋白基因和N蛋白基因序列来检测SARS-CoV-2是否存在[25]。SARS-CoV-2病毒核酸检测的3个基因靶标在全基因组中的位置见图3。
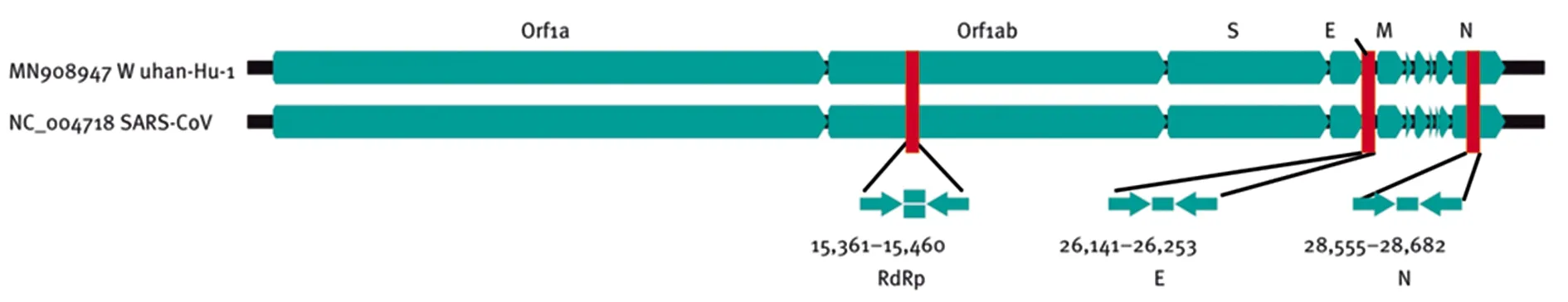
图3 SARS-CoV-2和SARS冠状病毒基因组上扩增子靶标的相对位置[25]。
在COVID-19患者的早期诊断中,具有以下病原学证据之一的患者可被确诊为SARS-CoV-2感染:一是呼吸道标本或血液标本qPCR 检测SARS-CoV-2核酸阳性;二是呼吸道标本或血液标本病毒基因测序,与已知的SARS-CoV-2高度同源。目前市场上绝大部分SARS-CoV-2病毒核酸检测试剂盒采用一步法或磁珠法进行病毒核酸的提取,以ORF1ab和N基因作为检测靶标进行扩增,最后通过荧光检测得到所需的结果,具有快速、易操作等特点。
然而,在大量的临床应用过程中发现核酸检测存在假阴性等不确定的情况。鉴于此,国家卫生健康委员会印发《新型冠状病毒肺炎防控方案(第五版)》,在实验室检测技术指南中明确指出,核酸检测结果阴性不能排除SARS-CoV-2感染,需要排除可能产生假阴性的因素。核酸检测假阴性的原因应考虑以下几个方面:(1)被感染者体内病毒未达到一定水平;(2)采集患者标本时,未采集到含有病毒的标本;(3)体外诊断试剂不够灵敏;(4)不规范的核酸检测程序。此外,通过对6种国产SARS-CoV-2核酸检测试剂的检测性能进行了比较和分析,发现6种试剂对弱阳性标本的检测能力参差不齐,少数试剂对SARS-CoV-2(ORF1ab和N基因)均能检出,而部分试剂只能检测出其中1个[26],说明当前各试剂的准确性和重复性还有待提高。
4.3血清学检查 炎症细胞因子风暴是在高致病性冠状病毒感染(如SARS、MERS)中被观察到的典型异常,且被认为与疾病严重程度有关。最近也有研究报道,SARS-CoV-2感染患者的血清中出现炎症细胞因子水平升高的现象[27]。根据目前最新的《新型冠状病毒肺炎诊疗方案(试行第七版)》,血清学抗体检测已被纳入COVID-19确诊标准之一。与核酸检测相比,抗体检测具有采样简单、检测效率高等特点。IgM抗体是免疫应答中首先分泌的抗体,是病毒感染自体免疫过程中最早出现的抗体,可作为近期急性感染的标志。在通常情况下,IgM 抗体产生早,一经感染,快速产生,多在3~5 d后开始出现阳性,维持时间短,消失快,血液中IgM检测阳性可作为早期感染的指标。IgG 抗体产生晚、维持时间长、消失慢、滴度恢复期较急性期有4倍及以上增高,血液中检测阳性可作为感染和既往感染的指标。因此,通过检测患者血清中 IgM 和 IgG 的阳性情况,将有助于判断患者所处SARS-CoV-2感染的不同时期。
5 其他病毒感染筛查技术的发展
虽然核酸检测是SARS-CoV-2检测的最常用的手段,但也受到诸多因素的限制,比如实施核酸检测需要有专门的仪器和标准的分子检测实验室,防止检测人员受到待检血液或其他体液标本的感染,且取样过程或其他原因可能会导致qPCR结果出现假阴性或漏检,从而使检测灵敏度降低。因此,研发出新的SARS-CoV-2病毒筛查诊断技术将有利于推动本次及今后的疫情防控工作。
5.1基于抗原/抗体检测的即时检验(POCT)产品 和核酸检测相比,基于抗体检测的POCT可在数分钟内出结果,操作简单方便,适用于大批量标本的快速筛查。目前已有多家SARS-CoV-2抗体快速检测试剂盒获批上市。抗体检测法主要是采集COVID-19患者血清或血浆,通过检测其中IgM或IgG抗体浓度值间接检测SARS-CoV-2,可用于疑似病例中核酸检测为阴性的患者的辅助诊断,同时也可以部分反映确诊患者的免疫情况。2020年3月5日,电子科技大学杨正林教授团队研发的SARS-CoV-2 IgM/IgG抗体检测试剂盒(胶体金法)获得欧盟准入资格,可快速、准确检查人体血清中病毒特异性IgM和IgG抗体。与此同时,重庆医科大学黄爱龙教授团队牵头研发的SARS-CoV-2 IgM/IgG抗体检测试剂盒(磁微粒化学发光法),通过国家药品监管局审批。李泉等[28]临床一线工作人员通过25例确诊患者与17例疑似病例分析了上述IgM/IgG抗体检测在SARS-CoV-2肺炎诊断中的应用价值,临床检测结果灵敏度达到了96%,特异度为100%。此外,钟南山院士团队近期发表论文描述了SARS-CoV-2 IgM/IgG联合抗体检测试剂的研发及在SARS-CoV-2感染性疾病临床诊断中的应用[29]。该检测试剂只需滴血可验,约15 min就能出结果,相比需要3~4 h出结果的病毒核酸qPCR检测,大大缩短了检测的时间。经过多中心的临床标本检测评价证实,该检测试剂的临床检测的灵敏度高达88.66%,检测特异度为90.63%;IgM/IgG联合抗体检测的敏感性(灵敏度为94.83%)远高于IgM或IgG单抗体检测(灵敏度分别为1.72%、3.45%)。另外,该抗体检测试剂采用指尖血与静脉血检测结果作对比,发现两者检测的一致性基本吻合,提示SARS-CoV-2 IgM/IgG联合抗体快速检测试剂盒可用于POCT,可以在床旁用指尖采血进行检查。这一便捷、快速、安全,灵敏度高的抗体检测试剂盒,既可作为病毒核酸检测阴性患者的补充检测提高临床诊断率,也可以作为快速筛查的手段,在全国复工、复产、复学等大面积人员流动和聚集的时期发挥筛查的优势。截至目前,国家药品监督管理局共批准SARS-CoV-2抗体检测试剂8个,采用的检测方法主要有胶体金法和化学发光法,见表1。除了IgM/IgG抗体检测外,还有一类抗原检测的策略,被检测对象为血浆中的病毒抗原包括N蛋白和S蛋白[30],通过免疫胶体金法、免疫荧光层析法和高通量化学发光技术等发展为特异性的POCT产品。

表1 目前获批上市的SARS-CoV-2抗体检测试剂
5.2高通量呼吸道感染病原体筛查芯片 早期筛查诊断是SARS-CoV-2疫情防控的关键环节之一。为了有效解决集中检测造成的医疗资源透支和交叉感染的问题,亟需发展核酸提取与扩增一体化、减少“开盖关节”与气溶胶污染、不依赖专业技术人员的现场快速分子检测新技术。上海交通大学谭蔚泓院士团队开发了一种SARS-CoV-2家庭简易快速检测试剂盒,该试剂盒突破了核酸快提、恒温反转录扩增、便携式实时荧光检测和比色检测等关键技术,可根据病毒或病原体相关基因信息设计不同的引物,实现对包括SARS-CoV-2在内的各种病原体的快速现场和家庭检测。近期由清华大学程京团队共同设计开发的包括SARS-CoV-2在内的“六项呼吸道病毒核酸检测试剂盒(恒温扩增芯片法)”也获得了国家药监局SARS-CoV-2应急医疗器械审批批准。该技术是用于呼吸道感染多病毒检测的全新微流控芯片系统,只需采集患者的咽拭子等呼吸道分泌物标本,便可在1.5 h内一次性检测包括SARS-CoV-2在内的6种呼吸道常见病毒,具有高通量快速检测、多指标联合检测等特点。此外,基因芯片技术在病毒的检测中也扮演着十分重要的角色。与传统的分子生物学技术相比,基因芯片最大的特色在于其能够实现对病原体的高通量筛查。
6 SARS-CoV-2的生物安全防护策略
大量的流行病学研究证实,SARS-CoV-2的主要传播途径仍然是呼吸道飞沫传播和密切接触传播。此外,日本“钻石公主号”邮轮在海上隔离,1例患者致该船上数百名游客陆续感染的案例,间接证明了SARS-CoV-2可经气溶胶传播。在生物标本方面,先后从COVID-19患者的粪便和尿液标本中分离出了SARS-CoV-2,证实了患者体液中存在活病毒,提示COVID-19患者体液标本存在实验室污染的可能性,对实验室标本处理与安全防控提出了新的挑战。2月 6 日,国家卫生健康委员会发布了《新型冠状病毒肺炎防控方案(第四版)》,其中对标本的采集和处理做了具体的指示和说明,现将实验室生物安全防护要点总结如下。
6.1标本处理 标本采集后须在生物安全二级实验室生物安全柜内进行分装,标本包装要求要符合《危险品航空安全运输技术细则》相应的标准。涉及外部标本运输的,应根据标本类型,按照 A 类或 B 类感染性物质进行3层包装。废弃标本的处理应该按照《医疗废物管理条例》进行,对废弃物中可能含病原体的标本、耗材、实验废液等高危险废弃物,实验人员需要在实验室就地进行压力蒸汽灭菌或者化学消毒处理。而对于感染性废液,需要用有效氯含量0.55%消毒剂浸泡,并验证灭菌效果后,排入实验室水处理系统。
6.2人员防护 国家卫生健康委员会公布的《新型冠状病毒实验室生物安全指南(第二版)》对实验活动生物安全的个人防护作了明确要求。按照指南,活病毒感染动物、感染动物取样、感染性标本处理和检测、感染动物特殊检查、感染动物排泄物处理等实验操作,应当在生物安全三级实验室操作。未经培养的感染性材料在采用可靠的方法灭活前进行的病毒抗原检测、血清学检测、核酸提取、生化分析及临床标本的灭活等操作,应当在生物安全二级实验室进行,同时采用生物安全三级实验室的个人防护。感染性材料或活病毒在采用可靠的方法灭活后进行的核酸检测、抗原检测、血清学检测、生化分析等操作应当在生物安全二级实验室进行。
7 展 望
SARS-CoV-2病毒在全球范围内的传播对世界公共健康构成了巨大威胁。实验室检测手段的加强能够在一定程度上减少甚至遏制SARS-CoV-2的传播。虽然核酸检测仍是SARS-CoV-2感染的确诊依据,但是目前也有许多实验室研发出了基于抗原、抗体检测的新技术。这些新兴诊断技术与核酸检测优势互补,联合使用后可以大大提高SARS-CoV-2的排查率。鉴于实验室检查结果在疾病诊断中的重要作用,多技术联合核酸检测有望成为今后确诊SARS-CoV-2感染的发展方向。

