甘油可能通过水通道蛋白3减轻脓毒症小鼠肠黏膜屏障损伤
何 锐,朱烨柯,滕文彬,单 跃,易声华,祝胜美,李玉红,3*
(1.浙江大学医学院附属第一医院 麻醉科,浙江 杭州 310006;2.绍兴市人民医院 麻醉科, 浙江 绍兴 312000;3.绍兴市人民医院 医学研究中心,浙江 绍兴 312000)
脓毒症(sepsis)是一种威胁生命的多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS),由于宿主对感染的反应功能失调[1],在重症患者中发病率高,医疗资源耗费大。尽管医疗技术日益进步,但病死率仍高达30%~70%[2]。肠道是体内最大的细菌储存库,是脓毒症的“启动器”,也是“靶器官”[3]。肠黏膜上皮细胞形成屏障阻止肠内细菌和内毒素入血,是人体最大的免疫器官。肠黏膜屏障作用机制复杂,可能与肠机械屏障、局部生物因素、化学因素和免疫功能有关。水通道蛋白 3(aquaporin-3, AQP3)是一种特殊的固有膜蛋白,分子质量为30 ku,具有疏水性,属于水通道蛋白家族成员之一。
AQP3在消化系统多个部位表达[4],调节肠上皮细胞的增殖、迁移以及运输甘油和过氧化氢等。AQP3在小肠中表达丰富,但其是否对肠黏膜屏障具有保护作用,尤其是脓毒症受损肠黏膜的保护作用尚不清楚。在既往研究的基础上,提出如下假设:AQP3对脓毒症肠黏膜损伤具有保护作用。为验证此假设,本研究以甘油替代AQP3试验,通过观察脓毒症小鼠小肠黏膜病理学改变,血浆二胺氧化酶(diamine oxidase, DAO)和肠型脂肪酸结合蛋白2(intestinal type fatty acid binding protein 2, I-FABP/FABP2)浓度变化,以探索AQP3对脓毒症小鼠肠黏膜功能的保护作用。
1 材料与方法
1.1 材料
1.1.1 实验动物:SPF级雄性Balb/c小鼠48只,6~8周,体质量20~25 g(浙江省动物研究中心 [许可证号:SCXK(浙)2-14-0001]。整个实验在20 d内完成。研究方案经绍兴市人民医院学术委员会和浙江大学动物伦理委员会以及动物管理委员会讨论通过(伦理审批文号:ZJU2015-207-10)。动物实验严格按照浙江大学实验动物标准操作流程进行。
1.1.2 试剂与试剂盒:七氟烷(江苏恒瑞医药股份有限公司);柠檬酸舒芬太尼注射液(宜昌人福药业有限责任公司);盐酸罗哌卡因(阿斯利康制药有限公司);甘油(glycerol)(湖南二康药业有限公司);DAO和FABP2试剂盒(Cloud-Clone Corp公司);HE染色试剂盒和Western blot试剂盒(上海碧云天生物技术有限公司);AQP3和β-actin抗体(一抗,Abcam公司);HRP 标记的山羊抗兔IgG(二抗,Jackson公司);免疫组化试剂盒(杭州昊鑫生物有限公司)。
1.2 方法
1.2.1 动物分组及处理:将小鼠用随机数字法分为4组,分别为假手术组 (n=6只)、假手术+口服甘油组(n=6只)、脓毒症时间依赖组(n=24只)为建模后分别于0、6、12和24 h 4个时点处死动物,每个时点6只)和脓毒症+口服甘油组(n=6)。采用盲肠结扎穿孔术(cecal ligation and puncture, CLP)[5],复制腹腔感染型脓毒症小鼠模型。口服甘油组动物术后6 h口服甘油(饮用水2%)[6],其余组自由饮水。
1.2.2 标本采集与处置:脓毒症时间依赖组,于CLP后0、6、12和24 h 4个时间点处死小鼠,其他3组术后24 h处死动物,取眼球血1 mL,置入EDTA抗凝管中,置于2~10 ℃冰箱中,1 h后4 ℃,3 000 r/min离心10 min,分装血浆,-80 ℃保存,用于DAO和FABP2检测。采集小鼠小肠组织,一部分于10%中性甲醛固定后,经脱水,石蜡包埋制成蜡块用于形态学或者免疫组化研究;另一部分分装于冻存管中,存于-80 ℃,用于检测AQP3表达。
1.2.3 病理学检测肠黏膜形态学改变:石蜡包埋块经切片、HE染色、封固,常规光镜下观察小肠组织形态学改变,按照Chiu’s评分法判定判定小肠组织损伤程度[7]。
1.2.4 免疫组化测定肠黏膜AQP3表达:取小鼠小肠组织标本行免疫组织化学染色,采用柠檬酸盐缓冲液(0.01 moL/L)高温高压抗原修复,常规透膜,5% BSA室温封闭1 h,滴加抗-AQP3抗体(1∶1 200)4 ℃过夜。HRP标记的二抗(1∶5 000) 37 ℃孵育1 h,DAB显色,自来水冲洗终止,苏木精复染10 min后返蓝,晾干组织切片,中性树胶封片,镜下观察。
1.2.5 Western blot测定小肠组织AQP3的表达:取出各组小鼠小肠组织,在蛋白裂解液中用组织研磨器裂解,冰上放置1 h,4 ℃ 10 000 r/min离心15 min,取上清液。经BCA方法定量后,取40 μg总蛋白与等体积2×上样缓冲液混合,1 000 ℃煮沸3~5 min变性,上样于10% SDS-聚丙烯酰胺凝胶进行电泳。常规转膜,用含5%脱脂奶粉的TBST室温封闭1 h。加入一抗,4 ℃孵育过夜。经TBST充分洗涤,加入辣根过氧化物酶(horseradish peroxidase, HRP)-山羊抗兔抗体室温反应1 h,TBST洗涤,用ECL发光试剂盒显影。
1.2.6 实时定量PCR(RT-qPCR)测定AQP3的表达:使用Trizol法提取小鼠小肠组织总RNA,微量核酸蛋白检测仪测定RNA浓度。 将mRNA反转录为cDNA,RT-qPCR检测AQP3的表达,反应体系: SYBR Green QPCR Master Mix 10 μL,ddH2O 7 μL,cDNA 2 μL, 和引物上下游各0.5 μL。反应条件为:90 ℃ 10 min,95 ℃ 10 s,72 ℃ 90 s,40个循环。以GAPDH为内参,每组设3个复孔,重复3次,计算平均值。引物如下,AQP3的上游引物序列:5′-GAATCGTTGTGGGGAGATGC-3′;下游引物序列:5′-CCAAAGAGCCCTGTCCCATA-3′;GAPDH的上游引物序列:5′-ACATCATCCCTGCATCCACT-3′,下游引物序列:5′-CCTGCTTCACCACCTTCTTG-3′。
1.2.7 ELISA检测血浆DAO和FABP2水平:取冻存血浆,水浴复温,按照ELISA试剂盒说明书检测各标本血浆DAO和FABP2表达水平。每样本和标准品均设3复孔,获取酶标仪 450 nm处吸光度值(A),并根据吸光度值绘制标准曲线,计算各样本DAO和FABP2含量,取平均值为统计数据。
1.3 统计学方法
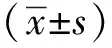
2 结果
2.1 脓毒症小鼠肠黏膜病理损伤
CLP术后,小鼠逐渐出现活动性下降、疲劳、竖毛现象、腹部渗出液、腹泻或黏液排出。病理切片分析显示,CLP后即刻(0 h)的小鼠肠黏膜结构完整,上皮排列紧密整齐,黏膜及黏膜下无水肿及炎细胞浸润。CLP后光镜可见小肠黏膜绒毛变细、变短、排列紊乱、绒毛顶端可见细胞脱落、缺失;其损伤程度呈CLP后时间依赖性加重(图1A);CLP术后6、12以及24 h的Chiu’s评分值呈现递增趋势,均显著高于0 h(P<0.001)(图1B)。
2.2 脓毒症小鼠肠黏膜AQP3表达下调
CLP术后,AQP3表达下调,下调程度呈时间依赖性,CLP后6、12、以及24 h均显著低于0 h(P<0.001)(图2)。
2.3 脓毒症小鼠血浆DAO和FABP2浓度升高
CLP术后血浆DAO和FABP2逐渐升高,呈时间依赖性,术后6、12、24 h均显著高于0 h(P<0.001)(图3)。
2.4 口服甘油治疗改善脓毒症小鼠肠黏膜病理损伤
假手术组和假手术组+口服甘油组小鼠肠黏膜完整,上皮排列紧密;而脓毒症组和脓毒症+口服甘油组肠黏膜绒毛明显受损,绒毛上皮细胞消失,绒毛皱缩变短。口服甘油治疗部分改善小肠黏膜病理损伤(图4A);与脓毒症种组相比,口服甘油后Chiu’s评分明显降低(P<0.05)(图4B)。
A.representative images of intestinal morphology (HE staining, magnification ×200); B.intestinal mucosa injury was quantitative assessed by Chiu’s score;*P<0.001 compared with 0 hour after CLP
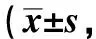
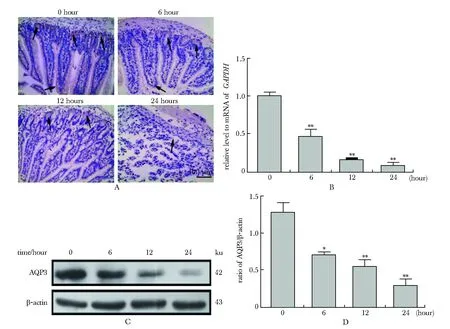
A.staining of AQP3 in intestinal tissue sections of septic mice at different times (×200); B.expression of AQP3 mRNA was down-regulated in a time-dependent manner; C.protein expression bands; D.relative express level of AQP3 was down-regulated in a time-dependent manner;*P<0.01,**P<0.001 compared with 0 h group
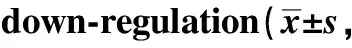
*P<0.001 compared with 0 hour after CLP group图3 CLP后各时间点DAO(A)和FABP2(B)的血浆浓度变化Fig 3 Plasma concentration changes of DAO (A) and FABP2 (B) at each time point after CLP n=6)
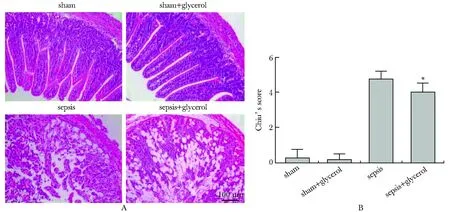
A.microscopic findings of the intestines stained with HE 24 hours after CLP in the sham, sham + glycerol, sepsis and sepsis + glycerol groups (magnification ×200); B.intestinal mucosa injury was assessed by Chiu’s score;*P<0.05 compared with sepsis group
2.4 口服甘油治疗降低脓毒症小鼠血浆DAO和FABP2浓度
脓毒症组和脓毒症+口服甘油组小鼠DAO和FABP2血浆浓度明显增高(P<0.001);口服甘油治疗后,与脓毒症组相比,两者血浆浓度均降低(P<0.05)(图5)。
3 讨论
肠道屏障损伤是脓毒症的重要原因。肠道是体内最大的细菌和毒素储存库,CLP后小鼠形成肠瘘,细菌快速繁殖,并产生大量内毒素,故脓毒症发生急剧、症状严重[6]。本研究中,CLP后,小鼠肠黏膜形态学受损,表现为肠黏膜绒毛明显受损,绒毛尖端的上皮细胞缺失,微绒毛变薄变短。血浆DAO和FABP2浓度是反映肠黏膜结构及通透性较为理想的标志因子[8-9]。本研究中,脓毒症小鼠血浆DAO和FABP2浓度升高,并随着肠黏膜损伤加重而逐渐升高,提示肠黏膜破坏,通透性增加。
靶向AQP3可调控脓毒症患者肠道屏障功能障碍甚至多器官功能障碍[10-11]。结肠炎小鼠AQP3敲
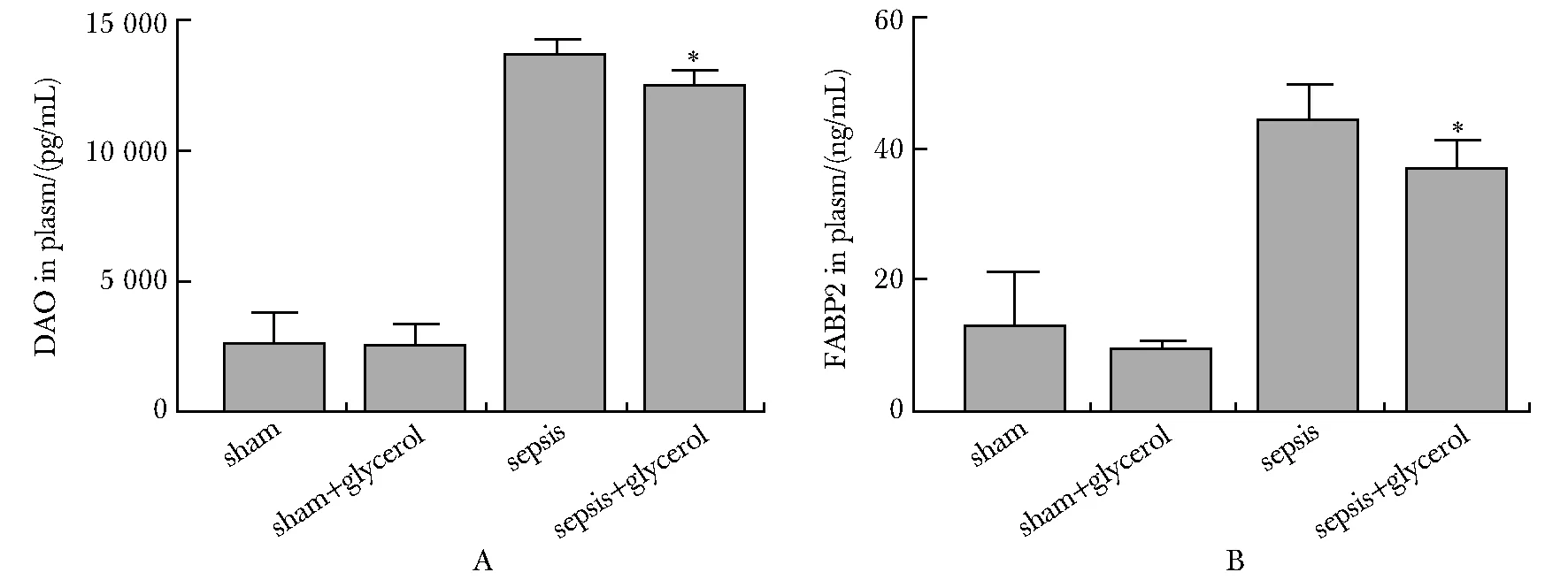
*P<0.05 compared with sepsis group图5 甘油治疗降低脓毒症小鼠DAO(A)和FABP2(B)血浆浓度
除后,小鼠结肠出血、上皮细胞丢失、细胞死亡等现象更为严重。本研究发现CLP后AQP3表达下调,并呈时间依赖性;同时,肠黏膜病理破坏,通透性增加。
本研究尚不能明确肠黏膜损伤引起AQP3表达下降,或者相反,两者可能互为因果。口服甘油治疗能部分替代AQP3功能,改善肠黏膜细胞损伤,促进细胞增殖[6]。本研究对脓毒症小鼠进行口服甘油治疗,结果表明口服甘油部分改善脓毒症所致的肠黏膜损伤。迄今为止,甘油的肠黏膜保护机制尚不明确,可能作为黏膜保护剂发挥黏膜保护作用,也可能通过抑制AQP3下调而发挥作用。
结肠黏膜AQP3表达水平与腹泻、便秘密切相关[12];大肠杆菌引起小鼠腹泻过程中,小肠黏膜AQP3表达下调[13];抗炎药通过抑制AQP3表达减少,能预防CPT-11诱导的延迟性腹泻[14]。在本研究中,CLP术后小鼠出现黏液大便,可能是由于小肠黏膜AQP3表达下调有关。
本研究结果为AQP3对脓毒症肠道损伤的保护作用提供动物实验的初步依据,为进一步研究提供线索。脓毒症肠道损伤病理生理机制复杂,本研究也存在局限性,口服甘油不能完全替代AQP3,为了进一步明确AQP3对脓毒症肠黏膜屏障的保护作用,需要AQP3激动/拮抗剂,或者选用AQP3敲除小鼠进行实验。AQP3对脓毒症肠黏膜屏障功能保护作用的机制也有待于进一步研究。

