血管内皮生长因子在乳腺疾病中的表达及其对诊疗的指导意义
陆琳璘,兰 晶,周晔辉,张立峰,万玉秋,代甜甜,陈 彦
(1.苏州大学附属第一医院普外科,江苏 苏州 215006;2.苏州大学,江苏 苏州 215123)
乳腺癌是世界上女性发病率最高的恶性肿瘤,高居美国女性癌症死亡率排行榜的第二名,同时也是我国45 岁以下年轻女性癌症致死的主要原因[1],位列于中国女性癌症死亡率的前五,它严重威胁着全球女性的健康与生命安危[2]。血管内皮生长因子(vascular endothelial growth factor, VEGF)是一个家族内皮生长因子,包括VEGFA,-B,-C,-D,-E以及胎盘生长因子(PLGF)[3]。它在肿瘤中不仅促进了血管生成和血管通透性,并且VEGF在肿瘤细胞中介导了一种传导肿瘤发生的关键信号,包括了肿瘤干细胞(CSCs)的自我更新和存活[4]。目前,已有研究证明VEGF的水平在多种癌症患者的血清和恶性疾病所致的胸腔积液中是升高的[5]。然而其与乳腺癌的关系尚未明确,有待进一步研究。本研究回顾性观察了48 例良性乳腺患者与100例恶性乳腺患者,分析了血清血管内皮生长因子(sVEGF)在良恶性病例中的表达水平以及乳腺癌患者sVEGF水平与其临床病理特征之间的关系,探讨了sVEGF在乳腺疾病诊疗中的指导意义。
1 资料与方法
1.1 一般资料 选取苏州大学附属第一医院甲状腺乳腺外科2019年1月—2019年5月收治的48 例乳腺良性疾病患者为对照组,同期的100 例乳腺恶性疾病患者为实验组。对照组年龄12~61(37.4±13.3)岁;乳腺纤维瘤19 例,乳腺病13 例,乳腺纤维瘤16 例。实验组年龄22~83(51.5±13.6)岁;BMI≤24 kg/m2(非肥胖)67 例,BMI>24.0 kg/m2(肥胖)33例;绝经62 例,未绝经38 例;左乳肿瘤57 例,右乳肿瘤43 例;肿瘤直径≤2 cm 45 例,肿瘤直径>2 cm 55 例;腋窝淋巴结转移阳性52 例,腋窝淋巴结转移阴性48 例;Ⅰ期56 例,Ⅱ期26 例,Ⅲ期18例;雌激素受体(ER)阳性45 例,ER阴性55 例;孕激素受体(PR)阳性51 例,PR阴性49 例;人表皮因子生长受体-2(HER2)阳性35 例,HER2阴性65 例;Ki67<15% 50 例,Ki67 15%~30% 18 例,Ki67>30% 32 例;浸润性癌68 例,黏液性癌13例,原位癌15 例,乳头状癌4 例。所有纳入病例均为女性患者,单侧肿瘤,既往无乳腺疾病史,未行新辅助化疗,既往体健,术后病理诊断明确。且对照组和实验组的年龄等一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 检测方法 利用血管内皮生长因子测定试剂盒(北京健平金星生物科技有限公司)定量测定人血清中的VEGF含量。此试剂盒利用夹心酶联免疫吸附原理,在微孔板预包被VEGF的单克隆抗体等,加入酶标试剂(辣根过氧化物标记的VEGF的单克隆抗体)和显色剂TMB,通过酶标仪检测吸光度(A值)从而判断样品中VEGF的浓度。采血(禁食10 h),稀释VEGF冻干粉校准品,稀释待检样品与样品稀释液,确定板条数目,稀释浓缩洗涤液,加样温育,洗涤孔内液体,加入酶标试剂,温育,洗涤孔内液体,加入显色液,封板显色,加入终止液,酶标仪测定各孔A值,绘制标准曲线,计算检测结果。健平金星推荐临界值为142.2 pg/mL,即阳性为>142.2 pg/mL,阴性为≤142.2 pg/mL。
1.3 观察指标 观察实验组和对照组sVEGF水平,并分析实验组sVEGF水平与乳腺癌患者临床病理特征之间的关系。
2 结果
2.1 两组sVEGF表达水平比较 实验组的sVEGF阳性率(50/100,50.0%)明显高于对照组的阳性率(12/48,25.0%),差异具有统计学意义(χ2=8.327,P=0.004)。
2.2 sVEGF水平与乳腺癌患者临床病理特征之间的关系 我们对乳腺癌患者的12 项临床病理特征,包括初次被诊断为乳腺癌时的年龄,BMI,绝经与否,原发肿瘤的位置,肿瘤大小,腋窝淋巴结转移情况,肿瘤分期,ER、PR、HER2及Ki67表达情况,组织学分类与sVEGF表达水平相关性进行了统计学分析,结果显示:sVEGF的阳性表达与乳腺癌患者的年龄(P=0.045),肿瘤分期(P=0.028),Ki67表达情况(P=0.019)密切相关,即年龄越大,肿瘤分期越晚,Ki67表达水平越高,sVEGF阳性率越高,而与乳腺癌患者的BMI,绝经与否,肿瘤位置,肿瘤大小,腋窝淋巴结转移情况,ER、PR、HER2表达情况及组织学分类无关(P>0.05)。(表1)
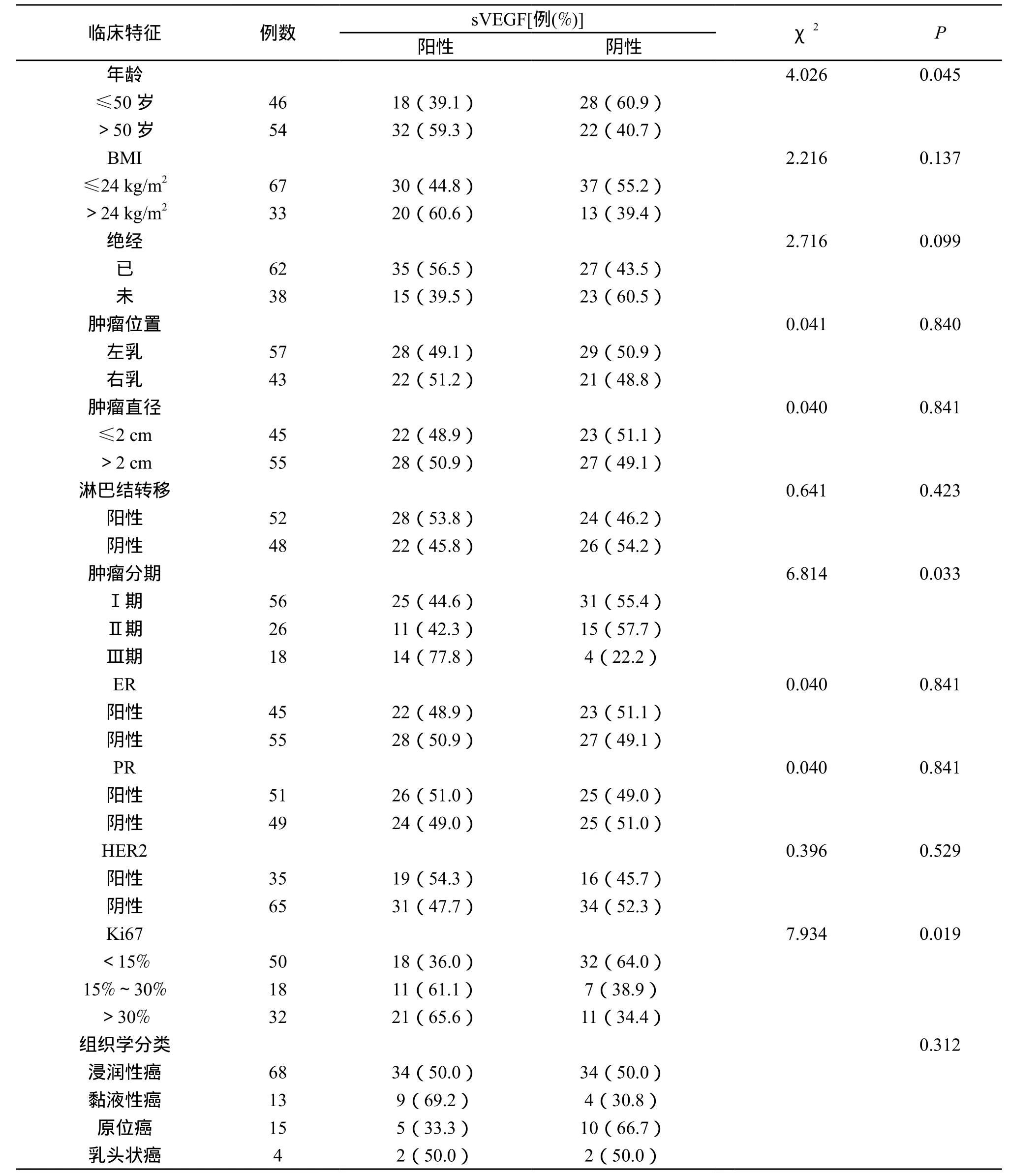
表1 sVEGF水平与乳腺癌患者临床病理特征之间的关系
3 讨论
VEGF最初被定义为一种具有诱导生理和病理血管生成以及血管通透性的能力的内皮细胞特有的有丝分裂原[6-7]。现在VEGF被称为VEGF-A,并且它是庞大的生长因子家族中的一员,它还包括VEGF-B、VEGF-C、VEGF-D和PLGF。这些家族成员在表达模式、受体特异性和生物学功能方面有所不同[3]。1939年,Ide等[8]就推测肿瘤细胞可能产生并释放促血管生成因子。1971年,Folkman[9]提出了肿瘤微环境在肿瘤发生中的重要作用,他认为肿瘤生长依赖于血管生成。此外,还有一些相关学说,在没有血管生成的情况下,几乎所有的肿瘤都被限制在需要用显微镜观察的大小;肿瘤产生可扩散的血管生成分子;抑制血管的生成可以引起肿瘤的休眠[7]。1983年,Senger等[7]证实了其所推测的“血管通透性因子”是一种VEGF。Ferrara和Henzel[10]在1989年成功地分离纯化了第一个VEGF,并证明了VEGF作为一种重要的促血管生成因子的重要作用。1992年,Vries等[11]发现了第一个VEGF受体。目前,VEGF被认为是肿瘤血管生成中最重要的调节因子,通过其刺激肿瘤血管生成的能力参与肿瘤生长的全过程。随着肿瘤转移所需的局部必需氧和营养素的增加,激活宿主血管内皮细胞并促进其恶性增殖[5]。已有研究证明,VEGF不仅是最重要的血管生成因子,也是一种增强血管通透性和触发内皮细胞迁移的有效刺激因子[5]。VEGF在多种癌症患者的血清和恶性疾病所致的胸腔积液中水平有所升高已被证实,如NSCLC细胞能够产生和分泌VEGF,促进胸腔积液形成、血管生成和肿瘤转移进展[5]。然而VEGF与乳腺癌的关系尚未明确,测定sVEGF的水平有望为乳腺疾病的诊疗提供一个新思路。
本研究利用统计学方法对收入我院的病例进行分析,结果显示:(1)乳腺癌患者的sVEGF阳性率明显高于良性乳腺疾病患者。异常的血管生成是癌症发生中被研究的最多的基因改变。血管生成也是恶性肿瘤发生、发展和转移的关键步骤。VEGF的过度表达是血管生成的关键介质,与癌症的不良预后相关[13]。有研究证实,肿瘤细胞中存在自分泌和旁分泌的VEGF信号,这种功能,特别是CSCs的功能在肿瘤发生发展的关键方面起到了重要作用[14]。参考以往研究结果,我们还可以猜测乳腺癌细胞也能够产生和分泌VEGF,其具体机制有待进一步研究发现。并且,VEGF基因的遗传变异也可以通过影响血管生成来调节乳腺癌的发生。VEGF的高表达与肿瘤血管的增强有关,这将有助于肿瘤靶向药物的研究,对VEGF和VEGF受体的抗血管生成靶向治疗提供了基础,为乳腺癌的治疗提供了新靶点。(2)sVEGF的阳性表达与乳腺癌患者的年龄、肿瘤分期、Ki67表达情况密切相关,即年龄越大,肿瘤分期越晚,Ki67表达水平越高,sVEGF阳性率越高,而与乳腺癌患者的BMI,绝经与否,肿瘤位置,肿瘤大小,腋窝淋巴结转移情况,ER、PR、HER2表达情况及组织学分类无关。VEGF基因位于第6p12-p21号染色体上,由8 个外显子和7 个内含子组成,这些内含子通过选择性剪接形成一个蛋白质家族。近年来,已在多种恶性肿瘤中证实,抑制血管的生成可以显著改善患者的预后。这可能与新生血管给予肿瘤足够的营养以维持其浸润生长有关[15]。科学家发现缺乏血液营养的肿瘤,无法及时排除代谢产物,将逐渐处于休眠状态。VEGF不仅是最重要的血管生成因子,也是一种增强血管通透性和触发内皮细胞迁移的有效刺激因子,介导肿瘤的浸润和转移。但本研究并未发现肿瘤大小、腋窝淋巴结转移与sVEGF水平有相关性,这可能是由于样本量不足导致。Ki67是一种增殖细胞的相关抗原,对细胞的有丝分裂和增殖分化起到了重要的作用,是乳腺癌中灵敏而独立的病理诊断指标。它与VEGF的相关性也说明了VEGF的高水平可能预示着肿瘤的恶性程度越高。并且,我们发现在TNM分期中,乳腺癌分期越晚,sVEGF阳性表达率越高,说明VEGF促进了乳腺癌的发生发展,其阳性高表达可能预示着乳腺癌的不良预后。所以,我们可以猜测sVEGF可能可以成为乳腺癌早期诊断中的标志物,这需要进一步探讨研究。
综上所述,检测sVEGF水平有助于鉴别乳腺疾病的良恶性,并且对乳腺癌患者临床分期的判断有诊断意义,临床可以通过该指标的表达水平指导乳腺疾病的诊断和治疗。

