急性蛛网膜下腔出血患者入院心电图异常对住院预后的判断作用*
黄永平 张 勇 王德国 卜莉萍 李二军
(1合肥职业技术学院 安徽合肥 238000;2皖南医学院附属弋矶山医院 安徽芜湖 241001)
急性蛛网膜下腔出血(SAH)患者的心电图(ECG)变化很常见(50%~90%)[1],尽管临床上明显的心律失常并不常见[2]。急性SAH心电图异常的病理生理机制尚不完全清楚。认为肾上腺素能释放过多可能引起心肌损伤,在心电图异常中起重要作用[3]。实验模型显示,中风后血浆去甲肾上腺素水平升高会损害心功能[4-5]。因此,有必要确定临床意义上的心电图变化是否与患者的预后相关。最常见的心电图改变是复极化异常,包括QT间期延长、ST段改变、T波形态改变、U波和Q波异常[6]。这些模拟心脏缺血样形态的心电图改变,可能使SAH的诊断和治疗过程复杂化[7-8]。有几项研究报告称,一些心电图异常可能预测3个月后的不良临床结果[9-10]。其他研究表明,心电图变化与更严重的神经损伤相关,尽管它们不是SAH全因死亡率的独立预测因子[11-12]。据报道,SAH后出现明显的临床心律失常会增加心血管合并症的风险、住院时间延长和临床的不良结果[13]。文章设计了一项回顾性研究,以确定某些心电图异常是否与SAH后的住院死亡或不良临床结果有关。
1 方法
1.1 研究人群
经皖南医学院附属弋矶山医院医学伦理委员会批准,对象为2016年1月至2018年12月收治的有医疗计算机记录的所有自发性SAH患者,通过CT、MRI或脑脊液黄疸来诊断SAH。排除标准包括肿瘤引起的SAH;白血病等血液疾病;最近的头颈部手术;慢性肾功能不全;心脏结构异常,如先天性心脏病感染性心内膜炎;首次心电图采集或入院后延迟72h以上出现临床症状。在这3年中,共有270名自发性蛛网膜下腔出血患者入院。通过上述排除标准,从270例患者中纳入145例,其中男68例,女77例;年龄45~78岁。
1.2 临床评估
收集患者的年龄、性别、高血压、冠心病(CHD)和糖尿病(DM)等医学病理特征。根据Hunt Hess评分(I级,无症状或轻度头痛;II级,中度或重度头痛,颈部强直,可有动眼神经麻痹;III级,精神错乱、嗜睡或轻微的局灶性体征;IV级,昏迷或偏瘫;V级,昏迷、垂死和/或伸肌姿势)和世界神经外科医生联合会(WFNS)分级(I级,格拉斯哥昏迷量表(GCS),15,无运动缺陷;II级,GCS13-14,无运动缺陷;III级,GCS13-14,存在运动缺陷;IV级:GCS 7-12;V级:GCS 3-6),从入院病历中判断患者的临床和神经状态。不良的临床结果定义为出院时,经改良的GCS的住院死亡率或神经系统恶化≥2分[11-14]。
1.3 心电图
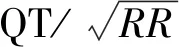
根据以下标准定义和分析心电图的形态学异常:①延长QTc:男性患者最大QTc>440ms,女性患者最大QT>470ms;②缺血性心电图变化:肢体导联ST段抬高和压低≥0.1mV,胸导联ST段抬高和压低≥0.2mV,除AVR和V1外,导联T波倒置(阴性);③形态复极化异常:双相、双峰或尾T波或分离U波≥0.1mV。
1.4 统计分析
采用常用统计软件SPSS 22.0进行统计分析。采用χ2检验或Fisher精确检验对分类变量进行统计分析。连续变量以平均值(sd)表示,并用独立样本t检验进行比较。采用Spearman相关分析法分析变量间的关联性(非正态分布)。选择两组临床变量和心电图异常单变量比较(p<0.1),进行多因素logistic回归。p<0.05被认为具有统计学意义。
3 结果
根据患者的住院结果,将其分为预后好组(n=116)和预后不良组(n=29)。如表1所示,这两组患者在年龄、性别、联合用药方面没有显著差异。然而,与预后好组相比,预后不良组的WFN等级和Hunt-Hess量表明显较高。
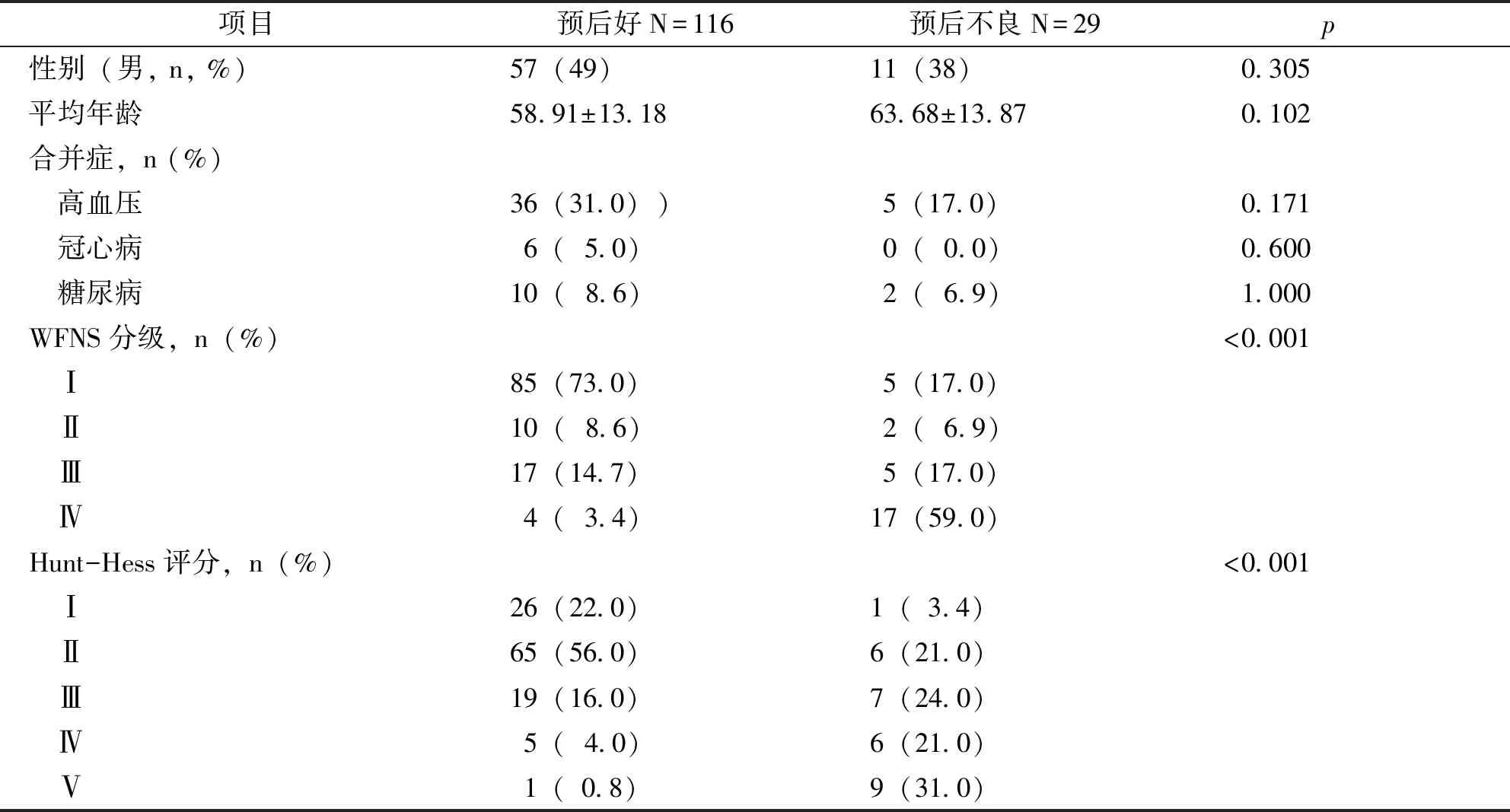
表1 SAH患者的人口统计学和临床特征
研究期间的心电图结果如表2所示。与预后好组结果相比,不良结果组心率明显加快(p=0.002),QTc间期延长(p=0.027),左室肥厚增高(p=0.002),ST段异常频率增高(p<0.001)。其它ECG参数均相等(p值均大于0.05),这些参数包括心电图T波形态、TP-E、QRS波轴、异常U波、Q波等。
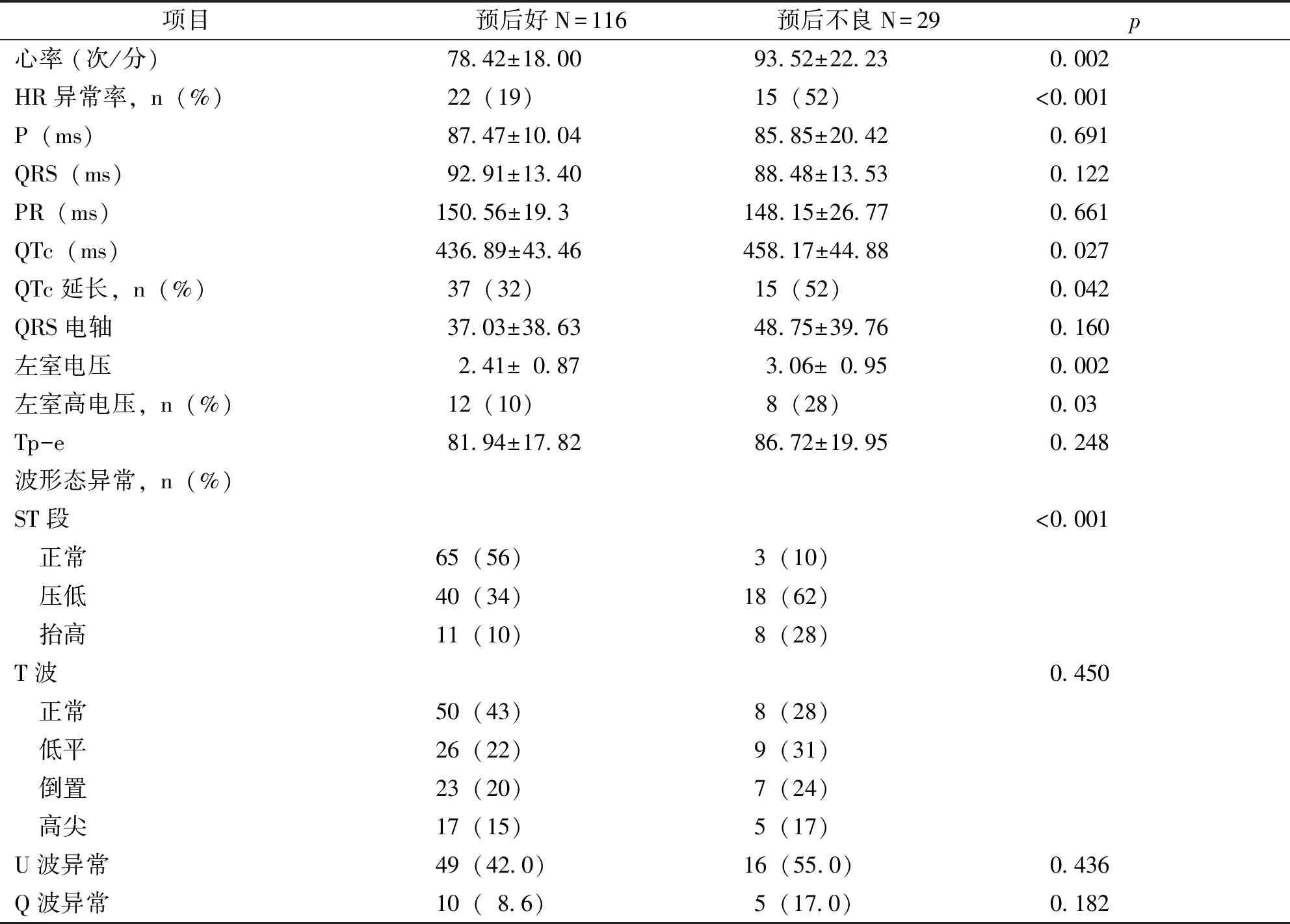
表2 患者心电图表现
SAH患者心电图参数与住院不良预后的相关性如表3所示。住院不良预后与心率、QRS波轴、ST段异常、左室肥大呈显著正相关。住院不良预后与Q波、U波、qtc间期、tp-e间期异常无显著相关性。

表3 与SAH患者住院不良预后相关的心电图参数
采用多logistic回归模型分析住院不良预后的风险,分析的独立变量为WFNS分级、Hunt-Hess量表、心率、QTC延长、Q波异常、U波异常、左室肥大、ST段异常、T波异常、QRS波轴异常。结果表明,WFNS分级、ST段异常和HR异常是非创伤性蛛网膜下腔出血患者住院不良预后的显著独立变量。变量的优势比和p值如表4所示,均小于0.05。
表4 多元logistic回归模型中与SAH患者住院不良结局相关的统计独立变量。
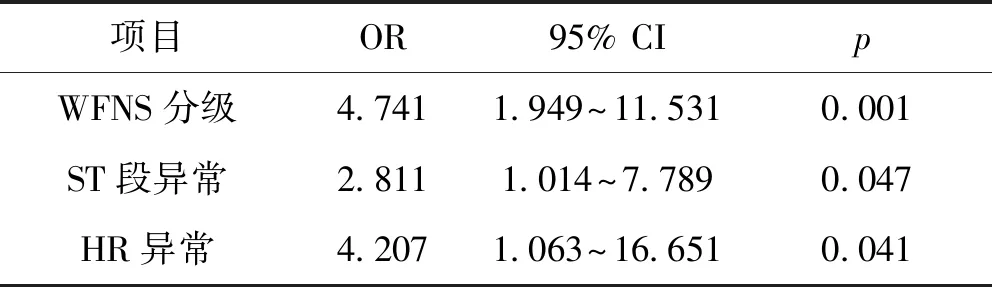
项目OR95% CIpWFNS分级4.7411.949~11.5310.001ST段异常 2.8111.014~7.7890.047HR异常4.2071.063~16.6510.041
4 讨论
研究数据表明,对于临床结局较差的SAH住院患者,除入院时的临床情况外,ST段异常(包括压低、抬高)、心率异常是独立的预测因子。以往的研究表明,在蛛网膜下腔出血早期,QTC间期延长是最常见的心电图表现[18-19]。
据报道,QTC间期延长是住院死亡率和不良临床结局的独立预测因子[14-20]。在该研究中,急性SAH患者QTc间期延长比例较高。尽管不良预后组患者的qtc间期较长,但结果与QTc间期的相关性没有达到统计学意义(r=0.162,p=0.052)。重要的是,logistic回归模型显示,异常的QTc间隔不能作为SAH患者住院不良结局的独立预测因子。
体表心电图的t波形态受复极化过程中跨壁离散度的影响[21]。SAH患者T波异常的发生率非常高,波动变化严重,预后较差[16-22]。在该研究中,的SAH患者常出现异常的T波,如倒置、平直、双相、直立等。但T波差异、T波与住院结局的相关性,均未达到统计学意义。因此,T波异常可能是由脑损伤引起的非特异性改变。
另一个代表性的SAH心电图变化是ST段抬高或压低,这类似于急性缺血性心脏病[8]。当与心肌肌钙蛋白升高同时发生时,很有可能将ST改变错误地估计为缺血性心脏病。由于缺血性心脏病的治疗包括抗凝血剂、抗血小板治疗或纤溶剂,误诊可能导致致命的不良后果[23]。几项研究表明,SAH后72h内ST的变化与不良临床结局的风险增加是独立相关的[16-24]。一种包含ST抬高、ST压低和T波倒置的新型心电评分可以预测心壁运动异常和SAH预后,这可能与死亡风险增加有关[16]。因此,ST改变可能是SAH心肌损害的一个标志,心脏损伤进一步导致SAH患者预后不良。在该研究中,预后较差的患者ST异常改变的频率较高。相关分析也证实,预后与ST段异常呈正相关(r=0.375,p<0.001)。此外,logistic回归模型显示,ST段异常是SAH患者住院不良结局的独立预测因子(OR=2.811,95%CI:1.014-7.789,p=0.047)。
还发现,心率异常是住院治疗不良的另一个独立危险因素。这与之前的报道一致,即心动过缓和相对心动过速与蛛网膜下腔出血后3个月的死亡率有很强的独立相关性[20]。在该研究中,心率异常并不常见,但预后不良的患者出现心率异常的频率较高,包括窦性心动过缓和心动过速。但确定SAH后心率异常与神经系统结果之间是否存在因果关系,还需要进一步研究。
导致上述心电图异常的机制尚不清楚。然而,一些证据表明,SAH可引起局部脑动脉痉挛和下丘脑及周围区域的缺血性损伤[25-26],这种脑损伤可能导致心脏交感神经过度兴奋,故高水平的儿茶酚胺可引起冠状动脉痉挛和可逆性缺血性休克心肌[26]。事实上,SAH患者的尸检显示冠状动脉相当正常,这表明这些心电图异常可能是由心肌微循环的短暂血管收缩或儿茶酚胺毒性作用直接引起的,而不是心肌梗死引起的[27],预后不良的患者心率加快也可能来自循环儿茶酚胺的毒性作用。
该研究有一些局限性。首先,由于所有患者均有SAH,这些心电图异常不能与其他临床情况相比较。其次,这些患者在SAH发生前没有心电图记录,所以不能排除部分患者存在心电图异常。最后,由于定义困难,该研究无法评价T波除倒置和直立峰外的形态变化。在今后的研究中,应采用T波形态学分析等新方法来阐明这些非特异性T波异常。
5 结论
研究表明,除入院时的临床情况外,标准12导联心电图72h内的心率异常、ST段压低或抬高与住院SAH患者不良临床结局风险增加独立相关。这些结果表明,SAH后心电图异常与神经系统预后有重要关系。

