MicroRNA-499对中华鳖脂类代谢相关基因表达的影响
卢 祎,高有领,王水涛,何盛盛
(浙江万里学院 生物与环境学院,浙江 宁波 315100)
MicroRNA(miRNA)是一类长度为19~25个核苷酸的内源性非编码小分子单链RNA,可以与靶基因的3′非翻译区(3′-untranslated region,3′-UTR)结合从而抑制靶基因的翻译或降解靶基因,实现转录后水平调控靶基因的表达,并最终影响蛋白质的合成。miRNA多在基因间隔区、内含子、编码蛋白的外显子区域内转录产生[1-2],在生物体内构成一个极其复杂的网络调控系统。有研究表明,miRNA参与了发育、细胞分化、细胞凋亡、激素分泌、脂类代谢,以及肿瘤发生、糖尿病和病毒感染等多种生理和病理过程[3-4]。也有证据表明,miRNA是脂质合成、脂肪酸氧化及脂蛋白形成和分泌的关键调控因子。脂类代谢有关的miRNA种类较多,目前研究主要集中于miR-33、miR-122等,其调控方式主要是通过调节与脂类合成和氧化相关基因的表达来调节脂类代谢[5]。miR-499已知与人的急性心肌梗死[6]、猪氧化肌纤维的形成[7]和人肺癌的发生[8]有关,但目前尚无研究证实与脂类代谢相关。本研究以中华鳖为试验动物,旨在研究miR-499对中华鳖脂类代谢相关基因的调控作用。
1 材料与方法
1.1 材料
1.1.1 miR-499 antagomirs 和miRNA-499
miR-499 antagomirs由生工生物工程(上海)股份有限公司制备,对其进行3′端胆固醇修饰、3′端4个硫代骨架修饰、5′端2个硫代骨架修饰、全链2′甲基化修饰[9]。miRNA-499序列为:5′-TTAAGACTTGCAGTGATGTTTA-3′;miR-499 antagomirs序列为:5′-tsasaacatcactgcaagtctstsasas-Chol-3′(小写字母表示2′-O-甲基修饰的核苷酸,下标“s”表示硫代磷酸酯键,“Chol”表示通过羟基脯氨酸键连接的胆固醇)。
1.1.2 试验动物
试验用中华鳖为2019年孵化的健康稚鳖,购于浙江省湖州市的养殖场,试验在浙江万里学院生态养殖实验室进行。
1.2.3 主要试剂
甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)和总蛋白(total protein,TP)检测试剂盒购自南京建成生物工程研究所;Trizol购自Ambion公司;RevertAid First Strand cDNA试剂盒购自Thermo Scientific公司;Mir-XTM miRNA First-Strand Synthesis Kit、TB GreenTMPremix ExTaqTMII购自TaKaRa Biotechnology公司。
1.2 方法
1.2.1 试验设计
选取15只健康稚鳖,体质量(52.04±6.28)g,随机分成3组,分别为空白对照组、注射生理盐水组、注射miR-499 antagomirs组,每组5只中华鳖。分组后,进行暂养驯化,7 d后进行腹腔注射。试验期间,中华鳖每天早晚(09:00和19:30)各投喂1次,定时检测水质,每天换水,水温保持在28~30 ℃,水中溶解氧含量大于5 mg·L-1,氨基氮小于0.01 mg·L-1,光照周期为12 L/12 D。
1.2.2 中华鳖腹腔注射与样品采集
注射开始前,用少量DEPC水溶解antagomirs,注射剂量为每只每次13.2 μg,生理盐水组注射200 μL 0.65% NaCl溶液。采用腹腔注射(图1),具体注射过程如下:擦干体表水后翻转中华鳖,使腹部朝上,拉开一侧后肢,露出后肢根部无腹甲覆盖处的皮肤(进针位置),用酒精棉球消毒。选取2 mL注射器吸取注射液,进针方向为水平向心略侧向背甲,与中华鳖腹部正中线呈45°,进针深度1.5 cm左右,然后缓缓注入注射液。试验时,在同一时间连续注射3 d,最后1次注射后24 h采样。中华鳖解剖后,采集血液,离心后分离血浆,迅速分离肝脏组织,液氮速冻后置于-80 ℃超低温冰箱保存。
1.2.3 血清与肝脏中甘油三酯和总胆固醇含量测定
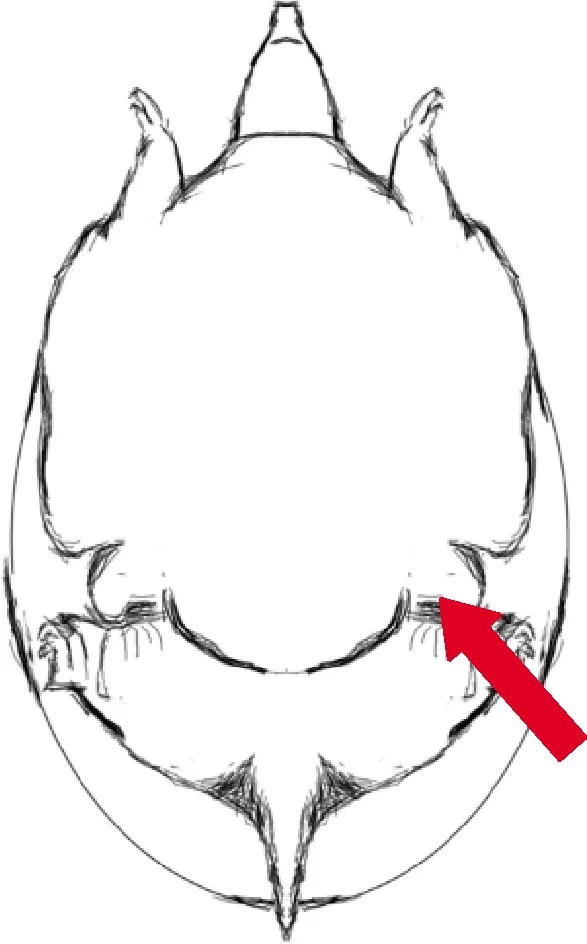
红色箭头所示为注射部位。The red arrow showed the injection site.图1 腹腔注射示意图Fig.1 Diagram of intraperitoneal injection
采用试剂盒测定中华鳖血清和肝脏中甘油三酯、总胆固醇和总蛋白含量,具体操作步骤按试剂盒说明书进行。
1.2.4 脂类代谢基因表达分析
用Trizol提取中华鳖肝脏总RNA,使用具有Oligo(dT)18引物的反转录试剂盒合成cDNA;使用Mir-XTM miRNA First-Strand Synthesis Kit反转录microRNA。用TB GreenTMPremix ExTaqTMII试剂盒进行荧光定量PCR,以β-actin和U6为内参基因,目的基因及内参基因引物序列见表1。反应程序:95 ℃预变性30 s;95 ℃变性5 s,55 ℃退火30 s,72 ℃延伸30 s,30个循环;65 ℃反应5 s,95 ℃反应5 s。用荧光定量PCR方法分别对脂类代谢相关基因甲状腺激素应答蛋白(THRSP)、酰基辅酶A氧化酶1(ACOX1)、乙酰辅酶A羧化酶A(ACACA)、固醇调控元件结合转录因子1(SREBF1)、脂肪酸合成酶(FASN)、过氧化物酶体增殖物激活受体-γ(PPARγ)、肉碱棕榈酰转移酶1(CPT1)、酰基辅酶A合成酶长链家族成员1(ACSL1)、脂肪酸结合蛋白(FABP)和钠/碘共同转运体(NIS)基因的相对表达量进行测定。
表1 引物信息
Table 1 Primer information

基因Gene引物名称Primers name引物序列Sequence(5’-3’)THRSPTHRSP-5-49CAACAGCCAGCATCCCTTHRSP-3-289GACCCTCCATCGCAAGTFASNFASN-5-3575TCCTGGTCTCCTAAACACTCAFASN-3-3871TCGCCAAGCATTTCTCCTACSL1ACSL1-5-649TGACAATGGCTGGTGACACSL1-3-936CCTGTGCGAGTTTGAATATCPT1CPT1-q5-1033GCCGTTATTTCAAAGTCTGTCCPT1-q3-1307ATCCTCTTCCCTGTATCCCTSREBF1SREBF1-5-3773TATTGGTCCATTTCTCCAGCCTTCTSREBF1-3-4097CCAGCACTAACACTGAGCCCTTCFABPFABP-5-152AAAGGGCAAGGACATCAFABP-3-309CAACAGCCTTGACCTTCTACOX1ACOX1-5-295GACTGCAAGGTTCCTGGTCACOX1-3-552CATGAATCCTCCTGGCTCACACAACACA-5-1278TGCGACCTTAGTGGTGTTTACACA-3-1529ATTACGCGGATGTCTTTGAPPARγPPAR-5-80TCACTCCCATTCCTTCGPPAR-3-393AAGCCTTGTCTCCACATACNISNIS-5-144TCAGCGGCGTTTGATTGAGNIS-3-456ACACCCAGAAATGTCCGAGAACmiR-499aca-miR-499-5pTTAAGACTTGCAGTGATGTTTAβ-actinβ-ACTIN-5-162TCCTGACAGAAAGAGGCTACAβ-ACTIN-3-382GGATGGCTGGAAGAGGGU6U6FCTCGCTTCGGCAGCACAU6RAACGCTTCACGAATTTGCGT
1.2.5 数据处理与分析
采用2-ΔΔCt方法对荧光定量PCR的数据进行分析,分别以β-actin和U6基因的表达水平作为中华鳖脂类代谢基因和miRNA表达水平的标准。采用SPSS 19.0软件进行单因素方差分析,结果以“平均值±标准差”表示。
2 结果与分析
2.1 血清中甘油三酯和总胆固醇含量
相对于空白对照组和生理盐水注射组,注射miR-499 antagomirs组中华鳖稚鳖血清中总胆固醇含量显著升高(P<0.05),但是甘油三酯含量无显著差异(P>0.05)(图2)。
2.2 肝脏中甘油三酯和总胆固醇含量测定
相对于空白对照组和注射生理盐水组,注射miR-499 antagomirs组中华鳖稚鳖肝脏中甘油三酯和总胆固醇含量均无显著差异(图3)。
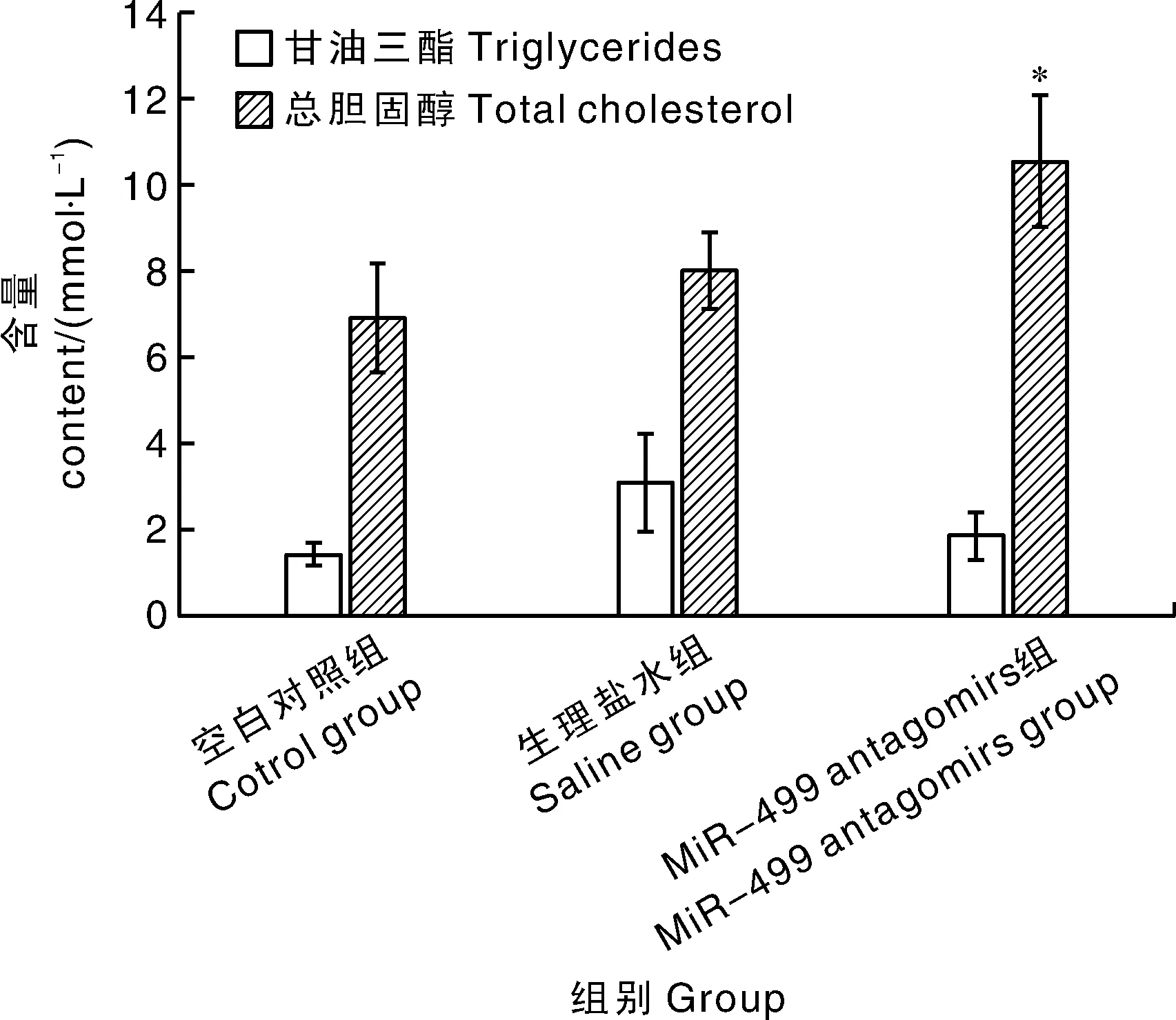
数据柱形标注*表示与空白对照组差异显著(P<0.05)。下图同。Value columns with * symbol meant significant difference compared to the control (P<0.05). The same as below.图2 MiR-499 antagomirs对中华鳖稚鳖血清中甘油三酯和总胆固醇水平的影响Fig.2 Effects of miR-499 antagomirs on serum triglyceride and total cholesterol level of Pelodiscus sinensis
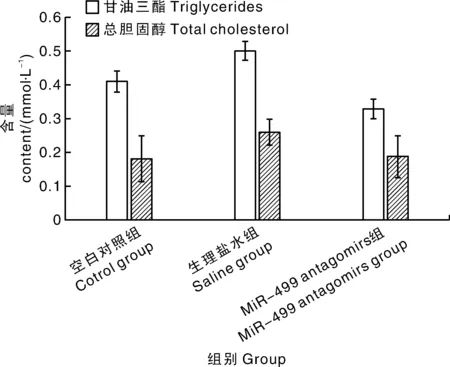
图3 miR-499 antagomirs对中华鳖稚鳖肝脏中甘油三酯和总胆固醇水平的影响Fig.3 Effects of miR-499 antagomirs on liver triglyceride and total cholesterol level of Pelodiscus sinensis
2.3 脂类代谢相关基因表达量的测定
Antagomirs组miR-499的相对表达量显著低于空白对照组和生理盐水组(图4)。中华鳖肝脏脂类代谢相关基因的表达量见图5,相对于空白对照组和注射生理盐水组,注射miR-499 antagomirs组THRSP和NIS表达水平显著升高(P<0.05),CPT1表达水平显著降低(P<0.05),ACOX1、ACACA、ACSL1、FABP、FASN、SREBF1和PPAR表达水平无显著差异(P>0.05)。
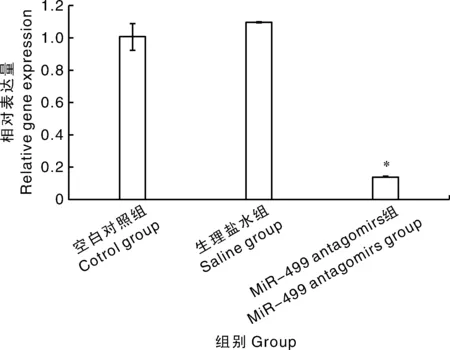
图4 miR-499基因相对表达量Fig.4 Relative expression of miR-499 gene
3 结论与讨论
本试验中,相对于空白对照组和注射生理盐水组,注射miR-499 antagomirs对稚鳖血清和肝脏中甘油三酯含量无显著影响,这与张犁苹[10]的研究结果相似。注射miR-499 antagomirs组稚鳖血清中总胆固醇含量显著升高,提示miR-499 antagomirs增加了中华鳖血清中胆固醇含量,说明miR-499可能与胆固醇生成有关,这与zhang等[11]的研究结果一致。注射miR-499 antagomirs显著降低了中华鳖肝脏中miR-499基因的相对表达量,表明antagomirs成功抑制稚鳖体内miR-499的表达,该结果与Chu等[12]和杨峰[13]的研究结果一致,上述作者采用相应的antagomirs分别成功地抑制了miR-126、miR-33和miR-122的表达。THRSP基因在哺乳动物的肝脏、脂肪和乳腺等脂肪生成组织中高度表达,在脂肪合成过程中具有重要调控作用[14]。钠/碘共同转运体是一种跨膜糖蛋白,NIS基因在甲状腺中高度表达,主要功能是调节甲状腺细胞摄取碘分子[15-16]。CPT1是脂肪酸β-氧化的关键限速酶[17]。本试验中,注射antagomirs引起中华鳖肝脏中THRSP基因表达水平显著升高和CPT1基因表达水平显著降低,表明中华鳖肝脏中脂肪合成增加,脂肪酸β-氧化减弱,说明了miR-499具有调节中华鳖脂肪生成和β-氧化的作用。
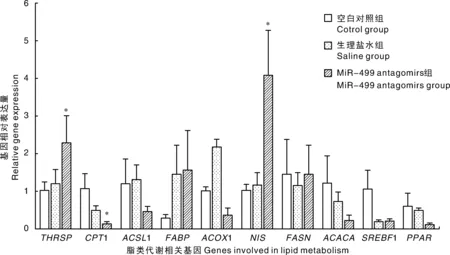
图5 miR-499 antagomirs对中华鳖脂类代谢相关基因表达水平的影响Fig.5 Effects of miR-499 antagomirs on lipid metabolism-related genes expression level of Pelodiscus sinensis
有关miRNA-499的研究多集中在肿瘤、心脑血管等疾病方面[18-20]。有研究表明,miRNA-499与心肌梗死[21-22]、冠心病[23]、心房颤动[24-25]、心肌细胞缺血损伤[26-28]等心血管疾病相关。也有研究表明,miRNA-499与缺血性脑卒中的脑供血障碍性疾病有关[29]。脂质代谢紊乱是引起各种心、脑、血管疾病的重要启动因素,如胆固醇内稳态失调和脂肪酸过氧化等可引起脑卒中、冠心病、脂肪肝、肥胖症等多种疾病[30]。miRNA-499与心、脑、血管疾病具有相关性,而脂质代谢紊乱与心、脑、血管疾病也有密切联系,因此miRNA-499可能通过调节脂质代谢,从而参与调节心、脑、血管疾病发病的发生。Zhang等[11]的研究证实了这一点,他们用miR-449模拟物和抑制剂转染人肝癌细胞,发现miR-449通过抑制沉默接合型信息调节因子2同源蛋白1(SIRT1)和胆固醇调节元件结合蛋白1(SREBP-1c)表达,下调其靶基因脂肪酸合成酶基因(FASN)表达,控制肝癌细胞的脂肪生成和胆固醇生成,从而抑制肝癌细胞的DNA合成、有丝分裂进入和增殖,这也佐证了本试验的推断,即miR-499参与调节中华鳖肝脏脂肪生成和脂肪酸β-氧化的过程。
体内注射miR-499 antagomirs上调了中华鳖脂肪合成相关基因(THRSP和NIS)表达水平,下调了脂肪酸β-氧化相关基因(CPT1)的表达水平,表明miRNA-499与中华鳖脂肪生成和脂肪酸β-氧化有关。

