代谢综合征患儿肝前脂肪厚度和腰围变化*
王丽君,靳广甫,王 齐,吴 丹,李素娟
代谢综合征(metabolic syndrome,MS)是临床常见的代谢性疾病。有报道显示MS发病率为11.8%,且有上升趋势[1]。既往多认为MS与免疫和代谢异常有关,常与非酒精性脂肪性肝病(NAFLD)伴随出现,临床则多表现为肥胖和高尿酸血症[2]。随着MS病情进展,逐渐引起血管内皮细胞功能障碍和肠道菌群失调,增加心脑血管事件发生的风险[3,4]。因而,MS的早期诊断对控制病情进展,改善预后具有重要意义。目前,腰围是临床判断MS的重要依据,但单一指标诊断效果有限[5]。有学者提出了肝前脂肪厚度检测有助于MS的诊断[6],但其在儿童中的研究报道较少。本研究回顾性分析了在本院体检的445例儿童的临床资料,分析了肝前脂肪厚度和腰围诊断MS的临床应用价值,现报道如下。
1 资料与方法
1.1 临床资料 2017年2月~2019年2月在我院体检的儿童445例,男296例,女149例;年龄10~14岁,平均年龄为(12.4±2.6)岁;体质指数为18.5~27.0 kg/m2,平均为(22.8±2.7)kg/m2。MS诊断符合中华医学会儿科学分会内分泌遗传代谢学组推荐的标准[7]:① 腰围:≥同龄同性别儿童腰围的90个百分位(P90),为诊断儿童和青少年MS的基本和必备条件,同时具备以下至少2项:(1)血清甘油三酯≥1.47 mmol/L;(2)高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)<1.03 mmol/L,或低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C))≥3.76 mmol/L;(3)高血压: 收缩压≥同龄同性别儿童血压的P95或舒张压≥同龄同性别儿童血压的P95;(4)高血糖:①空腹血糖受损:空腹血糖≥5.6 mmol/L;②或糖耐量受损:口服葡萄糖耐量试验2 h血糖≥7.8 mmol/L,但≤11.1 mmol/L;③或伴有2型糖尿病。NAFLD诊断符合中华医学会肝病学分会脂肪肝和酒精性肝病学组推荐的标准[8]:(1)无饮酒史或饮酒折合乙醇量<140 g/周(女<70 g/周);(2)肝组织病理学活检可见肝腺泡3区大泡性或以大泡为主的混合性肝细胞脂肪变;(3)排除病毒性肝炎、自身免疫性肝病和其他能导致脂肪肝的特定疾病。排除标准:(1)既往有神经系统疾病或精神病史者;(2)入院前已接受护肝或改善胰岛素抵抗治疗者;(3)合并有恶性肿瘤。在445例儿童中,肥胖者37例(8.3%),发现NAFLD 54例,MS 18例,健康儿童373例。本研究得到儿童及其监护人的知情同意,签署知情同意书,并获得我院医学伦理委员会的批准。
1.2 超声检查 使用ZY-6600型彩色超声诊断仪(武汉金莱特光电子有限公司),探头频率为7.5~10 MHz。取仰卧位,选用10.0 MHz探头,将探头置于腹部前正中线上剑突下1.5 cm处,与皮肤保持垂直,取横切面解剖图像,测量腹膜与白线间最大脂肪层厚度,记为肝前脂肪厚度。充分暴露颈动脉,测定颈动脉内中膜层厚度(intima media thickness,IMT)。在脐上1 cm处测腹直肌内面至腹主动脉后壁的垂直距离,连续测量3次,取平均值,记为腹内脂肪厚度。
1.3 血生化指标检测 空腹抽取静脉血3~5 ml,采用免疫荧光分析仪检测高敏C反应蛋白(high-sensitivity C-reactive protein,hs-CRP,上海飞测生物科技有限公司);使用生化分析仪检测血HDL-C、LDL-C、胆固醇(cholesterol,TC)和甘油三酯(triglyceride,TG)水平(济南格利特科技有限公司),计算胰岛素抵抗指数(homeostasis model assessment of insulin resistance,HOMA-IR)。
1.4 人体指标测量 使用YXY-61型医用电子血压仪测量收缩压(systolic blood pressure,SBP)和舒张压(diastolic blood pressure,DBP,北京东华原医疗设备有限责任公司);测量腰围,连续测量3次,取平均值。

2 结果
2.1 三组肝前脂肪厚度、腹内脂肪厚度、腰围和IMT比较 在373例健康儿童中,根据年龄和性别配比,选择其中54例作为对照组。MS儿童肝前脂肪厚度、腹内脂肪厚度和腰围显著大于NAFLD和健康儿童,差异具有统计学意义(P< 0.05,表1)。
2.2 三组临床和血清指标比较 MS儿童 HOMA-IR、hs-CRP、SBP和LDL-C水平显著高于,而血清HDL-C水平显著低于NAFLD和健康儿童,差异具有统计学意义(P< 0.05,表2、表3)。
2.3 影响儿童MS发生的多因素Logistic回归分析 将单因素分析中差异有统计学意义的指标纳入Logistic多因素回归模型,结果显示肝前脂肪厚度(95%CI=1.098-4.198,OR=2.147,P=0.026)、腰围(95%CI=1.395-4.523,OR=2.512,P=0.002)和腹内脂肪厚度(95%CI=1.332-5.958,OR=2.817,P=0.007)是预测儿童发生MS的独立危险因素(表4)。

表1 三组肝前脂肪厚度、腹内脂肪厚度、腰围和比较
与健康儿童组比,①P< 0.05;与NAFLD组比,②P< 0.05

表2 三组临床生化指标水平比较
与健康儿童组比,①P< 0.05;与NAFLD组比,②P< 0.05

表3 三组血脂指标比较
与健康儿童组比,①P< 0.05;与NAFLD组比,②P< 0.05
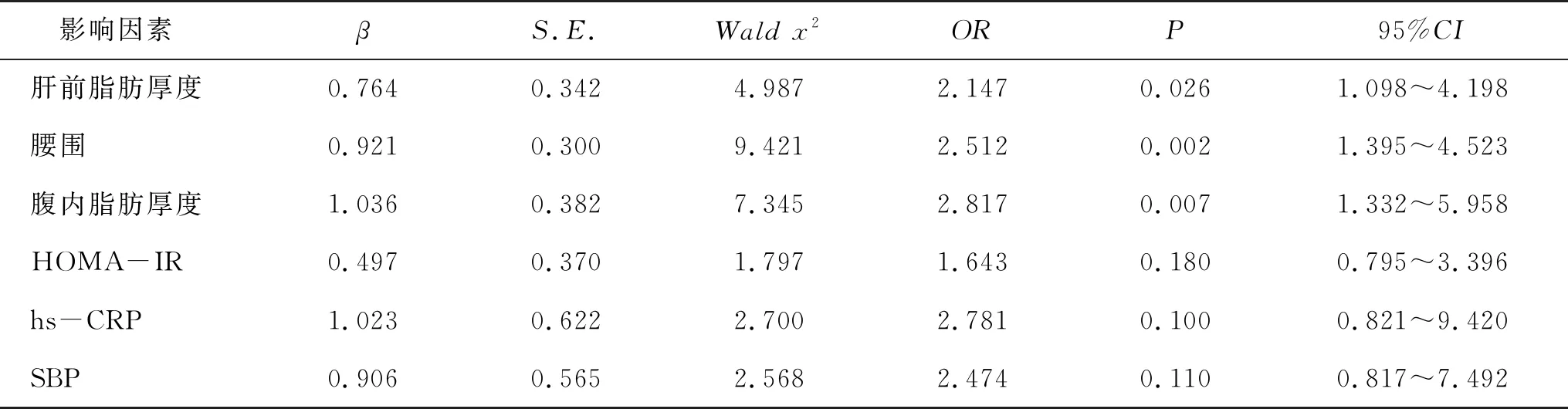
表4 影响儿童发生MS的多因素Logistic回归分析
3 讨论
近年来,随着人们生活方式的转变,儿童肥胖日益严重,儿童MS发病率也逐渐上升,成为严重的公共卫生问题。既往报道证实,肥胖可促进糖尿病、高血压和冠心病等多种疾病进展,成为MS的重要诱因[9,10]。肥胖是MS的独立危险因素,因而肥胖监测可能有助于MS的早期诊断[11]。腰围是评价中心性肥胖的关键指标,腰围较体质指数判断MS准确性更高,MS风险随腰围增加而成倍增加[12]。因而,本研究回顾性分析了445例儿童的体检资料,发现肥胖发生率为8.3%,肥胖儿童MS发生率为44.4%,与既往研究小儿肥胖及肥胖儿童MS发生率基本符合[13]。经分析腰围等临床资料,测量腰围也有助于MS的早期检出。本研究纳入人群中心性肥胖较少,男女性别间也可能存在差异。腰围受皮下脂肪的影响,可能降低了其评估腹腔内脂肪厚度的准确性。
MS的发生与脂质代谢关系密切。随着腹腔脂质堆积,细胞代谢率增加,对交感神经系统敏感性随之增加,进而促进脂肪因子和游离脂肪酸的分泌[14],最终导致MS的发生。相关研究明确指出MS与NAFLD互为因果,相互促进[15]。腹内脏器脂肪神经血流分布丰富,细胞代谢活跃,可分泌脂肪因子和游离脂肪酸,加快MS的发生发展[16]。因而腹内脂肪厚度对于评估MS具有较高的价值。对于MS患儿,尤其是合并脂肪肝的肥胖患儿,超声检查可能影响清晰显像,且检查易受肠腔胀气的干扰,降低测量的准确性。超声检测肝前脂肪厚度具有可重复性,操作性强,且与常规超声比较,该检测可避免体内气体和压力的干扰。肝前脂肪厚度可客观地反映腹内脂肪厚度[17],肝前脂肪厚度与腹腔内脂肪厚度具有显著的相关性,因而检测肝前脂肪厚度可以作为腹内脂肪厚度的替代检测指标,成为诊断MS的依据[18]。
为进一步分析肝前脂肪厚度在MS诊断中价值,本研究对比分析了健康儿童、NAFLD儿童与MS患儿脂质代谢相关指标的变化,并进行Logistic多因素回归分析,结果显示肝前脂肪厚度、腰围和腹内脂肪厚度是MS的高危因素。肝前脂肪厚度较腹内脂肪厚度检测更简便实用,易于在基层医院推广。肝前脂肪厚度与颈动脉内膜厚度、内脏脂肪厚度等多因素有关[19],其在NAFLD诊断中的应用还有待于今后进一步深入研究。本研究调查了MS患儿肝前脂肪厚度和腰围的变化,其结果与有关研究结论[20]类似,为NAFLD的诊断提供了补充依据。
综上所述,NAFLD,尤其是MS患儿肝前脂肪厚度和腰围发生了明显的变化,借助超声检查,可无创地评估病情,对早期临床诊断和及时处理,提供了方便的诊断指标。

