IDO/TTS 比值在RA 排除及病情评估中的价值
周福江,伍成斌,高守霞,徐 超,钱文楹,黄秋兰
(上海市嘉定区南翔医院检验科,上海 201802)
目前,类风湿性关节炎(rheumatoid arthritis,RA)的发病机制尚不明确,其治疗方法多采用免疫抑制治疗和抗炎治疗,但仅能延缓病情的发展。吲哚胺2,3双加氧酶(indoleamine 2,3-dioxygenase,IDO)为色氨酸(tryptophan,Trp)代谢中重要的酶,在人和动物的许多组织中均正常表达,但易受细菌、病毒感染带来的致炎因子诱导。当IDO表达升高时,可生成犬尿氨酸(kynurenine,Kyn)等促凋亡因子,抑制免疫细胞的增殖,诱导免疫耐受状态[1]。色胺酰-tRNA合成酶(tryptophanyltRNA-synthetase,TTS )可拮抗IDO对色氨酸的消耗,通过含色氨酸蛋白的合成而维持细胞的生存和分裂[2]。因此,IDO与TTS可能共同调节细胞内色氨酸的代谢和免疫反应。为此,本研究拟探讨IDO、TTS在RA中的临床价值,以期能为RA的预防和治疗提供参考。
1 材料和方法
1.1 研究对象
选取2017年1月—2018年12月上海市嘉定区南翔医院收治的88例RA患者,其中男46例、女性42例,年龄18~69岁,诊断均符合2010年美国风湿病协会/欧洲抗风湿病联盟制定的RA诊断标准[3]。纳入标准:(1)年龄≥18周岁;(2)脾脏轻度肿大或不肿大。排除标准:(1)合并严重的糖尿病、高血压;(2)合并其他自身免疫性疾病或慢性感染性疾病;(3)采样前1个月内有糖皮质激素或免疫抑制剂治疗史;(4)各项检测指标不完整;(5)患有严重的精神疾病。根据改良疾病活动指数28(disease activity score 28,DAS28)评分[4]将RA患者分为低活动度组(35例,DAS28≤3.2分)、中活动度组(42例,DAS28为>3.2分~≤5.1分)和高活动度组(11例,DAS28>5.1分)。参照PREVOO等[5]的方法计算DAS28评分。选取同期上海市嘉定区南翔医院体检健康者88名(正常对照组),其中男50名、女38名,年龄18~65岁。
1.2 样本采集
采用肝素抗凝管和乙二胺四乙酸抗凝管分别采集所有对象静脉血4 mL,以600×g离心10 min,吸取上层血浆,-80℃保存待测。含血细胞的沉淀用于流式细胞术和荧光定量逆转录-聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)检测,24 h内完成检测。
1.3 高效液相色谱法检测血浆Kyn、Trp水平
1.3.1 仪器和试剂 Agilent1100高效液相色谱仪购自美国Agilent公司,乙腈(色谱纯)购自美国天地公司,Kyn和Trp 标准品购自美国Sigma-Aldrich公司(货号分别为K3750、T8941),其余试剂均为国产分析纯。
1.3.2 样本预处理 取400 μL血浆,用400 μL 0.05 mol/L磷酸钾缓冲液(pH值6)对倍稀释,加入2 mol/L三氯乙酸100 μL沉淀蛋白,涡旋混匀1 min,静置10 min,4℃ 15000×g离心10 min,沉淀血浆蛋白,取上清300 μL进样分析。
1.3.3 色谱条件 Agilent Hypersil RP-C18色谱柱(125.0 mm×4.6 mm,5 μm),流动相为0.015 mol/L磷酸钾溶液(pH值6.4)∶乙腈=95∶5(V/V),流速为0.5 mL/min,柱温为25℃;在波长为350 nm的紫外光处检测Kyn水平,在激发波长为284 nm和365 nm处测定Trp水平,计算Kyn/Trp比值。
1.4 流式细胞术检测淋巴细胞内IDO和TTS的表达
1.4.1 仪器和试剂 FACSCalibur流式细胞仪购自美国BD公司。异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的小鼠抗人CD45抗体(FITC-CD45)、别藻蓝蛋白(allophycocyanin,APC)标记的小鼠抗人IDO抗体(APC-IDO)、藻红蛋白(phycoerythrin,PE)标记的兔抗人TTS抗体(PE-TTS)、PE标记的驴抗兔IgG抗体(PE-IgG)、APC标记的小鼠IgG1同型对照、APC标记的兔IgG1同型对照、固定/破膜剂(Fixation/Permeabilization Solution Kit)和流式染色缓冲液(Flow Cytometry Staining Buffer)均购自美国BD公司。Ficoll淋巴细胞分离液购自天津市灏洋生物制品科技有限责任公司。
1.4.2 流式细胞术分析 首先建立流式细胞术IDO/TTS检测模板。取肝素抗凝血样本4 mL,分离出外周血单个核细胞(peripheral blood mononuclear cell,PBMC)后,将PBMC浓度调整为1×106个/mL,用吸管吹打混匀至单细胞悬液。取100 μL细胞悬液,加入10 μL FITCCD45,4℃避光染色30 min。用2 mL预冷的染色缓冲液200×g离心洗涤5 min,弃上清,旋涡震荡重悬细胞后加入1 mL 1×固定/破膜剂,再次旋涡震荡混匀,4℃避光放置30 min,再次加入2 mL预冷的染色缓冲液,200×g离心洗涤5 min,弃上清,加入5 μL APC-IDO(1∶100稀释)和10 μL PE-TTS(1∶100稀释),4℃避光染色30 min,加入2 mL预冷的染色缓冲液,200×g离心洗涤5 min,弃上清。在检测管中加入5 μL PEIgG,4℃避光染色30 min,加入2 mL预冷的染色缓冲液,200×g离心洗涤5 min,弃上清,每管中加入200 μL磷酸盐缓冲液后,上机检测。采用CellQuest软件(美国BD公司)分析,调整前向及侧向角,圈出CD45+细胞,定义为淋巴细胞群,从中获取10000个细胞,检测TTS及IDO荧光强度。
1.5 采用荧光定量RT-PCR测定PBMC中IDO mRNA和TTS mRNA的表达
1.5.1 仪器和试剂 LightCycler 480实时荧光定量PCR系统购自瑞士罗氏公司,SYBR PrimeScrip RT-PCR Kit Ⅱ(货号为DRR083S)购自日本TaKaRa公司,Trizol试剂(货号为15596-026)购自美国Invitrogen公司。
1.5.2 荧光定量RT-PCR检测 采用Ficoll淋巴细胞分离液分离PBMC,抽提新鲜分离PBMC中的mRNA,逆转录成互补DNA(complementary DNA,cDNA)。采用荧光定量聚合酶链反应检测IDOmRNA、TTSmRNA的表达,计算IDOmRNA/TTSmRNA比值。(1)引物设计和合成:在Genbank中查找IDO和TTS的mRNA已知序列,并用BLAST软件在Genbank中设计IDO和TTS的特异性引物序列,同时设计内参照基因β-actin的引物序列,引物由美国Invitrogen公司合成,序列见表1。(2)PCR反应条件:95℃5 min;95℃ 15 s,55℃ 15 s,72℃ 35 s,40个循环,温度转换率为20℃/s;扩增循环结束后进行熔点曲线检测(45~90℃,升温速度0.2℃/s,连续检测荧光)。(3)计算相对表达量:扩增结束后,采用配套软件进行检测和分析,采用2-ΔΔCt法计算IDOmRNA和TTSmRNA的相对表达量,并计算IDOmRNA/TTSmRNA比值。

表1 引物序列
1.6 统计学方法
采用SPSS 20.0软件进行统计分析。呈正态分布的数据以表示,组间比较采用t检验,多组间比较采用方差分析。趋势检验采用Cochran Armitage趋势检验(对应的计量资料按总均值转化成两分类资料)。采用受试者工作特征(receiver operating characteristic,ROC)曲线评估IDO/TTS比值在排除RA中的价值和在RA病情评估中的价值。以P<0.05为差异有统计学意义。
2 结果
2.1 RA组与正常对照组血浆Kyn、Trp水平和Kyn/Trp比值的比较
RA组血浆Kyn、Trp水平均高于正常对照组(P=0.000),Kyn/Trp比值低于正常对照组(P=0.000)。见表2。
表2 RA组与正常对照组血浆Kyn、Trp水平和Kyn/Trp比值的比较
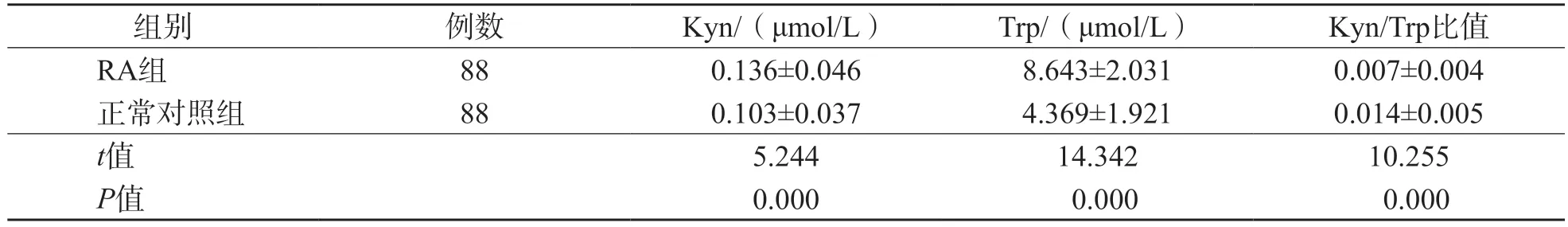
表2 RA组与正常对照组血浆Kyn、Trp水平和Kyn/Trp比值的比较
2.2 RA组与正常对照组淋巴细胞中IDO、TTS、IDO/TTS比值的比较
RA组淋巴细胞中TTS表达高于正常对照组(P=0.000),IDO和IDO/TTS比值均低于正常对照组(P=0.000)。见表3、图1、图2。
2.3 RA组与正常对照组IDO mRNA、TTS mRNA的相对表达量及IDO mRNA/TTS mRNA比值的比较
RA组TTSmRNA相对表达量高于正常对照组(P=0.000),IDOmRNA相对表达量和IDOmRNA/TTSmRNA比值均低于正常对照组(P=0.000)。见表4。
2.4 不同疾病活动度各组IDO/TTS比值的比较
低活动度组、中活动度组及高活动度组之间IDO/TTS比值依次降低,各组间差异均有统计学意义(P<0.05)。见表5。
表3 RA组与正常对照组淋巴细胞IDO、TTS、IDO/TTS比值比较

表3 RA组与正常对照组淋巴细胞IDO、TTS、IDO/TTS比值比较

图1 正常对照者淋巴细胞IDO和TTS的表达

图2 RA患者淋巴细胞IDO和TTS的表达
表4 RA组与正常对照组IDO mRNA、TTS mRNA的相对表达量及IDO mRNA/TTS mRNA比值的比较
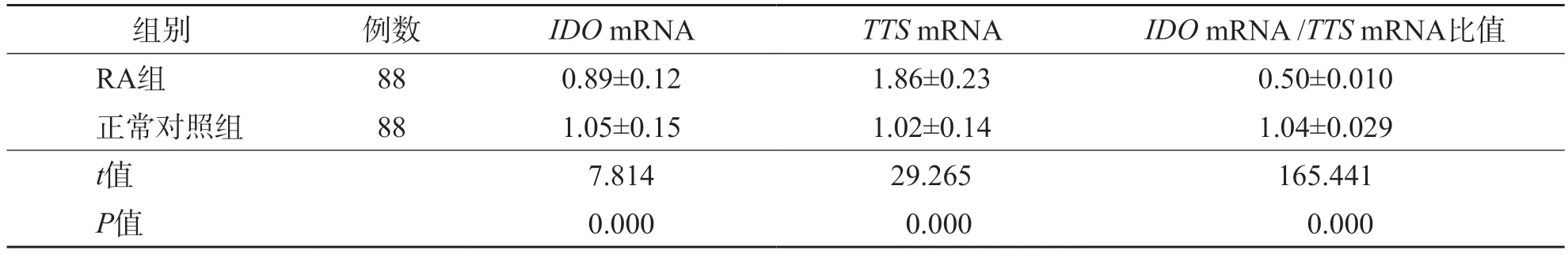
表4 RA组与正常对照组IDO mRNA、TTS mRNA的相对表达量及IDO mRNA/TTS mRNA比值的比较
表5 不同疾病活动度各组IDO/TTS比值的比较
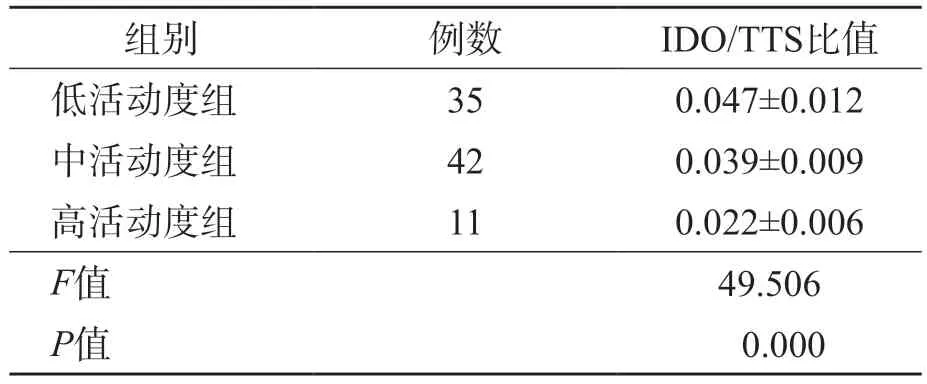
表5 不同疾病活动度各组IDO/TTS比值的比较
注:趋势检验前将IDO/TTS比值数据按总体均值0.037进行两分类转化,即1≥0.0370=否,趋势检验结果显示差异有统计学意义(Armitage χ2=7.632,P=0.022)
2.5 IDO/TTS比值在排除RA中的价值及对RA病情严重程度的判断价值
以RA组为阳性样本,正常对照组为阴性样本,将IDO/TTS比值数据划分成8个组段,建立排除RA模型的ROC曲线。结果显示,IDO/TTS比值排除RA的曲线下面积(area under curve,AUC)为0.841,最佳临界值为0.080(即IDO/TTS比值>0.080,可排除RA),敏感性为84.2%,特异性为81.6%,阴性预测值为0.838,阳性预测值为0.821,Youden指数为0.658。见图3。

图3 IDO/TTS比值排除RA的ROC曲线
因RA组中高活动度患者较少,故将病情严重程度分为2组:以高、中活动度患者为严重/阳性样本(53例),以低活动度患者为非严重/阴性样本(35例),将IDO/TTS比值数据划分成8个组段,建立病情评估模型的ROC曲线。结果显示,IDO/TTS比值判断RA病情严重程度的AUC为0.734,最佳临界值为0.042(即IDO/TTS比值>0.042,RA病情更严重),敏感性为72.1%,特异性为70.7%,阴性预测值为0.626,阳性预测值为0.788,Youden指数为0.428。见图4。
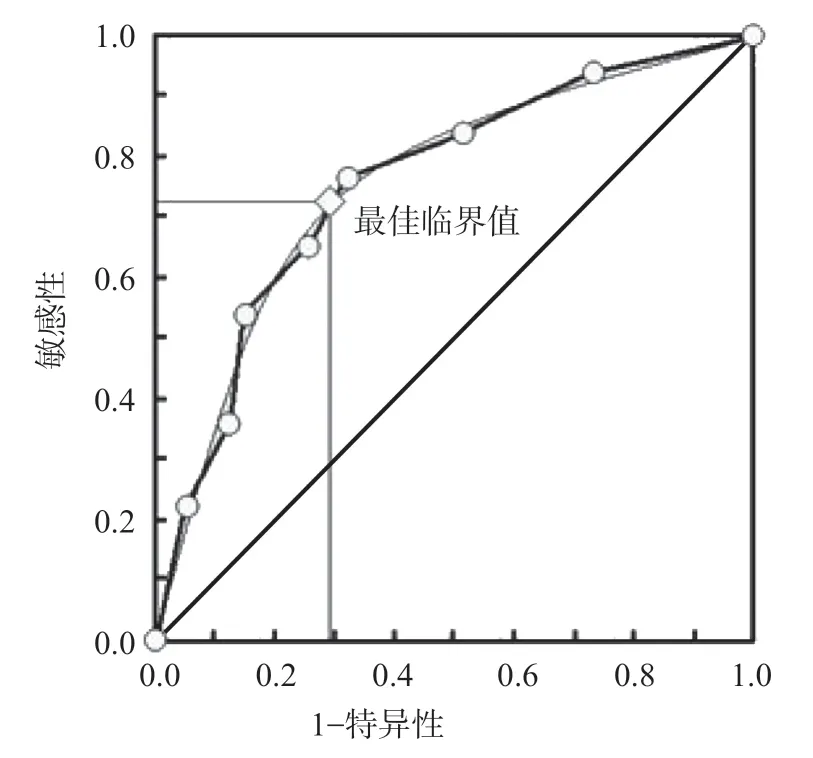
图4 IDO/TTS比值判断RA病情严重程度的ROC曲线
3 讨论
Trp是人体必需的氨基酸,正常状态下成人每天的Trp需求量为3 mg/kg[6]。IDO为含亚铁血红素的单肽链,是Trp沿Kyn代谢的关键酶[7]。健康人体内IDO的表达率较低。当人体内IDO表达率上调和功能增强时,体内Trp代谢加速,生成大量的Kyn,抑制免疫细胞的功能,阻断T淋巴细胞的免疫应答,诱导机体产生免疫耐受[8]。RA为慢性炎症性自身免疫性疾病。有研究结果显示,RA的发生、发展与关节内免疫细胞的活化、聚集有关,可造成免疫调节失衡,进而造成组织、软骨和骨损伤[9]。为此,本研究对IDO/TTS比值在排除RA中的价值及在RA病情评估中的价值进行了探讨,以期能为RA的治疗和病情评估提供参考。
TTS可通过Trp在促进T细胞对抗IDO介导的免疫抑制过程中发挥双重保护作用,一方面可促使更多的Trp用于合成蛋白质,促进细胞增殖[10];另一方面可抑制IDO介导的代谢作用,降低毒性代谢产物的生成,从而增加RA患者体内反应型T细胞的生成与增殖[11]。Trp经TTS催化结合后,可增加细胞内Trp的储备,调节Trp的代谢过程,进而调控免疫应答[12]。IDO和TTS可参与到Trp的代谢过程中,对多种自身免疫性疾病进行调控,因此Kyn/Trp比值可用于评估IDO活性[13]。本研究结果显示,RA组血浆Kyn、Trp水平均高于正常对照组(P=0.000),Kyn/Trp比值低于正常对照组(P=0.000);RA组淋巴细胞TTS表达及TTSmRNA相对表达量均高于正常对照组(P=0.000),IDO表达量、IDO/TTS比值、IDOmRNA相对表达量及IDOmRNA/TTSmRNA比值均低于正常对照组(P=0.000)。这可能是由于IDO可促进Trp消耗,抑制细胞免疫,而TTS可与Trp结合而维持细胞免疫,TTS可拮抗IDO对Trp的代谢和消耗,如TTS表达升高可造成Trp代谢失衡,因此IDO和TTS共同参与了体内Trp的代谢,在免疫性疾病中起重要的免疫调节作用[14]。由此可见,外周血淋巴细胞中Trp代谢失调可能与RA的发生、发展有关,自身反应性免疫细胞的激活及对自身组织的持续破坏,最终会导致RA的发生和发展[15]。
本研究ROC曲线分析结果显示,IDO/TTS比值排除RA的最佳临界值为0.080(IDO/TTS比值>0.080,可排除RA),AUC、敏感性和特异性均高于0.8;判断RA病情严重程度的最佳临界值为0.042,AUC、敏感性和特异性均高于0.7。由此可见,IDO/TTS比值对RA有较好排除价值,对RA病情也有较好的评估价值。
IDO(IDOmRNA)、TTS(TTSmRNA)与IDO/TTS比值(IDOmRNA/TTSmRNA)有直接的换算关系,且IDO、TTS指标较对应的mRNA测定更为简便,因此可以考虑以淋巴细胞的IDO/TTS比值作为RA患者的病情评估指标。IDO是炎症性自身免疫性疾病的致病介质[13]。本研究结果显示,RA患者IDO表达高于正常对照者(P=0.000)。MERLO等[16]的研究结果显示,抗IDO2单抗治疗小鼠RA模型有效。提示抗IDO单抗靶向治疗RA可能是未来RA免疫治疗的潜在策略。
综上所述,RA患者外周血、T细胞内Trp代谢途径失调。IDO/TTS比值对RA有较高的排除价值,亦可用于RA病情的评估。本研究为RA的发病机制研究提供了参考,也为病情评估和寻找新的治疗策略开拓了新的思路。

