黄芩素对顺铂抑制卵巢癌A2780细胞增殖的影响
郑宁泽?陶亮?王琴


【摘要】目的 體外检测黄芩素对顺铂抑制卵巢癌A2780细胞增殖的影响及其机制。方法 选择对数生长期A2780细胞,采用CCK-8法分别检测黄芩素对A2780细胞的毒性、有黄芩素和无黄芩素作用下顺铂对A2780细胞的半数抑制浓度(IC50)差异、在细胞缝隙连接(GJ)通道功能抑制剂18-α-甘草次酸(18-α-GA)的作用下顺铂对A2780细胞抑制率的变化以及增加黄芩素对顺铂作用的影响,使用细胞接种荧光示踪法检测黄芩素对A2780细胞GJ通道功能的影响。利用GEO公共数据库,比较卵巢正常上皮组织和卵巢癌上皮组织中编码Cx43的GJA1基因表达的差异。利用蛋白免疫印迹法检测黄芩素对A2780细胞中Cx43蛋白表达的影响。利用Swiss Target Prediction 数据库预测黄芩素的靶蛋白,并构建靶蛋白与GJ通道的互作网络。结果 当黄芩素≤10.00 μmol/L,其对A2780细胞无明显毒性。与单用顺铂比较,10.00 μmol/L
黄芩素可增加顺铂对A2780细胞的抑制率(P < 0.01)。GEO公共数据库分析显示,卵巢癌上皮组织中GJA1 mRNA的表达水平低于卵巢正常上皮组织(P < 0.01);黄芩素可上调A2780细胞中Cx43蛋白表达量(P < 0.01)。18-α-GA可降低顺铂对A2780细胞的抑制率,并且能逆转黄芩素对顺铂增敏作用(P均< 0.01)。Swiss Target Prediction 数据库分析显示,黄芩素直接靶向于GJ通道中的4个蛋白。结论 黄芩素能增强顺铂对卵巢癌A2780细胞的毒性,其机制可能与增强A2780细胞的GJ通道功能有关。
【关键词】黄芩素;卵巢癌;顺铂;细胞缝隙连接
Effect of baicalein on the inhibitory role of cisplatin on the proliferation of ovarian cancer A2780 cells Zheng Ningze, Tao Liang, Wang Qin. Department of Pharmacology, Zhongshan School of Medicine, Sun Yat-sen University, Guangzhou 510080, China
Corresponding author, Wang Qin, E-mail: Wangqin6@ sysu. edu. cn
【Abstract】Objective To evaluate the effect and mechanism of baicalein on the inhibitory role of cicplatin on the proliferation of ovarian cancer A2780 cells. Methods The A2780 cells in the logarithmic growth phase were selected. The cytotoxicity of baicalein on the ovarian cancer A2780 cells was assessed by CCK-8 assay. The difference of IC50 of cisplatin in the A2780 cells treated with and without baicalein was statistically compared. After the treatment with cell gap junction (GJ) pathway inhibitor 18-α-glycyrrhetinic acid (18-α-GA), the effect of cisplatin on the inhibitory rate of A2780 cells was evaluated. The effect of baicalein treatment on the inhibitory role of cisplatin was assessed. The impact of baicalein on the function of GJ signaling pathway in the A2780 cells was evaluated by Parachute assay. Based on the GEO dataset, the expression levels of GJA1 (Cx43) genes between the normal ovarian epithelial and ovarian cancer epithelial tissues were statistically compared. The effect of baicalein on the expression of Cx43 protein in the A2780 cells was assessed by Western blot. The targeted protein of baicalein was predicted by Swiss Target Prediction database. The interaction network between the targeted proteins and GJ pathway was constructed. Results Baicalein treatment at a dose of≤10 μmol/L provoked no obvious toxicity to the A2780 cells. Compared with cisplatin alone, baicalein treatment at a dose of 10 μmol/L could significantly increase the inhibitory rate of cisplatin on the A2780 cells (P < 0.01). Administration of 18-α-GA could considerably lower the inhibitory rate of cisplatin on the A2780 cells and significantly reverse the sensitization effect of baicalein on cisplatin (both P < 0.01). GEO dataset revealed that the expression level of Cx43 mRNA in the ovarian cancer epithelial tissues was significantly lower compared with that in the normal ovarian epithelial tissues (P < 0.05). Treatment with baicalein could significantly up-regulate the expression level of Cx43 protein (P < 0.01). Swiss Target Prediction database demonstrated that baicalein directly targeted to the four proteins in the GJ pathway. Conclusion Baicalein can increase the cytotoxicity of cisplatin upon the ovarian cancer A2780 cells, probably correlated with the enhancement of the function of GJ pathway in the A2780 cells.
【Key words】Baicalein;Ovarian cancer;Cisplatin;Gap junction
卵巢癌是常见的一种恶性肿瘤,患者病死率在妇科肿瘤中居于首位。大部分卵巢癌患者在经过一线化学治疗之后,容易出现继发性耐药,导致化學治疗失败、肿瘤复发[1-2]。其中,导致卵巢癌患者出现耐药的原因是,铂类药物的使用会出现一系列的不良反应,从而限制了铂类药物在临床上的使用剂量[3]。因此,寻找提高一线化学治疗药物疗效的方法,是延长卵巢癌患者生存期的关键所在。细胞缝隙连接(GJ)是连接相邻2个细胞胞浆的一种蛋白质通道,由接合素蛋白(Cx)组成,如Cx32、Cx37、Cx43等。大多数肿瘤在发生发展过程中,GJ通道功能会明显下降;而在恢复GJ通道功能之后,肿瘤细胞的生长会受到抑制[4]。重建和增强肿瘤细胞的GJ通道功能,由GJ通道介导的“旁观者效应”能够增强辐射和抗肿瘤药物对肿瘤的杀伤作用[5-6]。抑制GJ通道功能可以减弱顺铂和紫衫醇等抗肿瘤药物的细胞毒性[7]。因此,GJ通道可增强化学治疗药物的细胞杀伤作用。既往研究表明,人卵巢癌细胞中Cx的表达和GJ通道功能是降低的[8]。因此恢复卵巢癌细胞中的GJ通道功能,对提高药物疗效具有重要意义。
黄芩素是从黄芩根部提取出来的一种单体成分,对多种肿瘤都有明显的抑制作用,包括膀胱癌、乳腺癌、宫颈癌等。其发挥抗肿瘤作用的机制多种多样,主要包括清除自由基、抑制细胞周期蛋白复合物的形成、诱导细胞凋亡等[9-11]。目前笔者尚未查及黄芩素与卵巢癌细胞中GJ通道功能关系的相关研究。为此,本研究观察顺铂联合黄芩素对卵巢癌细胞增殖能力的影响,探讨黄芩素对顺铂毒性的影响及其作用机制,现报告如下。
材料与方法
一、材 料
黄芩素购于中国食品药品检定研究院。顺铂、二甲亚砜、18α-甘草次酸(18-α-GA)、Cx抗体、微管蛋白(Tubulin)抗体购于美国Sigma-Aldrich公司。羊抗鼠二抗购于美国Jackson公司;细胞计数试剂盒-8(CCK-8)购于日本Dojindo分子科技有限公司。DMEM培养基、活细胞染料CM-Dil和Calcein-AM购于美国Invitrogen生物试剂公司。双抗、胰酶和胎牛血清购于美国Gibco公司。
二、细胞培养
卵巢癌A2780细胞来源于美国典型培养物收藏中心(ATCC),置于高糖DMEM培养基(含有10%胎牛血清和100 U/ml的双抗),在5% CO2、37℃温箱中培养。
三、细胞存活率的测定
采用CCK-8法。取对数生长期的卵巢癌A2780细胞,稀释成5×104/ml的细胞混悬液,然后以每孔0.1 ml接种至96孔板中,每组接种3个复孔,培养24 h。待细胞贴壁之后,将培养基去除。对于黄芩素的毒性测定,于孔板中加入含有黄芩素(浓度为0、0.01、0.10、1.00、10.00、50.00 μmol/L)
的培养基,分别孵育48 h和72 h;对于顺铂与黄芩素的联合实验,于孔板中先加入含10.00 μmol/L黄芩素的培养基预孵育24 h,再与含顺铂(浓度梯度为0、1.25、2.50、5.00、10.00、20.00、30.00、50.00、100.00 μg/ml)的培养基共同孵育48 h;对于回复实验,细胞先与10.00 μmol/L黄芩素预孵24 h,然后与4.00 μg/ml顺铂、25.00 μmol/L
18-α-GA和10.00 μmol/L黄芩素或其组合共同孵育48 h。吸取含药培养基,加入CCK-8溶液孵育0.5 ~ 1.0 h,最后在450 nm的波长下检测各个孔的吸光度(OD)。存活细胞比例= OD待测时点/OD0 h;抑制率= 1-(OD加药孔-OD本底)/(OD对照孔-OD本底);半数抑制浓度(IC50)使用GraphPad软件绘制生存曲线计得。每组试验至少平行重复3次,最后结果取平均值。
四、细胞接种荧光示踪法
将细胞接种至12孔板中,孵育24 h。然后加入10.00 μmol/L的黄芩素孵育48 h。在培养供体细胞的孔中加入染料Calcein-AM(能通过GJ通道传递至相邻细胞)和CM-Dil(能渗透进入细胞,但不能通过GJ通道传递),在37℃的条件下孵育30 min。将供体细胞消化下来,以500/孔接种至受体细胞所在的孔中,继续孵育4 h。最后,利用免疫荧光显微镜进行拍摄。每个供体细胞周围含有绿色荧光的细胞的数量,即为GJ通道功能的度量。
五、蛋白免疫印迹法
取对数生长期的A2780细胞,接种至6孔板中,培养24 h。去除试验组中的培养基,加入含10.00 μmol/L黄芩素的培养基,继续培养48 h。丢弃培养基,用磷酸盐缓冲液(PBS)洗3遍,加入蛋白裂解液提取总蛋白。测定蛋白浓度,取20 μg总蛋白进行SDS-PAGE电泳分离、转膜、5%脱脂奶粉封闭,然后加入抗Cx43抗体(1∶5000)4℃孵育过夜。次日加入过氧化物酶标记的羊抗鼠二抗,室温孵育1 h,然后显影,最后用Image-Pro Plus 6.0软件进行灰度分析。
六、卵巢癌相关的数据的提取和分析
为了分析Cx43 mRNA在卵巢癌组织中的表达情况,在“GEO profiles”数据库的检索框中输入“GJA1; ovarian cancer”。检索结果纳入标准为:①种属为“human”;②样本分别为正常组织和肿瘤组织;③正常卵巢组织和卵巢癌组织的临床样本均≥3例。
七、黄芩素的作用靶点与GJ通道互作网络的构建
在Pubchem数据库(https://pubchem.ncbi.nlm. nih.gov/)中检索黄芩素化合物的Canonical SMILES号,并将其导入到Swiss Target Prediction数据库(http://www.swisstargetprediction.ch/)中进行化合物作用靶点的预测,一共获得100个靶蛋白基因。在KEGG数据库中获取GJ通道的基因集,然后利用STRING数据库进行构建蛋白互作网络。将黄芩素的靶基因集和GJ通道的互作网络导入Cytoscape软件中,最后获得黄芩素的作用靶点与GJ通道之间的关系。
八、统计学处理
采用GraphPad Prism 7.0进行结果处理分析,正态分布的定量数据以表示,2组比较用t检验,多组比较采用单因素方差分析,进一步的两两比较则采用LSD-t检验。P < 0.05为差异有统计学意义。
結果
一、黄芩素对卵巢癌A2780细胞的毒性测定
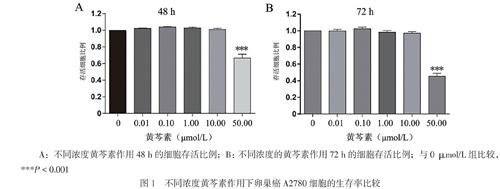
0.01 ~ 10.00 μmol/L的黄芩素对卵巢癌A2780细胞生存率无影响(P > 0.05),50.00 μmol/L的黄芩素对细胞生长有抑制作用,其存活率低于0 μmol/L(P < 0.001),见图1。当黄芩素浓度为10.00 μmol/L时,可认为对细胞生长无毒性,因此选择黄芩素10.00 μmol/L作进一步研究。
二、有黄芩素和无黄芩素作用下顺铂对卵巢癌A2780细胞的IC50比较
单用顺铂对卵巢癌A2780细胞的IC50为7.6 μg/ml;当10 .00 μmol/L黄芩素孵育卵巢癌A2780细胞24 h,再与顺铂和黄芩素的混合液共同处理48 h,卵巢癌A2780细胞对顺铂的反应性增加,黄芩素+顺铂对A2780细胞的IC50下降至4.9 μg/ml,与单用顺铂的IC50比较差异有统计学意义(P < 0.01),见图2。
三、有黄芩素和无黄芩素作用下卵巢癌A2780细胞的GJ通道功能变化
GEO数据库分析显示,与正常卵巢组织相比,卵巢癌组织中的Cx43蛋白编码基因GJA1 mRNA表达水平降低(P < 0.01),见图3A。细胞接种荧光示踪试验显示,与无黄芩素的A2780细胞相比,经过黄芩素作用48 h的A2780细胞GJ通道功能增强,见图3B。其Cx43蛋白的表达水平也随之升高(P < 0.01),见图3C。
四、黄芩素通过增强GJ通道功能增加顺铂的细胞增殖抑制作用
25.00 μmol/L 18-α-GA和4.00 μg/ml顺铂共同处理组的A2780细胞抑制率低于单用顺铂(P < 0.01);相比于单用顺铂处理,10.00 μmol/L黄芩素和顺铂的共同处理能够增加顺铂对A2780细胞抑制率(P < 0.01),而18-α-GA的加入可减弱这种增敏作用(P < 0.01),见图4。
五、黄芩素预测靶点与GJ通道的关系
利用Swiss Target Prediction数据库对黄芩素的作用靶点进行预测。在预测到的100个靶蛋白中,有4个蛋白存在于GJ通道中,分别是原癌基因酪氨酸蛋白激酶Src、丝裂原活化蛋白激酶3 (MAPK3)、表皮生长因子受体(EGFR)和周期蛋白依赖性激酶1(CDK1)。通过蛋白互作网络的构建,可以看出黄芩素直接靶向的这4个蛋白与GJA1存在直接的相互作用关系(图5),因此可推测黄芩素可通过作用于这4个靶蛋白,进而影响Cx43在细胞内的生物学效应。
讨论
铂类药物的化学治疗是卵巢癌术后的标准治疗方案,但是由于铂类药物毒性较大,限制了铂类药物单独使用的剂量[13]。特别是对于卵巢癌复发的患者,单独使用铂类药物难以达到令人满意的效果。所以目前对于卵巢癌的治疗,越来越趋向于铂类药物与其他药物的联合使用[14]。这类药物的作用机制与铂类药物的作用机制不同,比如血管生成抑制剂、多聚ADP核糖聚合酶抑制剂[15-16]。药物的联合使用,不仅降低了铂类药物的毒性,还增强了铂类药物的疗效。既往的研究表明,GJ作为连接相邻细胞胞浆的蛋白质通道,损伤的细胞所产生的死亡信号能够通过该通道传递至相邻未损伤的细胞中,从而介导了“旁观者效应”,使得一些抗肿瘤药物的疗效增加[17]。本研究显示,GJ通道功能抑制剂可减弱顺铂对卵巢癌A2780细胞的抑制作用,与以往的研究结果相一致。因此,GJ通道可以作为增加抗肿瘤药物疗效的靶点。
黄芩素是一种黄酮类化合物,研究显示其对多种肿瘤具有明显的抑制作用,而且其发挥抗肿瘤作用的机制多种多样[9, 18]。本研究也显示,黄芩素能够在对卵巢癌A2780细胞无毒性的浓度下,增加顺铂对其的抑制作用。另外,多项研究显示黄酮类药物具有增强GJ通道功能的作用,比如槲皮素能够增强肠上皮细胞的GJ通道功能[19]。山柰酚可上调结肠癌细胞中的GJ通道功能[20]。笔者团队前期的研究显示,黄芩素能够通过增强Cx32-Hela细胞的GJ通道功能,进而增加顺铂对Hela细胞的杀伤作用[12]。本研究显示,黄芩素同样也能够增强卵巢癌A2780细胞的GJ通道功能。结合前述研究结果,推测GJ通道参与了黄芩素发挥增敏作用的过程。进一步的研究使用了GJ通道抑制剂18-α-GA,结果显示18-α-GA能削弱黄芩素的增敏作用,进一步证明了黄芩素所发挥的顺铂增效作用是通过增强A2780细胞的GJ通道功能实现。
在卵巢组织中,Cx43蛋白是组成GJ通道的主要成分,并在卵巢组织的正常发育中起到重要的作用[21]。有研究显示,GJ通道功能在卵巢癌细胞中明显减弱[22]。为此,本研究利用GEO数据库比较了编码Cx43蛋白的GJA1基因在卵巢正常上皮组织和卵巢癌上皮组织中的差异。结果显示在卵巢癌上皮组织中,Cx43的表达降低。由此推测,卵巢癌组织中Cx43表达的下调导致GJ通道功能减弱,并且黄芩素增强GJ通道功能的作用可能与Cx43有关。为了验证这个推测,本研究观察了黄芩素对Cx43蛋白表达的影响,结果显示黄芩素可上调Cx43蛋白的表达。另外,我们利用网络数据库进行预测黄芩素的作用靶点,并构建黄芩素靶蛋白与GJ通道的关系。根据所得的互作网络图,可看出黄芩素直接靶向于GJ通道的4个靶蛋白,并且这4个靶蛋白与Cx43蛋白有直接的相互作用关系。
综上所述,本研究首次证明了黄芩素可通过增强卵巢癌A2780细胞中的GJ通道功能,进而增加顺铂对卵巢癌细胞的毒性。本研究结果为寻找化学治疗增效、提高抗肿瘤药物的效果以及克服肿瘤耐药的难题提供了理论基础。
參 考 文 献
[1] Sinha A, Ignatchenko V, Ignatchenko A, Mejia-Guerrero S, Kislinger T. In-depth proteomic analyses of ovarian cancer cell line exosomes reveals differential enrichment of functional categories compared to the NCI 60 proteome. Biochem Biophys Res Commun, 2014, 445(4):694-701.
[2] 高景阳, 黄淑华. 卵巢癌铂类耐药治疗的研究进展. 新医学, 2016, 47(5):299-302.
[3] Siddik ZH. Cisplatin: mode of cytotoxic action and molecular basis of resistance. Oncogene, 2003, 22(47):7265-7279.
[4] Mesnil M. Connexins and cancer. Biol Cell, 2002, 94(7-8):493-500.
[5] Sawal HA, Asghar K, Bureik M, Jalal N. Bystander signaling via oxidative metabolism. Onco Targets Ther, 2017, 10:3925-3940.,
[6] Wang L, Fu Y, Peng J, Wu D, Yu M, Xu C, Wang Q, Tao L. Simvastatin-induced up-regulation of gap junctions composed of connexin 43 sensitize Leydig tumor cells to etoposide: an involvement of PKC pathway. Toxicology, 2013,312:149-157.
[7] Wang Q, You T, Yuan D, Han X, Hong X, He B, Wang L, Tong X, Tao L, Harris AL. Cisplatin and oxaliplatin inhibit gap junctional communication by direct action and by reduction of connexin expression, thereby counteracting cytotoxic efficacy. J Pharmacol Exp Ther, 2010, 333(3):903-911.
[8] Gershon E, Plaks V, Dekel N. Gap junctions in the ovary: expression, localization and function. Mol Cell Endocrinol, 2008, 282(1-2):18-25.
[9] Liu H, Dong Y, Gao Y, Du Z, Wang Y, Cheng P, Chen A, Huang H. The fascinating effects of baicalein on cancer: a review. Int J Mol Sci, 2016, 17(10):1681.
[10] Zheng F, Wu J, Zhao S, Luo Q, Tang Q, Yang L, Li L, Wu W, Hann SS. Baicalein increases the expression and reciprocal interplay of RUNX3 and FOXO3a through crosstalk of AMPKα and MEK/ERK1/2 signaling pathways in human non-small cell lung cancer cells. J Exp Clin Cancer Res, 2015, 34(1):41.
[11] Wang YF, Xu YL, Tang ZH, Li T, Zhang LL, Chen X, Lu JH, Leung CH, Ma DL, Qiang WA, Wang YT, Lu JJ. Baicalein induces beclin 1- and extracellular signal-regulated kinase-dependent autophagy in ovarian cancer cells. Am J Chin Med, 2017, 45(1):123-136.
[12] Wang Y, Wang Q, Zhang S, Zhang Y, Tao L. Baicalein increases the cytotoxicity of cisplatin by enhancing gap junction intercellular communication. Mol Med Rep, 2014, 10(1):515-521.
[13] Bookman MA, Brady MF, McGuire WP, Harper PG, Alberts DS, Friedlander M, Colombo N, Fowler JM, Argenta PA, De Geest K, Mutch DG, Burger RA, Swart AM, Trimble EL, Accario-Winslow C, Roth LM. Evaluation of new platinum-based treatment regimens in advanced-stage ovarian cancer: a Phase Ⅲ Trial of the Gynecologic Cancer Intergroup. J Clin Oncol, 2009, 27(9):1419-1425.
[14] Mullen MM, Kuroki LM, Thaker PH. Novel treatment options in platinum-sensitive recurrent ovarian cancer: a review. Gynecol Oncol, 2019, 152(2):416-425.
[15] Schmitt J, Matei D. Targeting angiogenesis in ovarian cancer. Cancer Treat Rev, 2012, 38(4):272-283.
[16] De Lorenzo SB, Patel AG, Hurley RM, Kaufmann SH. The elephant and the blind men: making sense of PARP inhibitors in homologous recombination deficient tumor cells. Front Oncol, 2013, 3:228.
[17] Liu Z, Wang Q, Fan L, Wu DP, Zhang Y, Liu L, Tao L. Gap junction enhances phototoxicity of photodynamic therapy agent 2-[1-hexyloxyethyl]-2-devinylpyropheophorbide-a (HPPH). Lasers Surg Med, 2015, 47(1):68-76.
[18] Ma Z, Otsuyama K, Liu S, Abroun S, Ishikawa H, Tsuyama N, Obata M, Li FJ, Zheng X, Maki Y, Miyamoto K, Kawano MM. Baicalein, a component of Scutellaria radix from Huang-Lian-Jie-Du-Tang (HLJDT), leads to suppression of proliferation and induction of apoptosis in human myeloma cells. Blood, 2005, 105(8):3312-3318.
[19] Chaumontet C, Droumaguet C, Bex V, Heberden C, Gaillard-Sanchez I, Martel P. Flavonoids (apigenin, tangeretin) counteract tumor promoter-induced inhibition of intercellular communication of rat liver epithelial cells. Cancer Lett, 1997, 114(1-2):207-210.
[20] Nakamura Y, Chang CC, Mori T, Sato K, Ohtsuki K, Upham BL, Trosko JE. Augmentation of differentiation and gap junction function by kaempferol in partially differentiated colon cancer cells. Carcinogenesis, 2005, 26(3):665-671.
[21] Wang HX, Tong D, El-Gehani F, Tekpetey FR, Kidder GM. Connexin expression and gap junctional coupling in human cumulus cells: contribution to embryo quality. J Cell Mol Med, 2009, 13(5):972-984.
[22] Gershon E, Plaks V, Dekel N. Gap junctions in the ovary: expression, localization and function. Mol Cell Endocrinol, 2008, 282(1-2):18-25.
(收稿日期:2019-12-20)
(本文編辑:林燕薇)

