基于生物质催化剂的空气氧化法制备焦锑酸钠
钱福军,薛敏华*,浮建军,莫友彬,曹家兴
(1.广西大学化学化工学院,广西 南宁 530004;2.广西化工研究院,广西 南宁 530001)
中国是全球锑资源最为丰富的国家,美国调查局(地质)2014年发布世界锑资源调查数据表明:截止2013年已探明全球锑资源储量为180万t,中国锑资源储量约占全球总储量的52%[1];湖南、广西两省的锑矿储量分别位居全国第一和第二[2]。焦锑酸钠(NaSb(OH)6)是锑矿深加工重要产品之一,它在化纤、树脂、塑料的阻燃剂与显像管、光学用玻璃等高级玻璃澄清剂等方面有着广泛的应用[3]。
随着高品位锑资源利用消耗,其储量日趋减少,品位低、成分复杂的锑矿资源利用的比重逐步上升[4,5]。应对锑矿资源品位的变化,在湿式制备焦锑酸钠的方法[6-9]中,空气氧化法是一种有效的方法,该法过程如下:首先,在浸出阶段利用Na2S与NaOH的混合液对锑矿进行选择性浸出硫代亚锑酸钠(Na3SbS3,简称Sb(III)),即获得制备焦锑酸钠的前驱体,反应式如(1)所示;然后,在氧化阶段采用绿色氧化剂空气氧化Sb(III)制备焦锑酸钠,反应式如(2)所示。
空气氧化法既可处理单一锑精矿,也可处理多金属复杂硫化锑矿或它们的混合物。该法在浸出阶段很好利用Na2S实现多金属复杂硫化锑矿中锑元素与其它金属元素的分离,这也为碱法脱硫后的硫化物利用拓展了新的途径;氧化阶段对锑矿浸出的前驱体Sb(III)直接氧化生成焦锑酸钠沉淀,工艺上省去了其它湿法所得浸出液需除杂的中间环节,这简化了生产工艺流程、降低生产成本[10]。游离的Na2S也被空气氧化,溶液中的硫大部分转化成硫代硫酸钠,部分转化为亚硫酸钠和硫酸钠[11],该法耗时70h[12]。
Vogt[13]、唐建军[14]提出:铜与对苯二酚组合催化剂催化空气氧化Sb(III)溶液制备焦锑酸钠,氧化反应时间有所缩短,但反应结束时催化剂中的重金属盐会有部分掺杂于产物中,影响产品纯度;此外,对苯二酚有一定的毒性,该法产生含重金属与苯酚类的工业废水,处理不当易造成水体环境污染。张杜超,杨天足[15,16]采用加压氧气氧化Sb(III)溶液制备焦锑酸钠,虽保证了产品的纯度,但加压氧气的氧化工艺存在成本高、生产操作危险性大的问题。
本文采用与环境友好、无毒且廉价的生物质基催化剂,用于催化空气氧化Sb(III)溶液制备焦锑酸钠,以顺应当今绿色化学的发展趋势[17]。栲胶作为一类天然多酚化合物符合这一要求[18],在碱性条件下,其多酚的化学结构使其容易被氧化成相应的醌态又易于还原成原来的酚态[19],且栲胶独有的大分子结构,为焦锑酸钠的结晶提供更多的位点[20]。利用栲胶这些独特性质,以期制备超细化的焦锑酸钠产物。
1 实验部分
1.1 仪器及试剂
设有气体分布器的1 L三颈烧杯;83-5空气压缩机;DF-101S集热式恒温加热磁力搅拌器;SU-8020场发式扫描电子显微镜;BRUCKER D8 X-射线衍射仪;Nicolet IS10红外光谱仪;Shimadzu-LC-20A凝胶色谱仪。实验所用Na2S、NaOH、Se(SO4)2、Sb2S3、硫酸肼等试剂均为分析纯,氧化栲胶(简称TEOS)购自广西化工研究院,工业级。
1.2 焦锑酸钠的制备与表征分析
首先,配制含一定浓度Na2S、0.8mol/L NaOH的溶液(简称Na2S碱液),称取定量的硫化锑加入到一定体积量的Na2S碱液中进行浸出,浸出初始时液相中硫化锑与Na2S的量应符合(1)式化学计量比;其次,在浸出后所得的前驱体Sb(III)溶液中加入一定量TEOS,一定温度与搅拌速率下向混合溶液通入空气,在常压条件下进行氧化,氧化过程中定时取样,采用硫酸铈法[21]分析溶液中Sb(III)的浓度,计算相应的Sb(III)转化率。反应结束后抽滤得固相物,经洗涤、60℃下烘干至恒重得到产物。利用扫描电子显微镜(SEM)表征产物颗粒形貌与粒径;通过X-射线衍射仪(XRD)表征产物组成与含量。焦锑酸钠制备的实验流程如图1所示。

图1 焦锑酸钠制备的实验流程简图
2 结果与讨论
2.1 栲胶催化剂的表征与分析
TEOS,经中国林业局林化产物质量检验检测中心分析,其组成分析结果如表1所示;进一步采用Nicolet IS10红外光谱仪(FT-IR)与Shimadzu-LC-20A凝胶色谱仪(GPC)对它的官能团和分子量进行表征与分析,其测试结果表明:TEOS结构中含大量的酚羟基与羧基官能团、其平均分子量为1432。
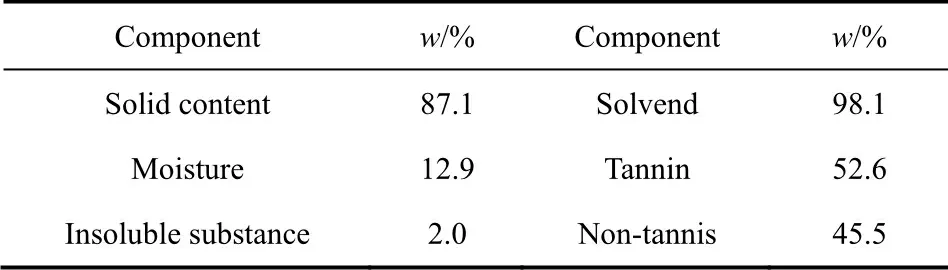
表1 TEOS的组成分析
采用单因素法分别考察温度、初始Sb(III)浓度、TEOS浓度和空气流量因素对氧化过程Sb(III)转化率的影响。
2.2 反应温度的影响
在含初始Sb(III)浓度为3.0×10-2mol/L、TEOS浓度为0.50g/L的NaOH碱液中,通入5.0L/min空气进行氧化,考察反应温度对氧化过程的Sb(III)转化率影响,结果如图2所示。
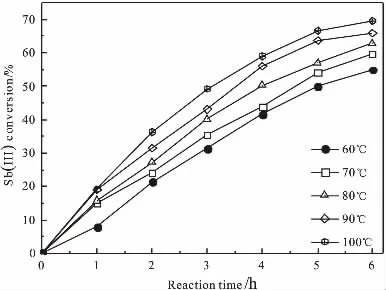
图2 反应温度对Sb(III)转化率的影响
由图2可见,在60~100℃范围内,反应时间一定时,随着反应温度提高氧化过程的Sb(III)转化率增大;当反应时间至6h时,100℃下的氧化反应Sb(III)转化率比60℃的提高了20%左右。表明反应温度的升高有利于溶液中Sb(III)的氧化生成焦锑酸钠沉淀。本实验以水为介质,选择氧化温度为90℃。
2.3 初始Sb(III)浓度的影响
反应温度90℃时,在含初始Sb(III)浓度一定、TEOS浓度为0.50g/L的NaOH碱液中,通入5.0L/min空气进行氧化,考察初始Sb(III)浓度对氧化过程的Sb(III)转化率影响,结果如图3所示。
由图3可见,初始Sb(III)浓度在1.2×10-2~3.6×10-2mol/L范围内,反应时间一定时,随着初始Sb(III)浓度增加氧化过程的Sb(III)转化率降低;当反应时间至6h时,初始Sb(III)浓度分别为1.2×10-2mol/L、1.8×10-2mol/L的氧化反应Sb(III)转化率基本相同。初始Sb(III)浓度为1.2×10-2mol/L时,随着反应时间增加Sb(III)浓度下降最快,表明初始Sb(III)浓度低有利于氧化反应进行。
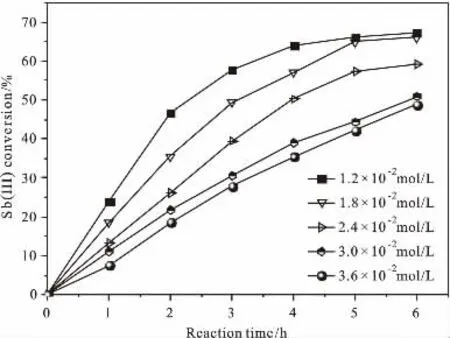
图3 初始Sb(III)浓度对Sb(III)转化率的影响
2.4 TEOS浓度的影响
反应温度90℃时,在含初始Sb(III)浓度为3.0×10-2mol/L、一定浓度TEOS的NaOH碱液中,通入5.0L/min空气进行氧化,考察0~16.0g/L范围的TEOS浓度对氧化过程Sb(III)转化率影响,结果如图4、图5所示。

图4 TEOS浓度对Sb(III)转化率的影响(0~8.0g/L)
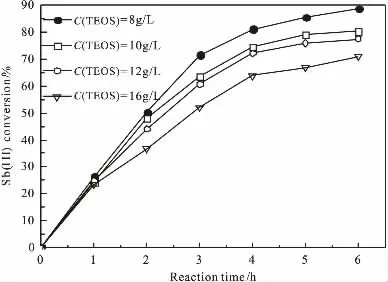
图5 TEOS浓度对Sb(III)转化率的影响(8.0~16.0g/L)
由图4、图5可见,当TEOS浓度在0~8.0g/L范围,反应时间一定时,随着TEOS浓度的增加,氧化过程的Sb(III)转化率增大;TEOS浓度在8.0~16.0g/L范围,随着TEOS浓度的增加,氧化过程的Sb(III)转化率降低,当反应时间至6h时,氧化反应Sb(III)转化率由90%降至70%左右。
这是因空气中氧气与液相进行气液传质过程中,总会伴有不同程度的界面湍流以推动气液传质的进行,假设质量传质通量J表达与传质推动力ΔC的关系[22],如式(3)所示:
式中:J—质量传质通量,kg/(m2·s);k—传质系数,m/s;ΔC—浓度差,kg/m3。
由式(3)可知,传质系数k与传质推动力ΔC共同影响质量传质通量J,对于高浓度范围8.0~16.0g/L的TEOS溶液,因TEOS在溶液中具有胶体的性质,随着TEOS浓度增大,其溶液的粘度增大,这抑制了气液传质的界面湍流,降低了传质速率,致液相溶氧量下降,则氧化反应Sb(III)转化率降低。可见,当溶液中TEOS浓度过高并不利于Sb(III)氧化生成焦锑酸钠沉淀。选择氧化过程中TEOS浓度8.0g/L为宜。
2.5 空气流速的影响
反应温度90℃时,在含初始Sb(III)浓度为3.0×10-2mol/L、TEOS浓度为0.50g/L的NaOH碱液中,通入空气进行氧化,考察0~16.0L/min空气流量对氧化过程Sb(III)转化率影响,结果如图6、图7所示。

图6 空气流量对转化率的影响(0~8L/min)

图7 空气流量对转化率的影响(8~16L/min)
由图6、图7可见,当反应不加入空气氧化时,反应至6h时Sb(Ⅲ)转化率为29.9%,表明催化剂TEOS本身存在一定的氧化性。随着空气流量的增大,氧化过程Sb(Ⅲ)转化率明显的增加,当空气流量上升至8.0L/min时,反应的Sb(III)转化率达最高值,表明增大空气流量有利于溶液中Sb(III)的氧化生成焦锑酸钠沉淀;但当空气流量在8.0~16.0L/min范围,随着空气流量的增加,氧化过程的Sb(III)转化率却降低,当反应时间至6h时,氧化反应Sb(III)转化率由约70%降至40%左右。
这因空气中氧气与液相进行气液传质过程中,增大空气流量导致气液两相界面湍流加强,气膜厚度减少,传质系数k增大,在式(3)中需考虑停留时间τ对质量传质通量J的影响[23],如式(4)所示:

式中:J-质量传质通量,kg/(m2·s);k-传质系数,m/s2;τ-停留时间,s;ΔC-浓度差,kg/m3。
由式(4)可知,增大空气流量导致传质系数k增大,质量传质通量J增大,即液相的溶氧量增加;当空气流量增大至8.0L/min以上时,气液传质的停留时间τ相应减少[24],致质量传质通量J减少,液相溶氧量下降,则氧化反应Sb(III)转化率降低。选择氧化过程中空气流量8.0L/min为宜。
2.6 产物表征与分析
基于2.2~2.5节的单因素法研究中,反应温度、初始Sb(III)浓度与TESO浓度对Sb(III)转化率的影响规律,其制备焦锑酸钠适宜氧化条件为:90℃反应 温 度、8.0L/min空 气 流 量、8.0g/L TEOS、1.2×10-2mol/L初始浓度Sb(III)的NaOH碱液。以添加单宁酸或不添加TEOS催化剂的前驱体Sb(III)氧化体系为参照,考察其适宜氧化条件下氧化过程Sb(III)转化率的变化规律,其Sb(III)转化率分别随反应时间变化结果如图8所示;对以催化剂TEOS催化空气氧化Sb(III)溶液制备焦锑酸钠所得产物进行表征与分析,其XRD与EDS表征结果分别如图9、图10所示,其相应的SEM表征结果如图11所示,图12为不添加TEOS催化剂氧化制备所得产物的SEM图。
由图8可见,当氧化进行7h时,催化剂TEOS催化空气氧化的Sb(III)转化率为98.8%,不添加TEOS的空气氧化其Sb(III)转化率为49.9%,催化剂单宁酸催化空气氧化的Sb(III)转化率为80.8%。
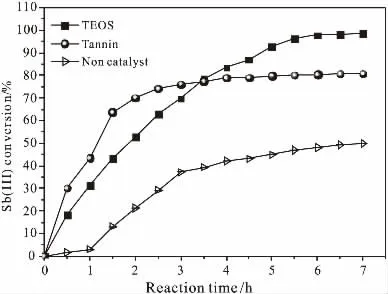
图8 氧化过程Sb(Ⅲ)转化率的变化
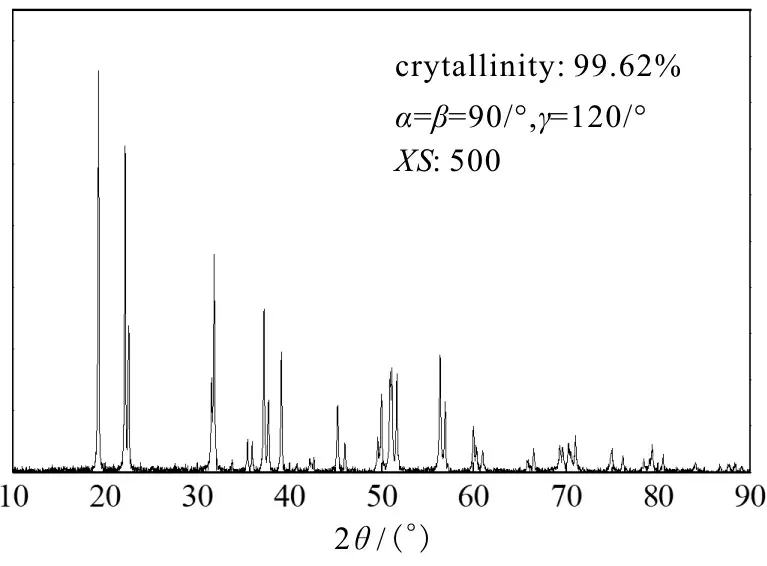
图9 产物焦锑酸钠的XRD图
由图9可见,XRD衍射特征峰结果表明:产物为六羟基锑酸钠(即焦锑酸钠,NaSb(OH)6),结晶度为99.62%;由图10可见,EDS检测结果表明:产物中杂质S元素质量分数仅为0.23%,由于采用生物质基的TEOS为催化剂,故产物中并未含其他金属杂质,产物质量符合锑行业标准[25,26]。因此,综合图8~图10的分析结果可知:以TEOS为催化剂,催化空气氧化Sb(III)溶液制备焦锑酸钠是一种有效的方法。
由图11可见,产物焦锑酸钠微粒的形貌呈米粒状,均一性与分散性良好,微粒粒径约100nm;无催化剂的空气氧化制备焦锑酸钠的产物SEM结果如图12所示,均一度较差且颗粒粒径达15μm。Gök等[27]采用对苯二酚为催化剂,催化空气氧化Sb(III)溶液制备的产物焦锑酸钠粒径50μm的球状颗粒,产物中存在其他锑氧化物的杂质;杨天足等[28]利用加压空气氧化技术,无催化的条件下制备的产物焦锑酸钠粒径为70~90μm,其颗粒形貌呈块状。当产物焦锑酸钠应用于阻燃添加剂与澄清剂[29]时,焦锑酸钠的粒径影响较大;超细化的颗粒,不仅可增强界面的相互作用,使其更均匀地分散,起到刚性粒子增塑增强的作用,极大改善材料的抗冲击性能和阻燃性能,而且颗粒表面积增大,其用量减少[30]。本文采用TEOS为催化剂,催化空气氧化制备出平均粒径为100nm且均一的焦锑酸钠颗粒,有利于产物的后续应用。

图10 产物焦锑酸钠的EDS图

图11 TEOS催化时产物焦锑酸钠SEM图

图12 无催化剂时产物焦锑酸钠SEM图
3 结论
(1)以生物质基TEOS为催化剂,催化空气氧化Sb(III)溶液制备超细焦锑酸钠是一种有效的方法。
(2)在反应温度60~100℃范围内,随着温度升高、3.6×10-2~1.2×10-2mol/L范围内随着初始Sb(III)浓度降低均有利于提高氧化过程的Sb(III)转化为产物焦锑酸钠的转化率。
(3)在TEOS浓度0~16.0g/L、空气流量0~16.0L/min范围内,两者对氧化过程的Sb(III)转化率影响的曲线存在拐点,前者的拐点为8.0g/L、后者的为8.0L/min。当TEOS浓度低于8.0g/L时,增大TEOS浓度可显著Sb(III)转化率提高;当TEOS浓度高于8.0g/L时,增大TEOS浓度则Sb(III)转化率下降。当空气流量低于8.0L/min时,增大空气流量则Sb(III)转化率提高;当空气流量高于8.0L/min,增大空气流量则Sb(III)转化率下降。
(4)基于单因素法研究获得的适宜氧化条件为:90℃温度、1.2×10-2mol/L初始Sb(III)浓度、8.0g/L TEOS浓度和8.0L/min空气流量,反应6.0h时Sb(III)的转化率为97.8%;对其产物采用XRD、EDS、SEM进行表征分析的结果表明:产物为NaSb(OH)6(即焦锑酸钠)、其结晶度为99.62%,产物中S元素杂质质量分数低至0.23%;产物微粒的粒径约为100nm,其形貌呈米粒状。

