豌豆低聚肽硒螯合物的体外抗氧化作用
秦修远 陆 路 崔欣悦 王雨辰 谷瑞增 鲁 军 刘文颖
(中国食品发酵工业研究院有限公司 北京市蛋白功能肽工程技术研究中心 北京100015)
中国自古以来就有食用豌豆的记载,其蛋白质含量非常丰富,有报道称豌豆已发展成为加拿大西部地区主要蛋白质作物[1]。近年来,大量的文献报道了豌豆蛋白多肽的性质,如张敏佳等[2]指出豌豆多肽能够缓解环磷酰胺导致的小鼠免疫低下。Temitola[3]在豌豆多肽中发现了具有α-淀粉酶活性的部分,有望成为肥胖及II 型糖尿病患者热量摄入管理的功能营养食品原料。
硒是一种人体必需的微量元素。人类生活土壤中缺乏硒可导致当地生活人群体内缺硒[4-5],而缺硒的直接后果是影响由硒蛋白参与的代谢过程。据报道,缺硒可能引起大骨节病、克山病等[6]。相比无机硒,有机硒毒性小且生物利用率高,能够更有效地在生物机体内同化[7]。研究者通常以螯合修饰等手段将无机硒转化成有机硒,以期制备出食用的补硒产品[8]。
豌豆低聚肽硒螯合物是将豌豆低聚肽与亚硒酸钠通过一定的工艺螯合而成。本文分析豌豆低聚肽硒螯合物的基础理化成分,以DPPH 和OH自由基清除和Fe3+还原能力为指标,评价豌豆低聚肽硒螯合物的抗氧化活性,旨在进一步拓宽豆科植物在功能食品领域的应用,同时也为一种补硒型的抗氧化剂的开发提供理论支持。
1 材料和方法
1.1 材料与设备
豌豆低聚肽,由北京中食海氏生物科技有限公司提供;亚硒酸钠(Na2SeO3)、磷酸氢二钠(Na2HPO4)、磷酸二氢钠(NaH2PO4)、水杨酸(C7H6O3)、硫酸亚铁(FeSO4)、抗坏血酸(VC)、氯化铁(FeCl3)、氢氧化钠(NaOH)、无水乙醇(C2H6O)、30%过氧化氢(30%H2O2),分析纯级,北京化工厂;2,2-二苯基-1-苦味肼基自由基(DPPH),色谱纯级,Biotopped;铁氰化钾(K3[Fe(CN)6])、三氯乙酸(C2HCl3O2),分析纯级,天津市福晨化学试剂厂;三氟乙酸(TFA),分析纯级,Alfa Aesar 公司;乙腈(C2H3N),色谱纯级,Fisher 公司;去离子水,Milli Q 制得。
J-HH-6A 精密数显恒温水浴锅,冠森生物科技(上海)有限公司;GT-S 超声波振荡器,广东固特超声股份有限公司;HS-DHG-9203A 卧式鼓风干燥箱,上海和晟仪器科技有限公司;PHS-2C精密酸度计,冠森生物科技(上海)有限公司;Mr酶标仪,Dynex Spectra;F30200150 凯氏定氮仪,Velp Scientifica 公司;LC-20AD 型高效液相色谱仪,日本岛津公司。
1.2 试验方法
1.2.1 豌豆低聚肽硒螯合物的制备 取豌豆低聚肽5 g 溶于100 mL 去离子水中,充分搅拌混匀,加入2.5 g 亚硒酸钠,使豌豆低聚肽与亚硒酸钠的质量比为2∶1。将混合物以超声波振荡器充分振荡均匀,以1 mol/L NaOH 溶液调节混合溶液至pH 9.0,在80 ℃恒温水浴中孵育30 min,然后全部倒在4 倍体积的无水乙醇中,经12 h 静置沉淀,倒出上清液。将沉淀放在30 ℃鼓风干燥箱中,干燥成粉,得到豌豆低聚肽硒螯合物。
1.2.2 螯合物得率计算公式
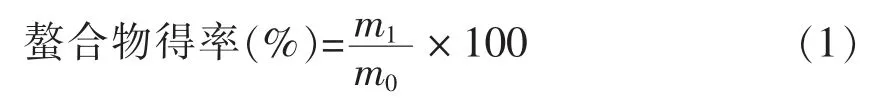
式中,m1——螯合产物的质量;m0——加入螯合体系总物质的质量。
1.2.3 理化成分分析方法 参照GB 5009.5-2016、GB 22729-2008、GB 5009.3-2016[9-11],分别对豌豆低聚肽硒螯合物的总氮(蛋白质)、酸溶蛋白、水分含量进行检测。采用参照文献[12]所述方法测定样品的分子质量。
1.2.4 清除DPPH 自由基能力测定 将检测物质与0.1 mol/L DPPH-无水乙醇溶液以1 ∶1 的体积比混合,避光保存30 min,于紫外-可见光谱波长517 nm 处测量混合液的吸光值(OD),记为A1。相应的,将DPPH-无水乙醇溶液替换为无水乙醇溶液,以同样方式操作得到OD 值记为A10。将样品替换为去离子水,以同样方式操作得到OD 值记为A0。每组试验重复3 次,取平均值并求标准差。以亚硒酸钠和豌豆低聚肽作为组间对照,以VC作为阳性对照,根据式(2)计算豌豆低聚肽硒螯合物DPPH 自由基清除率。

1.2.5 清除OH 自由基能力测定 将检测物质与5 mol/L FeSO4、5 mol/L 水杨酸-无水乙醇溶液以体积比1∶2∶2 混匀,以1 体积的5 mol/L H2O2溶液启动反应,在37 ℃水浴中反应1 h,于紫外-可见光谱波长510 nm 处测量OD 值,记为A2。相应的,以去离子水代替5 mol/L H2O2溶液,以同样方式操作得到OD 值记为A20。以去离子水代替样品溶液,以同样方式操作得到OD 值记为A02。每组试验重复3 次,取平均值并求标准差。以亚硒酸钠和豌豆低聚肽作为组间对照,以VC 作为阳性对照,根据式(3)计算豌豆低聚肽硒螯合物OH 自由基清除率。

1.2.6 还原能力测定 将检测物质与0.2 mol/L磷酸盐缓冲液(pH 6.6)、质量分数为1%的K3[Fe(CN)6]溶液以体积比1∶1∶1 混合均匀,于50℃水浴中保存10 min 后,迅速用冷水冷却。加入1体积比例、质量分数为10%的三氯乙酸溶液,迅速避光充分摇匀,从中取出1 体积比例的反应混合物,加入1 体积比例的去离子水和0.2 体积比例、质量分数为0.1%的FeCl3溶液,充分避光摇匀,静置10 min,于波长700 nm 处测量OD 值。以亚硒酸钠和豌豆低聚肽作为组间对照,以VC 作为阳性对照,以得到的OD 值作为样品还原能力参数。每组试验重复3 次,取平均值并求标准差。
2 结果与讨论
2.1 豌豆低聚肽硒螯合物基础理化成分
根据方法1.2.1 节制得的豌豆肽硒螯合物得率为27.87%,总氮(粗蛋白)含量为(23.87 ±0.30)%,酸溶蛋白含量为(23.22±0.12)%,则酸溶蛋白占总氮(粗蛋白)的比例为97.28%,水分含量为(14.17±1.12%)。豌豆低聚肽硒螯合物平均分子质量分布情况如图1所示。豌豆低聚肽硒螯合物中有93.45%的分子质量分布在1 000 u 之下。研究发现[13-14],此类小分子肽易消化吸收,具有大分子蛋白质所没有的一些物理、化学特性及生理活性。
2.2 豌豆低聚肽硒螯合物清除DPPH 自由基
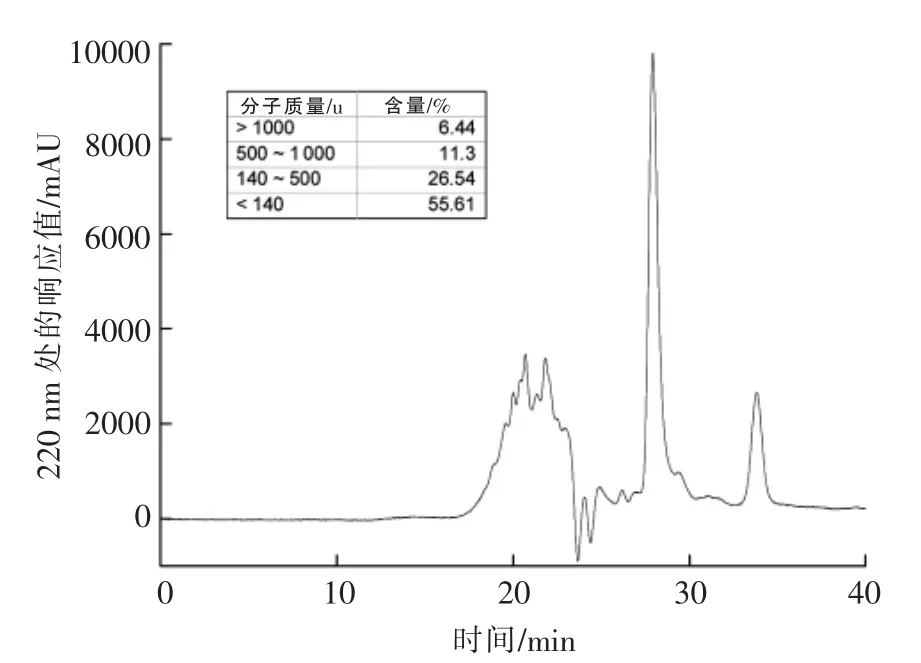
图1 豌豆低聚肽硒螯合物分子质量分布凝胶色谱图Fig.1 The gel chromatogram of molecular weight distribution of selenium-chelating pea oligopeptide
DPPH 是一种在氮桥上的一个原子中具有未配对价电子的自由基[15]。因不同研究者设置的试验条件不同,如浓度、水浴时间、pH 值等,故不同实验室的结果不能相互比较[16]。亚硒酸钠对DPPH自由基有很弱的清除能力,且与亚硒酸钠浓度无关,其清除率几乎稳定在20%左右。豌豆低聚肽对DPPH 自由基有清除能力,且清除率随豌豆低聚肽浓度的升高而升高,呈抛物线趋势,清除变化率逐渐减小。根据抛物线公式计算得到豌豆低聚肽对DPPH 自由基清除的IC50值为(3.39 ± 0.02)mg/mL。螯合物对DPPH 自由基有较强的清除能力,且随螯合物剂量的变化而变化。随着螯合物浓度的升高,其对DPPH 自由基清除率也逐渐升高,在螯合物质量浓度低于5 mg/mL 范围,清除率变化趋势几乎是线性的,随着浓度继续升高,清除率变化逐渐放缓,呈抛物线趋势。从图2中曲线公式求得豌豆低聚肽硒螯合物的IC50=(1.77 ± 0.01)mg/mL。螯合后,螯合物对于DPPH 自由基清除能力变强,高于原料豌豆低聚肽和亚硒酸钠,其IC50值几乎是豌豆低聚肽的一半。阳性对照VC 组的IC50值为(4.85±0.02)μg/mL。
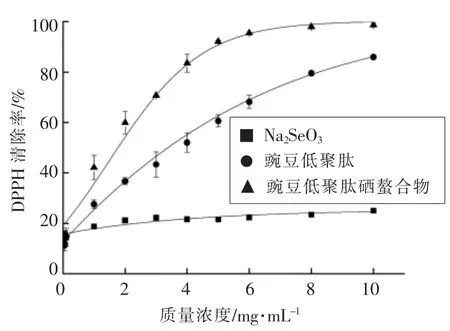
图2 螯合前、后清除DPPH 自由基作用对比Fig.2 Scavenging effect on DPPH free radicals before and after chelating
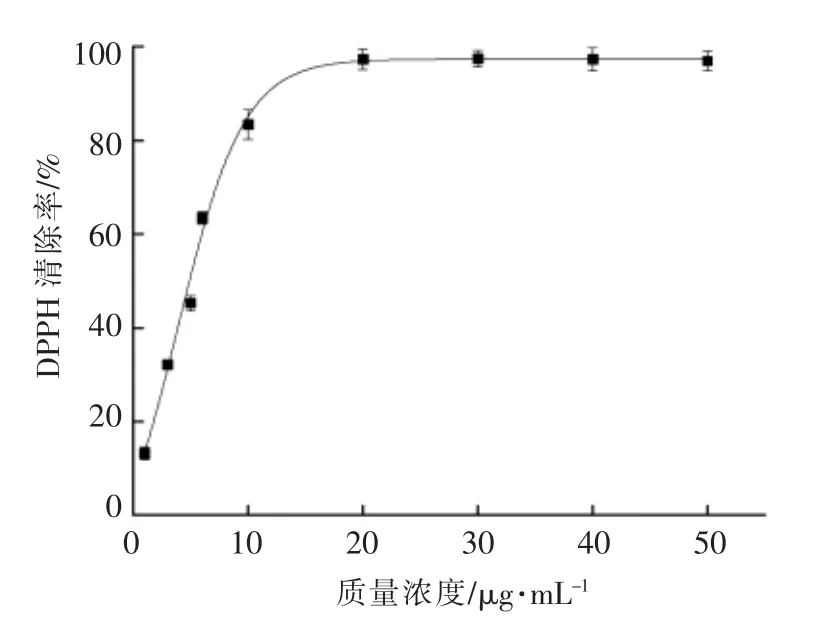
图3 VC 清除DPPH 自由基作用Fig.3 Scavenging effect of VC on DPPH free radicals
2.3 豌豆低聚肽硒螯合物清除OH 自由基
文献[17],[18]指出,非酶硒可能具有抗氧化作用,硒或可通过调节氧自由基、抗氧化酶活性来实现其抗氧化作用[19-20],特别是Na2SeO3对于OH 自由基的清除能力是其实现抗氧化功能的重要途径。本试验证实了Na2SeO3清除OH 自由基的功能。如图4所示,随着Na2SeO3浓度的升高,其对OH 自由基清除能力几乎呈线性变化,且斜率大。在Na2SeO3质量浓度为5 mg/mL 时,其对OH 自由基清除率可达100%。根据拟合曲线公式计算得到亚硒酸钠清除OH 自由基的IC50=(1.23 ± 0.02)mg/mL。豌豆低聚肽对OH 自由基有一定的清除能力,且清除率随豌豆肽浓度的增加呈抛物线变化趋势。根据拟合抛物线曲线方程,求得豌豆低聚肽清除OH 自由基的IC50值为(23.55 ± 0.07)mg/mL。豌豆低聚肽硒螯合物对OH 自由基有较强的清除能力,从图4看出,在其质量浓度低于5 mg/mL 时,清除率随浓度变化曲线接近线性,斜率较大,而随着浓度的增加,清除率曲线变化趋势放缓,斜率减小,几乎与豌豆低聚肽清除率变化斜率相同。推测在质量浓度低于5 mg/mL 时,螯合物清除OH 自由基能力受Na2SeO3浓度影响大,而超过质量浓度5 mg/mL 时,Na2SeO3清除OH 自由基能力达到饱和。螯合物清除自由基能力主要受原料豌豆低聚肽浓度的影响。根据拟合曲线求得豌豆低聚肽硒螯合物清除OH 自由基的IC50值为(3.28±0.04)mg/mL。阳性对照VC 清除OH 自由基的IC50值为(1024.87±5.96)μg/mL。
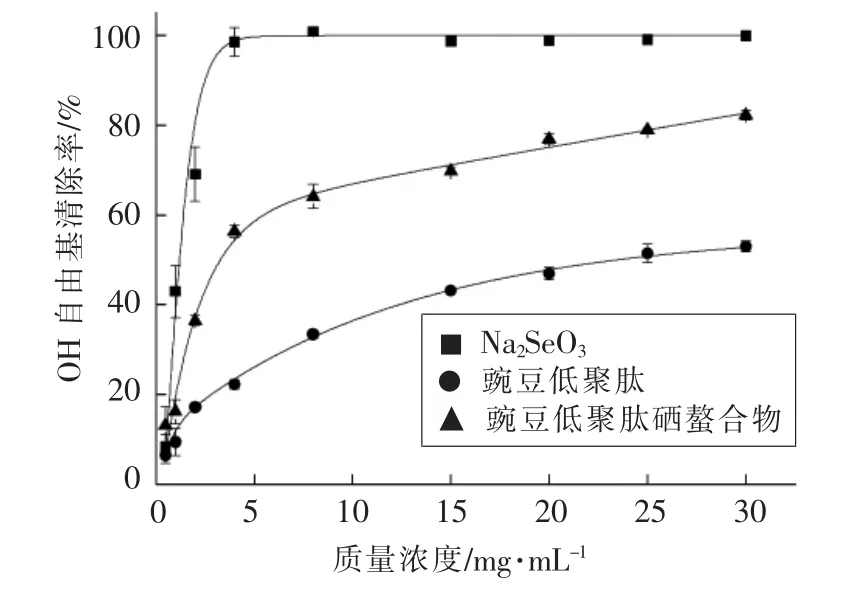
图4 螯合前、后清除OH 自由基对比图Fig.4 Scavenging effect on OH free radicals before and after chelating
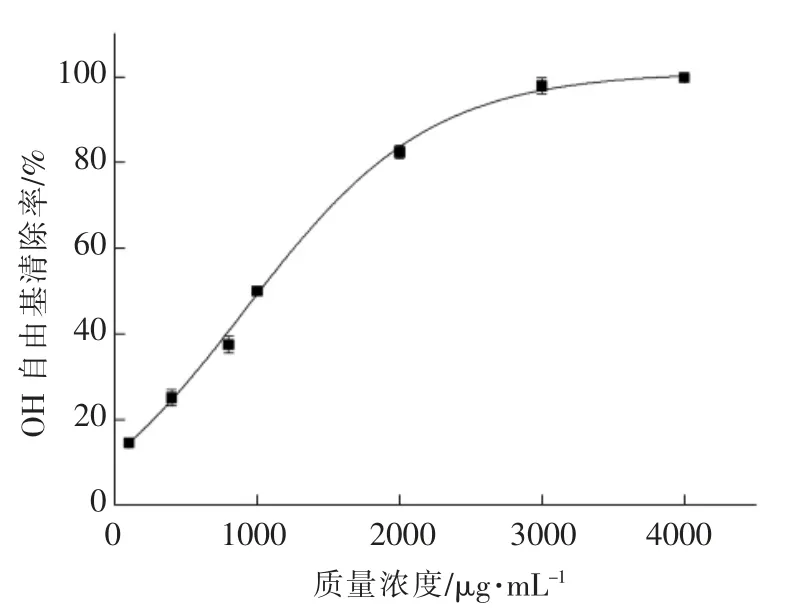
图5 VC 清除OH 自由基作用Fig.5 Scavenging effect of VC on OH free radicals
2.4 豌豆低聚肽硒螯合物的还原能力
将三价铁还原为二价铁是抗氧化功能评价的一个重要指标,其原理是抗氧化剂给出电子与自由基结合,从而清除自由基,将K3[Fe(CN)6]的三价铁还原成二价,进而二价铁与三氯化铁反应生成普鲁士蓝,在波长700 nm 处有最大吸光度。可用吸光值代表还原能力,吸光度的大小与化合物Fe3还原能力的强弱成正比[12]。如图6所示,Na2SeO3没有还原能力。豌豆低聚肽对Fe3还原能力随其浓度的增加而增加,且变化趋势呈线性。螯合物Fe3还原能力也随其浓度的增加而增加,变化趋势接近线性。螯合物的Fe3还原能力高于原料豌豆低聚肽。阳性对照VC 对Fe3还原能力随其浓度的变化呈抛物线变化趋势。在VC 质量浓度低于200 μg/mL 时,曲线变化接近线性,随着浓度的升高,对Fe3还原能力的变化率逐渐变小。当VC 的还原能力对应的吸光值约为1.6 时,所需VC 质量浓度为400 μg/mL。相应地,要到达这一吸光值,所需豌豆低聚肽硒螯合物质量浓度为50 mg/mL。当豌豆低聚肽质量浓度为50 mg/mL 时,其吸光值约0.8。从图6可推测,豌豆低聚肽硒螯合物对Fe3还原能力的提升并非是原料豌豆低聚肽与Na2SeO3的简单叠加,而是螯合工艺使还原能力增强。

图6 螯合前、后Fe3 还原能力对比图Fig.6 Reducing power comparison before and after chelating
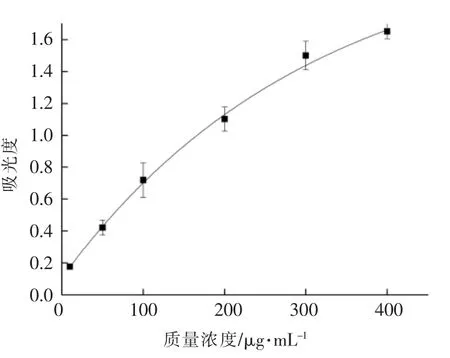
图7 VC 的还原能力Fig.7 Reducing power of VC
3 结论
Na2SeO3对于DPPH 自由基清除能力较弱,且与剂量无关,而对OH 自由基清除能力很强,Na2SeO3清除OH 自由基的IC50=(1.23±0.02)mg/mL。Na2SeO3不具有Fe3还原能力。豌豆低聚肽对于DPPH 自由基和OH 自由基都有一定的清除能力,且与剂量呈近似抛物线的关系,其对DPPH 自由基和OH 自由基的半抑制浓度分别为IC50=(3.39±0.02)mg/mL 和(23.55±0.07)mg/mL,并且具有一定的Fe3还原能力。
以豌豆低聚肽和Na2SeO3为原料,通过螯合工艺制得豌豆低聚肽硒螯合物得率为27.87%。通过理化成分分析得到螯合物水分含量为(14.17±1.12)%,总氮(粗蛋白)含量为(23.87%±0.30)%,酸溶蛋白含量为(23.22% ± 0.12)%,则酸溶蛋白占总氮(粗蛋白)的比例为97.28%,有93.45%的分子质量都分布在1 000 u 以下。豌豆低聚肽硒螯合物对于DPPH 自由基和OH 自由基的清除能力相对于原料肽都有很大提高,其对DPPH 自由基和OH 自由基的半抑制浓度分别为IC50=(1.77±0.01)mg/mL 和(3.28±0.04)mg/mL,有较强Fe3还原能力,且对其Fe3还原能力并非螯合原料肽与Na2SeO3的简单叠加,而是螯合工艺提高了对Fe3+的还原能力。
豌豆低聚肽硒螯合物具有抗氧化功能,这为植物蛋白的应用、抗氧化补硒食品的开发提供了理论基础。硒作为人体必需的一种微量元素,如何保证其在生理可控浓度范围内发挥豌豆低聚肽硒螯合物的抗氧化功能,仍需进一步研究。

