植酸酶YiAPPA在粪肠球菌中的高效组成型表达研究
(江西省科学院微生物研究所,江西南昌 330096)
植酸是单胃动物日粮中主要的抗营养因子,对蛋白质、脂类、矿物质离子等营养素均具有极强的吸附和螯合能力[1]。另外,单胃动物由于缺少分解植酸的酶,导致一些营养素的消化和吸收率降低,大量营养素被排泄到体外,造成对环境的污染[1]。植酸酶是能够将植酸分解为肌醇和无机磷的一类磷酸酯酶,是单胃动物日粮中最常见的饲料添加剂,其在饲用酶制剂生产和销售市场中占有很大的份额[2-8]。植酸酶作为饲料添加剂能够减轻植酸磷对环境的污染和解除饲料中植酸的抗营养作用。在实际生产中,通过添加外源性植酸酶可在一定程度上消除抗营养因子植酸的不良影响,但也增加了饲料成本,并且只能取得短期效应,同时在饲料制粒过程中,额外添加的植酸酶易因高温而失活[9]。因此,如何在实际生产中高效利用植酸酶具有重要意义。其中利用基因工程技术将植酸酶在乳酸菌宿主中进行表达将是一种可行的和廉价的策略。
来源于Yersiniaintermedia的植酸酶YiAPPA是目前已知的植酸酶活性最高的植酸酶,其于37 ℃、pH4.5条件下的酶活高达3960 U/mg[10],是目前应用最广泛的植酸酶AspergillusnigerPhyA酶活的40倍[11]。YiAPPA的最适反应pH为4.5,于pH2.0~5.5条件下具有50%以上的相对酶活,于pH1.0~8.0条件下具有80%以上的稳定性,并且对于胃蛋白酶和胰蛋白酶均具有较强的抗性[10]。YiAPPA的酶学性质使其在饲料工业中具有巨大的应用潜力,但是其酶学性质(特别是热稳定性)难以完全满足饲料工业的要求。以YiAPPA的热稳定性为例,饲用酶制剂在饲料制粒过程中需要经过一个75~93 ℃的短暂高温,而YiAPPA于80 ℃的半衰期仅为15 min[10],难以满足饲料工业的要求。
乳酸菌是以乳酸为主要代谢产物的各类细菌统称,是人与大多数动物肠道内常见优势菌群,被公认为安全级微生物[12]。乳酸菌进入动物体内不但可以保持肠道菌群微生态平衡,还可以提供很多益生作用。乳酸菌表达系统越来越受到重视,其优点在于乳酸菌安全,无内毒素,可以在肠道中存活定殖,其表达的外源蛋白质可以源源不断在肠道中生产并起到相应的作用[13-16]。但是乳酸菌表达系统存在表达量低的缺点[17],通过改造控制基因表达的顺式作用元件是提高蛋白质表达量的常用手段,而其中最常用的就是找到一种高效的启动子。乳酸菌属的启动子对宿主有着高度的选择性和特异性[18]。因此在乳酸菌表达系统中很少使用外源启动子甚至是不同种属的启动子。这就需要对乳酸菌内源性的启动子进行克隆和筛选,从而找到所需的启动子。目前用于构建乳酸菌表达载体的启动子包括诱导型启动子和组成型启动子,对应的表达载体分为诱导型表达载体和组成型表达载体[19-20]。诱导型表达载体的优点在于在添加诱导物的条件下可以相对提高外源蛋白质的表达量;其缺点在于在大规模发酵生产中,诱导物的添加使得工艺变得繁琐,生产成本变高,并且诱导物的添加是否会对人和动物机体产生非安全方面的影响还有待研究。组成型乳酸菌表达载体则可以在不添加诱导物的情况下不断地表达目的蛋白,在饲料生产、食品发酵等工业生产中简化操作步骤,同时降低成本,便于大规模生产[21]。乳酸菌组成型启动子在功能上的优势使其在科研和工业生产中显得越发重要,因此克隆和筛选高效的乳酸菌组成型启动子具有重要意义。
本研究以本实验室前期从健康仔猪肠道黏膜上分离纯化得到的具有优良益生特性的粪肠球菌EXW27为宿主菌,结合人工启动子文库技术和高通量筛选技术,获得控制YiAPPA高效组成型表达的强组成型启动子,从而构建既具有益生特性又具有植酸酶活性的转基因粪肠球菌。本研究一方面可为植酸酶YiAPPA的应用提供新策略,另一方面也为研制新型转基因微生态制剂奠定基础。
1 材料与方法
1.1 材料与仪器
大肠杆菌EscherichiacoliJM109、粪肠球菌EntercoccusfaecalisEXW27、大肠杆菌-乳酸菌穿梭质粒pSIP409、重组质粒pSTOP1622-yiappah 均由本实验室保存;KOD-Plus-neo DNA聚合酶 日本Toyobo公司;DNA限制性内切酶、T4 DNA连接酶、DNA Marker、蛋白质Marker 美国Fermentase公司;DNA胶回收试剂盒、质粒抽提试剂盒E.Z.N.A. 美国Omega Bio-tek公司;B-PERTMBacterial Protein Extraction Reagent 美国Thermo Fisher Scientific 公司;Chelating SepharoseTMFast Flow 美国GE Healthcare公司;Bradford法蛋白浓度测定试剂盒、PCR引物 上海生工生物工程股份有限公司;乳酸杆菌素sakacin P 百灵威科技有限公司;实验所用试剂 均为国产分析纯。
Mastercycler gradient型PCR仪 美国Eppendorf公司;TY04S-3C型凝胶成像系统 北京君意东方电泳设备有限公司;SCIENTZ-ⅡD型超声波细胞破碎仪 宁波新芝生物科技股份有限公司;SP-752PC型紫外可见分光光度计 上海光谱仪器有限公司;iMark 酶标仪 美国Bio-Rad公司。
1.2 实验方法
1.2.1 重组质粒pSIP409-yiappads的构建与鉴定 基于yiappa的碱基序列,设计引物P1和P2(表1),以重组质粒pSTOP1622-yiappah为模板,扩增基因yiappa中不含信号肽的结构基因yiappads。PCR扩增体系为:10×buffer I 5 μL;dNTP 5 μL;MgSO45 μL;引物各2 μL;模板1 μL;KOD-Plus-neo DNA聚合酶2 μL;ddH2O 28 μL。PCR扩增条件为:98 ℃ 5 min;98 ℃ 20 s,60 ℃ 20 s,74 ℃ 2 min,30个循环;74 ℃ 10 min。扩增产物经Nco I和Xho I双酶切,连接至经同样双酶切处理的载体pSIP409,构建重组质粒pSIP409-yiappads。将连接产物转化大肠杆菌EscherichiacoliJM109感受态细胞,将转化产物全部涂布于含200 μg/mL红霉素的LB固体平板上,于37 ℃过夜培养。挑取LB固体平板上转化子,提取其中所含重组质粒。采用Nco I和Xho I双酶切重组质粒鉴定是否有外源基因的插入。
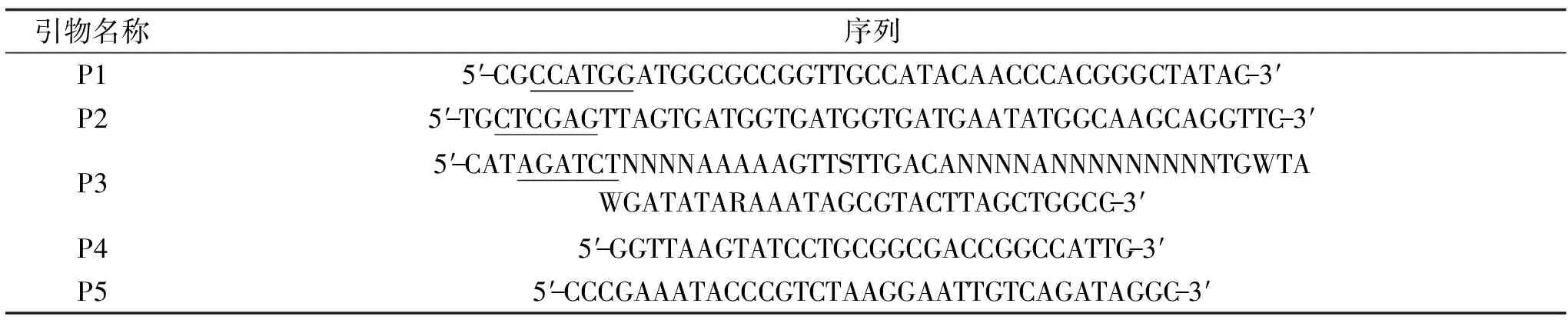
表1 构建重组质粒所用引物序列Table 1 Primer sequences for the construction of recombinant plasmids
引物P3中N为25%的A、G、C或T;S为50%的G或C;W为50%的A或T;R为50%的A或G。1.2.2 YiAPPA在粪肠球菌中组成型表达的人工启动子文库的构建 在NCBI中找出粪肠球菌中16S rRNA的启动子序列,采用DNAMAN软件对启动子序列进行比对,确定启动子序列中核心序列和非核心序列。将启动子序列中核心序列保持不变,将非核心序列设计为随机化序列或半保守序列,并结合穿梭质粒pSIP409的结构特点,设计构建人工启动子文库所需的上游PCR引物P3(如表1和图2所示)。再基于yiappa的碱基序列,设计构建人工启动子文库所需的下游PCR引物P4(如表1和图2所示)。以重组质粒pSIP409-yiappads为模板,以P3和P4为引物,进行PCR扩增。PCR扩增条件为:98 ℃ 5 min;98 ℃ 20 s,60 ℃ 20 s,74 ℃ 20 s,30个循环;74 ℃ 10 min。扩增产物经Bgl II和Nco I双酶切,连接至经同样双酶切处理的载体pSIP409-yiappads。将连接产物转化大肠杆菌EscherichiacoliJM109感受态细胞,将转化产物全部涂布于含200 μg/mL红霉素的LB固体平板上,于37 ℃过夜培养。挑取LB固体平板上所有转化子,提取其中所含重组质粒并电击转化粪肠球菌EntercoccusfaecalisEXW27,将转化产物全部涂布于含10 μg/mL红霉素的MRS固体平板上,37 ℃培养24 h,获得人工启动子文库。粪肠球菌EntercoccusfaecalisEXW27的电击转化方法参照参考文献[22]进行。
1.2.3 YiAPPA在粪肠球菌中组成型表达的人工启动子文库的高通量培养和筛选
1.2.3.1 人工启动子文库的高通量培养 取灭菌、烘干的96孔深孔板,每孔加入含10 μg/mL红霉素的MRS液体培养基500 μL。用10 μL移液枪扎取枪头后挑取单菌落,转移到培养孔中,依次反复直至挑选结束。盖上盖子,于摇床中37 ℃静置培养24 h进行活化。用8通道移液器按照顺序将活化后的种子液转接至48孔深孔板中,接种量为3%。盖上盖子,于37 ℃静置培养至OD600 nm为1.8(培养时间约为36 h)。其中,阴性对照为未经诱导处理的转化了重组质粒pSIP409-yiappads的重组粪肠球菌;阳性对照为经乳酸杆菌素sakacin P诱导处理的转化了重组质粒pSIP409-yiappads的重组粪肠球菌(诱导条件为:当重组粪肠球菌生长至OD600 nm为0.3时,加入50 ng/mL sakacin P进行诱导,待重组粪肠杆菌生长至OD600 nm为1.8,培养结束)[22]。
1.2.3.2 人工启动子文库的初步筛选 将发酵后的48 孔深孔板于4 ℃下4000 r/min离心10 min,收集细胞沉淀,加入25 μL 0.25 mol/L醋酸钠缓冲液(pH4.5),重悬菌体。按照顺序将菌悬液转移至96孔深孔板,加入等体积的细菌蛋白抽提试剂(B-PER Bacterial Protein Extraction Reagent),室温放置30 min后,再加入150 μL 0.25 mol/L醋酸钠缓冲液(pH4.5),混匀,用于植酸酶活性的高通量检测。向实验组中加入400 μL 1.5 mmol/L植酸钠溶液(0.25 mol/L醋酸钠缓冲液,pH4.5),对照组中加入400 μL颜色/终点混合液(钼酸铵/钒酸铵/硝酸),混匀。于37 ℃反应30 min后,立即向实验组中加入400 μL颜色/终点混合液,对照组中加入400 μL 1.5 mmol/L植酸钠溶液,并混匀。取洁净的酶标板加入100 μL无菌水和100 μL反应液并混匀,用酶标仪测定415 nm下的吸光值。实验组与对照组的吸光值的差值大小反应重组粪肠杆菌中植酸酶表达量的多少。
1.2.3.3 人工启动子文库的复筛 从人工启动子文库中选取酶活较高的10个克隆子,对其进行复筛,并以未经诱导处理的转化了重组质粒pSIP409-yiappads的重组粪肠球菌为阴性对照,以经乳酸杆菌素sakacin P诱导处理的转化了重组质粒pSIP409-yiappads的重组粪肠球菌为阳性对照。这12个克隆子的培养和筛选分别参照“1.2.3.1”和“1.2.3.2”。
1.2.4 YiAPPA在粪肠球菌中组成型表达的组成型启动子的鉴定 选取人工启动子文库中植酸酶活性较高的克隆子,设计引物P4和P5(表1)进行菌落PCR,其中PCR扩增体系和扩增条件参照“1.2.2”。并将获得的DNA片段送至上海生工生物工程股份有限公司进行测序,确定每个克隆子所对应的启动子序列。
1.2.5 YiAPPA在粪肠球菌中的组成型表达和纯化 接种重组粪肠杆菌单克隆到含10 μg/mL红霉素的MRS液体培养基中,用250 mL三角瓶进行培养,其中培养基的装液量为100 mL,于37 ℃静置培养,培养时间为24 h。然后转接该培养物于新鲜含10 μg/mL红霉素的MRS液体培养基中,用250 mL三角瓶进行培养,其中培养基的装液量为100 mL,接种量为3%,于37 ℃静置培养,培养时间为36 h。
待培养结束后,于4 ℃下8000 r/min离心5 min收集菌体沉淀,采用0.25 mol/L醋酸钠缓冲液(pH4.5)重悬并洗涤菌体沉淀,再加入适量0.25 mol/L醋酸钠缓冲液(pH4.5)重悬菌体沉淀,置于冰上用超声波破碎细胞。超声波细胞破碎仪的参数设置如下:超声波功率为250 W,超声波破碎时间为3 s,间歇6 s。超声波处理菌体细胞至菌体悬液变为均一的溶液,采用SDS-PAGE检测重组蛋白质的表达情况。扫描已脱色的凝胶,采用软件Image J 1.38×对凝胶上目标蛋白条带进行灰度积分,以此估算目标蛋白质占细胞总蛋白中的比例。
采用Ni2+亲和层析柱对细胞可溶成分中目的蛋白质进行纯化,用250 mmol/L咪唑洗脱缓冲液洗脱,即得到纯化后的重组酶。利用SDS-PAGE检测重组酶的纯度,并采用Bradford法[23]测定重组酶的浓度。

图1 粪肠球菌16S rRNA启动子序列比对Fig.1 Alignment of 16S rRNA promoters from Entercoccus faecalis图2 人工启动子文库构建示意图Fig.2 Construction of the synthetic promoter library
1.2.6 分子克隆技术和表达产物的聚丙烯酰胺凝胶电泳(Sodium dodecyl sulphate-polyacrylamide gel electrophoresis,SDS-PAGE)分析 分子克隆技术和表达产物的SDS-PAGE分析参照文献[24]进行。
1.2.7 YiAPPA的酶学性质分析 YiAPPA的酶学性质分析参考文献[25]。
1.2.7.1 植酸酶的最适反应pH测定 将酶液于不同pH(1.0~8.0)条件下测定植酸酶活性,将所测得的最高酶活力定义为100%,然后以相对酶活对pH作图。所使用的缓冲液如下:0.25 mol/L甘氨酸-盐酸缓冲液,pH1.0~3.5;0.25 mol/L醋酸钠-醋酸缓冲液,pH3.5~6.0;0.25 mol/L Tris-盐酸缓冲液,pH6.0~8.5。
1.2.7.2 植酸酶的pH稳定性测定 将酶液用不同pH(1.0~12.0)缓冲液稀释,使其在不同pH条件下于37 ℃处理2 h,然后用最适pH缓冲液稀释,并根据如上反应体系测定样品的酶活力,将所测得的最高酶活力定义为100%,然后以相对酶活对pH作图。所使用的缓冲液如下:0.25 mol/L甘氨酸-盐酸缓冲液,pH1.0~3.5;0.25 mol/L醋酸钠-醋酸缓冲液,pH3.5~6.0;0.25 mol/L Tris-盐酸缓冲液,pH6.0~8.5;0.25 mol/L甘氨酸-氢氧化钠缓冲液,pH8.5~12.0。
1.2.7.3 植酸酶的最适反应温度测定 按照如上反应体系,分别于30~90 ℃反应30 min,测定不同温度条件下样品的酶活力,并以酶活力对温度作图,确定其最适反应温度。
1.2.7.4 植酸酶的热稳定性测定 取250 μL酶液于离心管中,加入750 μL 0.25 mol/L醋酸钠缓冲液(pH4.5),混匀。酶液于80 ℃保温0~40 min后,根据如上反应体系测定样品的酶比活力,将所测得的最高酶比活力定义为100%,并以相对酶活对时间作图。
1.2.7.5 植酸酶的酶活力测定 取250 μL酶液于离心管中,加入750 μL 0.25 mol/L醋酸钠缓冲液(pH4.5),混匀。向实验组管中加入2 mL 1.5 mmol/L 植酸钠溶液(0.25 mol/L醋酸钠缓冲液,pH4.5),对照组中加入2 mL颜色/终点混合液(钼酸铵/钒酸铵/硝酸),摇匀。于37 ℃反应30 min后,立即向实验组中加入2 mL颜色/终点混合液,对照组中加入2 mL 1.5 mmol/L植酸钠溶液,并混匀,于415 nm处测定光吸收值。植酸酶活力单位(U)定义为:在37 ℃、pH4.5的条件下,每分钟从1.5 mmol/L植酸钠溶液中释放出1 μmol/L无机磷所需要的植酸酶量为一个酶活力单位(U)。
1.3 数据处理

2 结果与分析
2.1 人工启动子文库的构建
本研究首先从NCBI查询得到粪肠球菌中16S rRNA的启动子序列,包括Ef16SA-1、Ef16SA-2、Ef16SB-1、Ef16SB-2、Ef16SC-1、Ef16SC-2、Ef16SD-1和Ef16SD-2。并采用DNAMAN软件对这些序列进行比对分析,找出其中保守序列和非保守序列,结果如图1所示。将启动子序列中保守序列保持不变,将非保守序列设计为随机化序列,设计人工启动子文库构建引物P3。以诱导型大肠杆菌-乳酸菌穿梭表达载体pSIP409为基础框架,利用pSIP409中酶切位点构建植酸酶YiAPPA在粪肠球菌EXW27中组成型表达的人工启动子文库。
2.2 人工启动子文库的筛选与鉴定
本研究构建植酸酶YiAPPA在粪肠球菌EXW27中组成型表达的人工启动子文库,共获得318个克隆子,对这318个克隆子进行胞内植酸酶活性检测,实现人工启动子文库的初步筛选。从以上318个克隆子选取其中酶活较高的10个克隆子,对其进行复筛,并以未经诱导处理的转化了重组质粒pSIP409-yiappads的重组粪肠球菌为阴性对照,以经乳酸杆菌素sakacin P诱导处理的转化了重组质粒pSIP409-yiappads的重组粪肠球菌为阳性对照。这12个克隆子的胞内植酸酶活性检测结果如图3所示,此外以上克隆子的胞内可溶性成分的SDS-PAGE检测结果如图4所示。由图3和图4可知,本研究所获得的组成型人工启动子均能有效控制植酸酶YiAPPA在粪肠球菌EXW27中表达。其中,10号克隆子具有最高的植酸酶活性,其胞内可溶性成分以植酸钠为底物时所测得的415 nm下的吸光值最高。并且10号克隆子的胞内植酸酶表达量最高,10号克隆子中重组YiAPPA的表达量约占细胞内蛋白总量的15%,约为经乳酸杆菌素sakacin P诱导的重组YiAPPA表达量的94%。
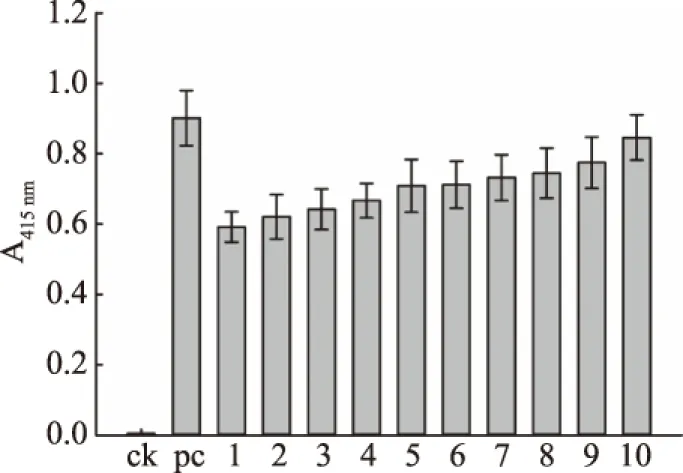
图3 人工启动子文库的植酸酶活性分析Fig.3 Phytase activity analysis of synthetic promoter library注:ck:未经诱导处理的转化了重组质粒pSIP409-yiappads的重组粪肠球菌;pc:经乳酸杆菌素sakacin P诱导处理的转化了重组质粒pSIP409-yiappads的重组粪肠球菌;1~10分别表示1~10号克隆子。
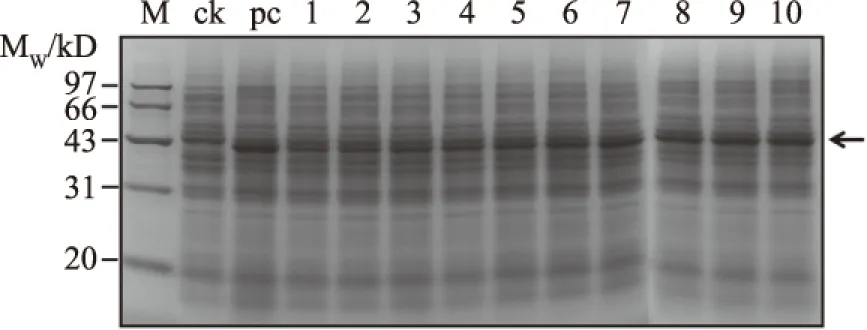
图4 重组植酸酶YiAPPA在粪肠球菌EXW27中表达的SDS-PAGE分析Fig.4 SDS-PAGE analysis of expression ofrecombinant phytase YiAPPA in Entercoccus faecalis EXW27注:M:蛋白质Marker;ck:未经诱导处理的转化了重组质粒pSIP409-yiappads的重组粪肠球菌的胞内可溶成分;pc:经乳酸杆菌素sakacin P诱导处理的转化了重组质粒pSIP409-yiappads的重组粪肠球菌的胞内可溶成分;1~10分别表示1~10号克隆子的胞内可溶成分;图中箭头标示为目的蛋白。
采用引物P4和P5对以上10个克隆子进行菌落PCR,并将获得的DNA片段送至上海生工生物工程股份有限公司进行测序,确定每个克隆子所对应的启动子序列,结果如图5所示。在筛选得到的10个启动子中,除了启动子p2对应为Ef16SA-1,启动子p5对应为Ef16SD-2,启动子p9对应为Ef16SC-1外,其他7个启动子均为人工启动子。根据以上结果,启动子p10控制YiAPPA在粪肠球菌EXW27中组成型表达的效率最高,选定启动子p10为控制YiAPPA在粪肠球菌EXW27中组成型表达的启动子。
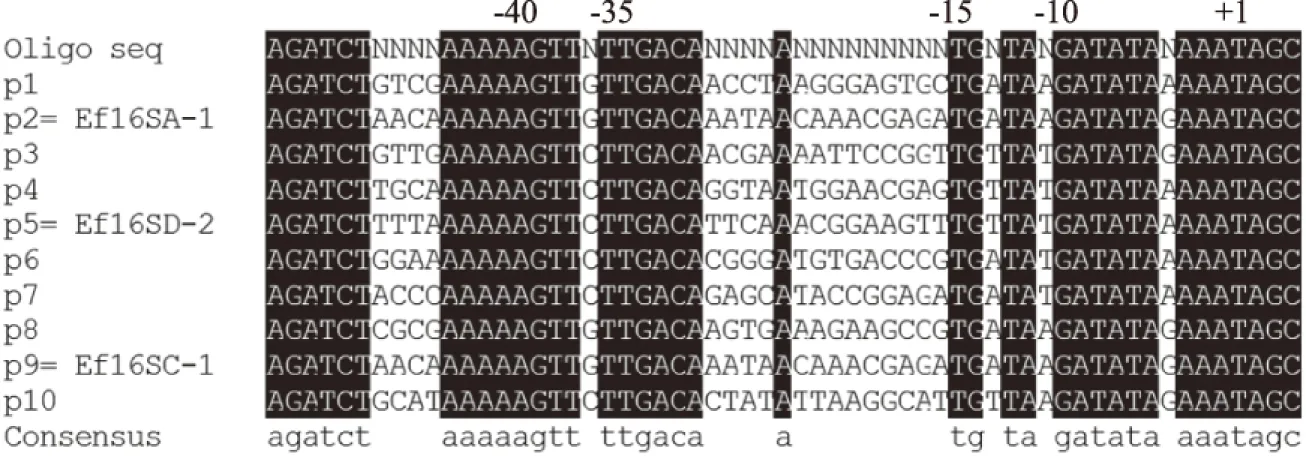
图5 人工启动子的序列比对Fig.5 Alignment of synthetic promoters
2.3 重组YiAPPA在粪肠球菌中的表达与纯化
待发酵结束后,采用超声波处理菌体细胞,并采用Ni2+亲和层析柱对细胞可溶成分中目的蛋白质进行纯化,用200 mmol/L咪唑洗脱缓冲液洗脱,即得到纯化后的重组植酸酶YiAPPA。
重组植酸酶YiAPPA在粪肠球菌EXW27中的组成型表达及纯化的SDS-PAGE检测分析结果如图6所示。重组YiAPPA的分子量约为45 kDa,与理论值基本一致。
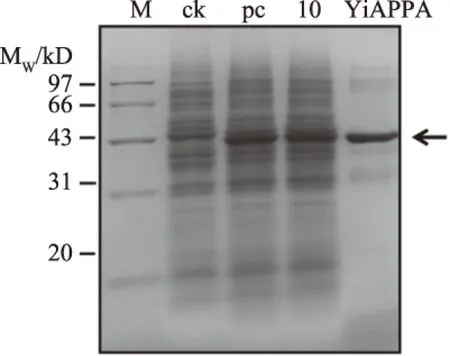
图6 重组YiAPPA在粪肠球菌EXW27中表达及纯化的SDS-PAGE分析Fig.6 SDS-PAGE analysis of expression and purification ofrecombinant YiAPPA in Entercoccus faecalis EXW27注;M:蛋白质Marker;ck:未经诱导处理的转化了重组质粒pSIP409-yiappads的重组粪肠球菌的胞内可溶成分;pc:经乳酸杆菌素sakacin P诱导处理的转化了重组质粒pSIP409-yiappads的重组粪肠球菌的胞内可溶成分;10:10号克隆子的胞内可溶成分;YiAPPA:经Ni2+亲和层析柱纯化后的重组YiAPPA。图中箭头标示为目的蛋白。
2.4 重组YiAPPA的酶学性质研究
2.4.1 pH对重组YiAPPA相对酶活的影响 将酶液于不同pH(1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0)条件下,测定pH对重组YiAPPA相对酶活的影响,结果如图7所示。重组植酸酶YiAPPA的最适反应pH为4.5,并且重组植酸酶YiAPPA在pH2.0~6.0范围内具有50%以上相对酶活。野生型YiAPPA的最适反应pH为4.5,并于pH2.0~5.5条件下具有50%以上的相对酶活[10,26]。本研究中重组粪肠球菌表达的重组YiAPPA和野生型YiAPPA的最适反应pH以及在不同pH条件下的相对酶活基本一致。

图7 pH对酶活的影响Fig.7 pH dependence of phytase activity
2.4.2 pH对重组YiAPPA稳定性的影响 重组植酸酶YiAPPA的pH稳定性如图8所示,其在pH1.0~3.0范围内具有80%以上的相对酶活;在pH4.0~10.0范围内具有90%以上的相对酶活。野生型YiAPPA于pH1.0~8.0条件下具有80%以上的稳定性[10,26]。重组YiAPPA与野生型YiAPPA的pH稳定性基本一致。

图8 pH对酶稳定性的影响Fig.8 pH stability of phytase activity
2.4.3 温度对重组YiAPPA酶比活力和稳定性的影响 按照植酸酶的酶比活力测定方法,于30~90 ℃下测定重组YiAPPA的酶比活力,以样品的绝对酶活对温度作图,结果如图9所示。重组植酸酶YiAPPA的最适反应温度为55 ℃,并且重组植酸酶YiAPPA于55 ℃的绝对酶活高达3900 U/mg。将重组植酸酶YiAPPA于80 ℃分别保温不同时间,测定其相对酶活,分析其热稳定性,结果如图10所示。在80 ℃下,重组植酸酶YiAPPA于80 ℃的半衰期约为15 min。重组YiAPPA于不同温度下的酶比活力以及于80 ℃的半衰期与野生型YiAPPA[10,26]基本一致。
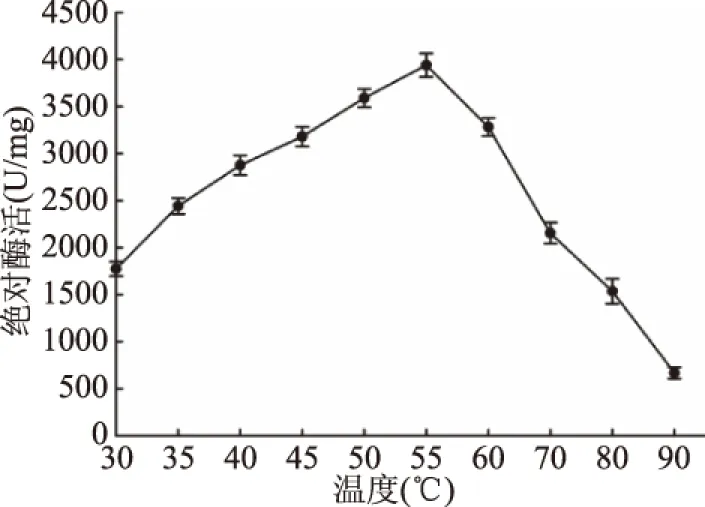
图9 温度对酶活的影响Fig.9 Temperature dependence of phytase activity
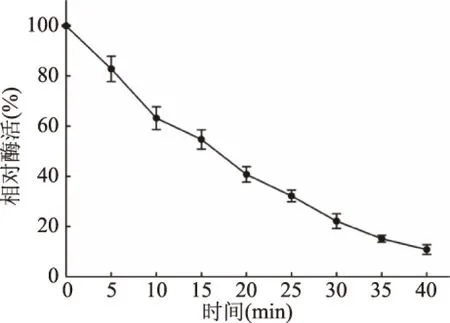
图10 80 ℃重组YiAPPA的热稳定性Fig.10 Thermal stability of recombinant YiAPPA at 80 ℃
3 结论
本研究首先对比分析了粪肠球菌16S rRNA的启动子序列,然后以诱导型大肠杆菌-乳酸菌穿梭载体pSIP409为基础框架,并结合粪肠球菌16S rRNA的启动子序列特征和pSIP409中酶切位点设计构建人工启动子文库的相关引物,最后基于PCR引物和启动子序列中非保守序列的随机化设计构建人工启动子文库。通过对人工启动子文库的高通量筛选,获得了控制植酸酶YiAPPA在粪肠球菌EXW27中高效组成型表达的组成型启动子p10。重组植酸酶YiAPPA在粪肠球菌EXW27中成功表达,其最适反应pH为4.5,在pH2.0~6.0范围内具有50%以上相对酶活,最适反应温度为55 ℃,绝对酶活高达3900 U/mg,于80 ℃的半衰期约为15 min。

