宏基因二代测序技术对感染性疾病患者的诊断价值及其临床应用
谢栓栓 李譞 李萍 彭爱梅 李晓峰 李微 王昌惠
1同济大学附属第十人民医院呼吸与危重症医学科,上海200072;2同济大学附属第十人民医院急诊科,上海200072;3同济大学附属第十人民医院老年科,上海200072
众所周知,感染性疾病的发病率和病死率居高不下[1]。一旦出现感染性疾病,将会以较快的速度进行传染,影响人们的身体健康[2]。
微生物实验室作为病原体检测的一线科室,通过显微镜检查药敏等方法,在感染性疾病的控制中发挥着重要作用[3]。而传统分子诊断和基因分型方法提供的信息有限,仍有高达60%的病例未检测到病原体[4-6]。无法获得明确病原体和及时诊断可能会延迟抗菌的精确治疗,从而导致不必要地使用广谱抗生素,诱导病原体抗药性并增加医疗费用[7]。
21世纪初人类基因组计划完成,测序技术发展迅猛,高通量、低成本的二代测序技术即高通量测序(next-generation sequencing,NGS)技术应运而生,该技术运用于全基因组测序、全外显子组测序、宏基因测序等。其中宏基因组二代测序(metagenomic next-generation sequencing,mNGS)技术的研究最为广泛。其优势在于单次运行获取微生物核酸片段的序列信息,经过生物信息分析与比对,检测出所有微生物的种类及序列数量的方法[8]。m NGS不依赖培养,可检出无法培养或难以培养的病原体,无偏向性地检索所有DNA,可用于所有病原体的鉴定和分型[9]。因此,该技术可在医学微生物实验室和感染预防措施中发挥巨大作用[2]。
本研究基于微生物组测序技术,对比m NGS方法与传统培养法检测病原体的敏感度和特异度,并探讨m NGS检出对感染患者病情程度和预后的影响。
1 对象与方法
1.1 研究对象 收集2018年5月至2019年9月于同济大学附属第十人民医院呼吸与危重症医学科、老年科、急诊ICU 和急诊科住院的94例患者的标本和临床资料,同时收集所有入组患者血常规、C反应蛋白、降钙素原、中性粒细胞计数、细胞因子等检查的资料。根据m NGS结果将所有患者分为检出组(病原体检出序列数≥1)和未检出组。本研究的排除标准为:孕妇、精神病患者;未满18周岁的患者。此研究已获得同济大学附属第十人民医院医院伦理委员会批准 (SHSY-IEC-4.1/20-21/01)。
1.2 病原微生物组二代基因测序 本实验采用基于国产BGISEQ-50平台进行检测。取样本后,提取核酸,建库及测序,最后利用微生物组学数据库进行数据分析。
1.2.1 样本采集及采集原则 对于感染患者或有不明原因发热患者,采集感染部位样本进行m NGS检测。样本处理:由于采集到的样本本身大多含有致病性病原菌,在核酸提取前往往需要对样本进行灭活处理。除此之外,痰液样本在灭活后需要进行去黏度处理,血液样本根据实际情况决定是否需要离心进行血浆、白细胞分离。提取核酸:核酸质量是m NGS检测成功的关键因素。文库制备及上机测序。3'末端多聚A 尾(poly-A)及对照品:每次实验都应包括poly-A 内参、阴性和阳性对照。poly-A 可以帮助识别分析失败或异常的样本,达到质控作用。
1.2.2 质量控制 有效测序数据量不低于20 M:(1)需去人源序列(90%以上)。(2)微生物序列同源性较高,所以对于检出序列数读长要求50 bp以上,考虑到人源基因组的干扰及检测的敏感度,在没有进行去除人源化基因组成分的前提下,建议有效测序数据量不低于20 M。
1.2.3 数据过滤 质控合格的数据,需要通过生物信息学分析方法进一步过滤,去除低质量的序列,以获得高质量的序列数据。高质量的序列再进行人源宿主序列去除,目前普遍参考的宿主序列库主要为人类基因组参考序列。不同的比对方法根据不同的比对策略设计了不同的算法,实验室应当选取合适的比对软件建立完善的实验室比对流程。
1.2.4 序列比对 经过上述过滤后的序列与病原数据库中的参考序列进行比对,病原数据库涵盖细菌、真菌、病毒、原虫等多种病原微生物。比对成功的序列需要进一步去除高覆盖重复序列、低质量比对序列,并尽可能排除多比对等情况,得到最终病原比对结果。针对最终病原比对结果,计算所有检出病原的参数,包括比对序列数、相对丰度、基因组覆盖度和深度等。
1.2.5 报告生成 报告生成过程中会参考疑似背景微生物库及阴性对照检测结果,并结合所提供的临床信息,最终给出检测报告。
1.3 细胞因子的检测方法 细胞因子的测定:采用IMMULITE/IMMULIE 1000 分析仪,采用固相、夹心以及化学发光法对血清中细胞因子(肿瘤坏死因子α、IL-2R、IL-6、IL-8、IL-10)进行检测。化学发光法试剂盒来自德国SIEMENS公司。按照厂家说明书的操作流程将处理后的标本送入分析仪进行检测,并记录相应的细胞因子浓度。
1.4 统计学分析 采用SPSS 25.0和Graphpad prism 7统计软件进行数据处理和分析。正态分布的数据以±s表示,率的比较采用χ2检验;呈非正态分布的数据则以四分位数或中位数进行表示,并进行秩和检验。logistic回归分析探讨与病原体检测阳性相关的危险因素。P<0.05为差异有统计学意义。
2 结果
2.1 样本的收集 纳入的94例的样本类型中血液最多(34/94),其次为肺泡灌洗液(28/94),组织(12/94),脑脊液 (3/94),痰液 (6/94),胸水(7/94),脓液 (1/94),骨髓 (1/94)等。下呼吸道感染所占比例最高 (60/94),其次是血流感染(10/94),胸水 (6/94),中枢系统感染 (5/94),心血管系统感染 (2/94),眼睛、口腔、咽喉等感染(2/94),皮肤黏膜感染(1/94)等。
2.2 m NGS检测和培养方法的诊断性比较 为了比较培养方法和m NGS的诊断阳性率,本研究纳入94例样本,分为感染组 (75例,79.79%)、非感 染 组 (16 例,17.02%)和 未 知 组 (3 例,3.19%)。结果显示:m NGS诊断组病原体的阴性预测值和阳性预测值分别为30.56%和91.23%,培养组诊断病原体的阴性预测值和阳性预测值分别为18.84% 和87.50%。此外,m NGS 的敏感度为67.53%,显著高于培养法 (27.23%) (χ2=-223.107,P<0.05)。m NGS 的 特 异 度 为68.75%,低于培养法 (81.25%),但差异无统计学意义(χ2=3.840,P=0.05)。见表1。
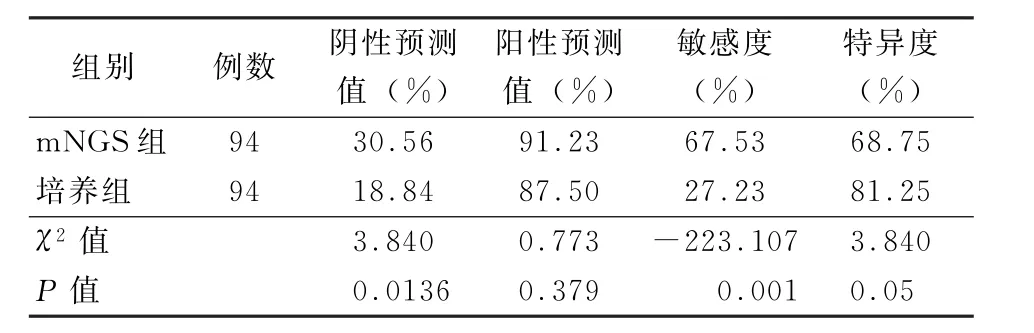
表1 m NGS检测和培养方法的诊断性比较
2.3 入组患者的一般资料 研究共入组75例感染患者,男63 例,女12 例,平均年龄56.2岁。75例患者(79.79%)检出病原体,检出病原体的为序列数为5 295.62±2 507.26,真菌检出率为9.62%,细菌检出率为59.49%,厌氧菌检出率为9.10%,支原体检出率为3.64%,结核检出率为5.45%,病毒检出率为12.70%。2 组性别、年龄和14 d 病死率差异均无统计学意义 (P值均>0.05)。但未检出组患者住院时间明显高于检出组(t=4.724,P<0.05)。见表2。
2.4 m NGS和培养检测方法病原体和样本水平上的比较 m NGS组肺泡灌洗液标本病原体检测阳性率高于全血标本阳性率。同样,培养方法中肺泡灌洗液标本病原体检测阳性率也高于全血标本的阳性率。在75例感染组患者中,克雷伯杆菌(7/75)是最常见的病原体,其次是厌氧菌 (6/75),假单胞菌 (6/75),曲菌 (6/75)和结核分枝杆菌(3/75),非结核分枝杆菌 (3/75),大肠埃希菌(3/75)和肠球菌属 (3/75),厌氧菌 (6/75) (仅限m NGS)等。
2.5 检出组与未检出组细胞计数及炎症相关指标的比较 结果显示:检出组的外周血白细胞计数、中性粒细胞计数、C反应蛋白、降钙素原均高于未检出组(t值分别为-8.848、-4.724、-4.335、-4.335,P值均<0.05)。见表3。
2.6 检出组与未检出组细胞因子浓度的比较 结果显示:检出组患者的外周血肿瘤坏死因子α、IL-2R、IL-8的浓度明显高于未检出组 (t值分别为-5.585、-7.258、-4.678,P值均<0.05)。见表4。
2.7 病原体检测阳性的相关因素分析 去除混杂因素后结果显示,对检出有意义的变量分别为:性别(男)、年龄、IL-2R、IL-10、住院时间及中性粒细胞计数。其中IL-10以及中性粒细胞计数对病原体的检出起到抑制作用,性别 (男)、年龄、IL-2R对病原体的检出起到促进作用。
3 讨论
本研究系统性地比较了m NGS和传统培养法,发现m NGS 在多个方面都具有优势。首先,m NGS 在检测克雷伯杆菌 (7/75)、厌氧菌(6/75)、假单胞菌 (6/75)、曲菌 (6/75)和结核分枝杆菌(3/75)有明确优势。感染检出组患者住院时间明显缩短。感染患者病情严重程度与病原体检出率呈正相关。单因素分析发现检出组患者外周血白细胞、中性粒细胞、C反应蛋白、降钙素原均高于未检出组,检出组中促炎因子 (肿瘤坏死因子α、IL-2R、IL-8) 水 平 均 高 于 未 检 出 组。logistic多因素回归分析去除混杂因素后,性别(男)、年龄、IL-2R 与病原体检出阳性有关。
其次,由于病原体DNA 在血浆中的存活时间长,抗生素的使用对m NGS结果影响较小,而传统培养物受抗生素使用的影响大,检测困难。m NGS早期快速报告结果,可以给临床提供下一步诊断和治疗的线索,尤其是病毒感染时,避免了抗生素的过度使用[10-11],其结果和笔者课题结果类似。最后,Miao等[7]研究结果显示NGS诊断感染性疾病的敏感度和特异度分别为50.7%和85.7%,敏感度高于传统培养 (35.2%),尤其是针对结核分枝杆菌、病毒、厌氧菌、诺卡菌和真菌优势明显。其结果和笔者课题结果类似,本研究结果显示m NGS的敏感度为67.53%,显著高于培养法敏感度(27.23%)。
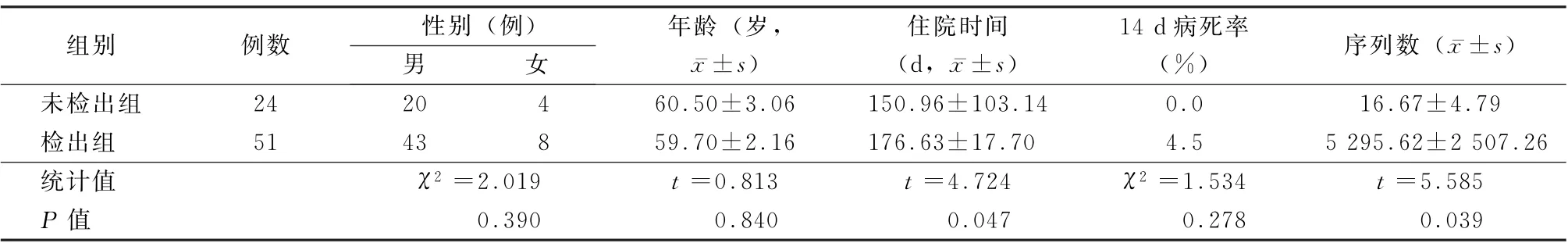
表2 未检出组和检出组患者的一般资料比较
表3 未检出组和检出组患者细胞计数及炎症相关指标的比较 (±s)
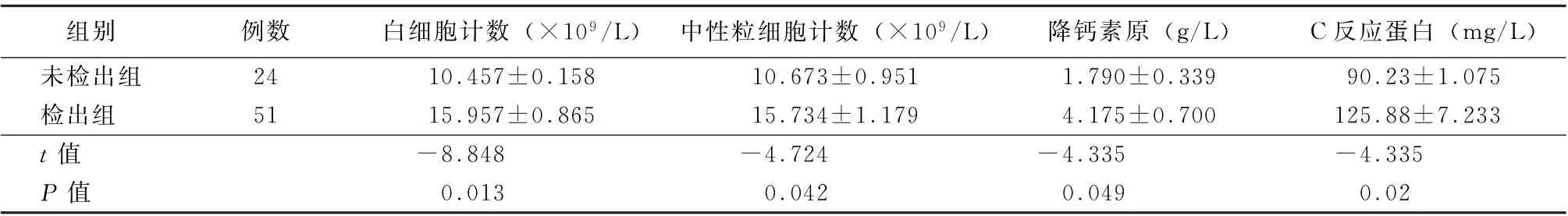
表3 未检出组和检出组患者细胞计数及炎症相关指标的比较 (±s)
组别 例数 白细胞计数 (×109/L) 中性粒细胞计数 (×109/L) 降钙素原 (g/L) C反应蛋白 (mg/L)未检出组 24 10.457±0.158 10.673±0.951 1.790±0.339 90.23±1.075检出组 51 15.957±0.865 15.734±1.179 4.175±0.700 125.88±7.233 t值 -8.848 -4.724 -4.335 -4.335 P 值 0.013 0.042 0.049 0.02
表4 未检出组和检出组患者细胞因子的比较 (ng/L,±s)
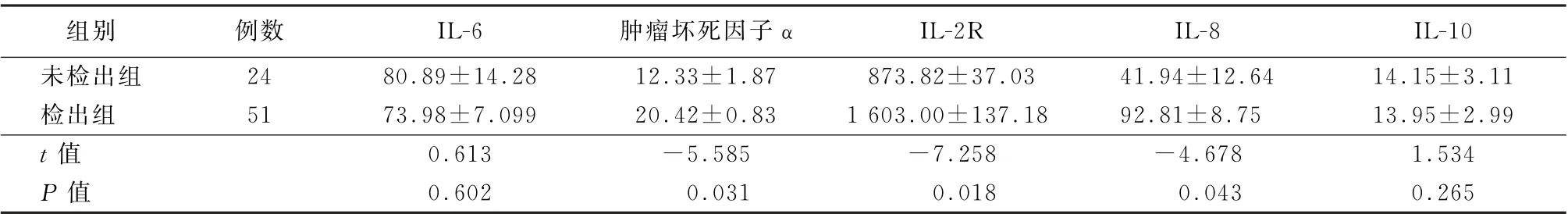
表4 未检出组和检出组患者细胞因子的比较 (ng/L,±s)
组别 例数 IL-6 肿瘤坏死因子α IL-2R IL-8 IL-10未检出组 24 80.89±14.28 12.33±1.87 873.82±37.03 41.94±12.64 14.15±3.11检出组 51 73.98±7.099 20.42±0.83 1 603.00±137.18 92.81±8.75 13.95±2.99 t值 0.613 -5.585 -7.258 -4.678 1.534 P 值 0.602 0.031 0.018 0.043 0.265
m NGS检测感染病原体不需要详细的临床信息,但报告结果快速准确,极大缩短了感染病原诊断时间。研究显示m NGS不仅可以用于病原体鉴定,还可进一步用于耐药基因和毒力因子检测。m NGS报告结果快速,能够推动临床及时调整治疗。但是,由于目前m NGS检测的可及性还较为局限,主要适用于疑难感染诊断[12]。m NGS目前仍存在一定局限性,比如人源背景、背景菌污染、无法区分感染和定植、生信分析流程标准化、报告解读问题等,需要临床充分了解其优势和局限性,以便更好地使用m NGS技术。如背景微生物的污染是m NGS技术面临的常见问题,可以通过阴性质控进行部分排除,但需要临床熟悉常见背景菌同时结合临床实践更好地解读结果[13]。
m NGS已经从科研运用进入临床实践,正在改变疾病诊断和治疗方式。Guan等[14]对4例疑似病毒性脑膜脑炎患者的脑脊液进行m NGS 检测,检出2例单纯疱疹病毒1型、1例单纯疱疹病毒2型和1例水痘-带状疱疹病毒,4 例患者的临床表现和治疗结果均与m NGS 诊断结果一致。Yao等[12]第一次应用脑脊液m NGS辅助诊断中枢神经系统单核细胞增生李斯特菌感染,脑脊液培养结果阴性。除此之外,m NGS 在一些罕见传染病原体也有应用。福氏耐格里阿米巴在中国虽然少见,Guo等[15]在脑脊液m NGS检出福氏耐格里阿米巴65 658条序列,询问病史发现患者1周前参加泼水节在接触了泼溅的湖水后开始发病,明确诊断后,临床快速调整治疗方案为两性霉素B 和抗阿米巴药物。Fan等[13]的研究中4 例怀疑布鲁菌病的患者来自疫区,但无明确的布氏杆菌流行病学接触史,临床症状表现不一,脑脊液m NGS均快速检出布氏杆菌。再比如,好多病原体培养如脑囊虫病需要长达数年,延误患者病情,Fan 等[16]使用m NGS对4例患者的脑脊液标本进行检测,均检测到猪带绦虫。31岁的人类免疫缺陷病毒感染患者因“发热、头疼20 d,意识混乱7 d”入院,Hu等[17]在传统病原学检测结果均为阴性情况下,脑脊液m NGS检出刚地弓形虫序列65 357条,基因组覆盖度为0.29%。肝结核是一种少见的肺外结核,在全球范围内鲜有报道。目前肝结核诊断线索较为缺乏,临床难以做出肝结核的诊断,m NGS可以助力罕见肝结核诊断:患者45岁,因持续发热3周和发现肝脏肿块入院,m NGS 结果回报肝组织检出结核分枝杆菌复合群特异性序列数8 229条,血液样本检测结果为阴性,抗结核治疗恢复明显,体温下降未再复发[18]。此外,m NGS 还可以协助明确诊断儿童裂头蚴病[19]。m NGS也可协助诊断非结核分枝杆菌、病毒、非人类免疫缺陷病毒患者马尔尼菲篮状菌感染和免疫缺陷患者卡氏肺孢子虫肺炎感染等[20-25]。
综上所述,目前m NGS的潜在临床运用包括病原体诊断、微生态分析、转录组分析和肿瘤诊断,在病原体诊断方面取得的进展最为显著。目前m NGS的临床运用还面临着提高结果可信度、操作标准化和实用化等挑战。
利益冲突 所有作者均声明不存在利益冲突

